De nouveaux résultats des études FIREFISH et SUNFISH indiquent qu’il existe un espoir pour les enfants atteints d’atrophie musculaire spinale.
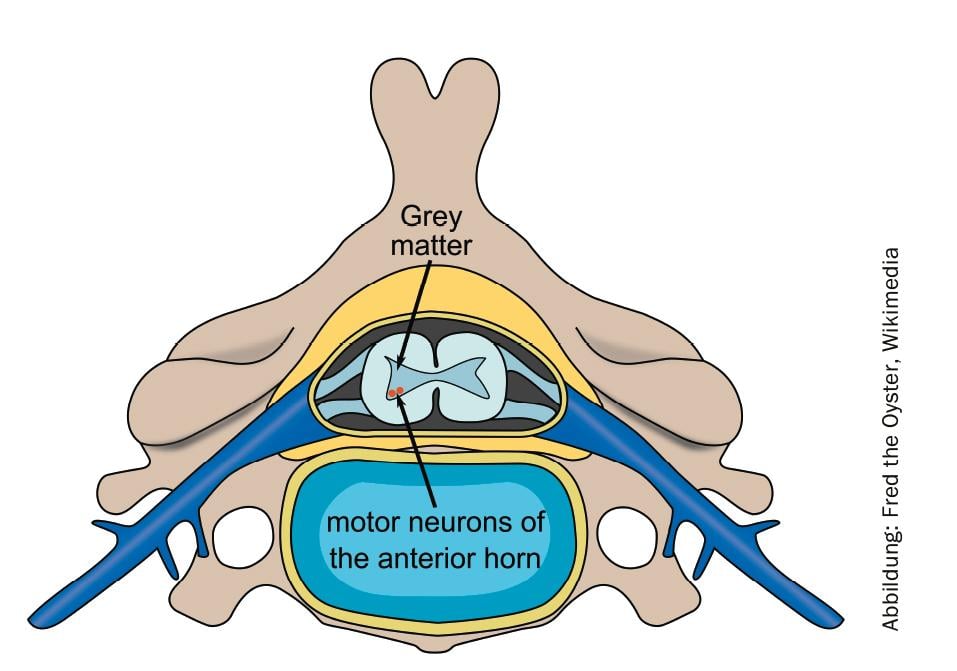
L’amyotrophie spinale (SMA) est une maladie neuromusculaire héréditaire, grave et progressive, qui entraîne une atrophie musculaire et des complications liées à la maladie. Parmi les maladies rares, la SMA est la plus fréquente, touchant environ un bébé sur 11 000. La perte progressive de cellules nerveuses dans la moelle épinière entraîne des limitations motrices dont la gravité dépend de la forme de la SMA.
Le Risdiplam est une approche thérapeutique prometteuse. Le dérivé de la pyridazine augmente la survie fonctionnelle des gènes de conservation de la vie du neurone moteur (SMN) en modifiant le schéma d’épissage. La molécule est administrée par voie orale et est actuellement étudiée dans les études FIREFISH, SUNFISH, JEWELFISH et RAINBOWFISH. Lors de la réunion annuelle de l’AAN à Philadelphie, Roche a présenté de nouveaux résultats issus de deux études.
Un pas de plus vers la thérapie orale
FIREFISH est une étude clé en deux parties et en open-label chez des enfants atteints de SMA de type 1. La première partie était une étude d’escalade de dose chez 21 enfants, dont l’objectif principal était de déterminer le profil de sécurité de Risdiplam. De plus, elle devait définir la dose pour la partie 2 (n=41). Dans le cadre de la partie 1, il est apparu que les patients traités par Risdiplam survivaient plus longtemps que les patients non traités. En outre, ils ont atteint des étapes motrices supérieures à celles attendues dans le cadre d’une évolution naturelle de la maladie. Ainsi, après 12 mois, sur 17 enfants qui avaient reçu la substance active et qui ont également été randomisés pour la partie 2, 7 enfants pouvaient s’asseoir pendant au moins cinq secondes sans assistance, 11 enfants pouvaient s’asseoir avec/sans assistance et 9 pouvaient tenir leur tête droite. Un enfant pouvait se tenir debout. Les effets secondaires comprenaient, à une fréquence décroissante, de la fièvre (52%), des infections des voies respiratoires supérieures (43%), de la diarrhée (29%), des vomissements, de la toux, de la pneumonie et de la constipation. Aucun enfant n’a eu besoin d’une trachéotomie ou d’une ventilation continue, aucun n’a perdu la capacité de déglutir. Trois enfants sont décédés au cours de l’étude, mais ces cas ne sont pas liés à Risdiplam.
Au total, 59% des patients >ont obtenu 40 points sur l’échelle CHOP-INTEND, le maximum étant de 57. L’auteur principal de l’étude, MD Giovanni Baranello de la Carlo Besta Neurological Research Institute Foundation à Milan (I), a souligné que ces résultats positifs préconisent une approche thérapeutique axée sur l’augmentation des gènes SMN dans le système nerveux central ainsi que dans l’ensemble du corps. “Nous sommes très encouragés par ces dernières découvertes concernant Risdiplam”, a également déclaré Sandra Horning, médecin-chef chez Roche et responsable du Global Product Development. “Ils nous rapprochent de la possibilité de fournir la première option thérapeutique orale à la communauté SMA”. La partie 2 de FIREFISH, qui vise à mesurer l’efficacité et inclut 41 patients, est actuellement en cours.
Préparation de l’étude d’efficacité terminée
L’étude clinique clé SUNFISH, également en deux parties, en double aveugle et contrôlée par placebo, a inclus des patients âgés de 12 à 25 ans atteints de SMA de type 2 ou de type 3. L’objectif de la partie 1 (n=51) était de déterminer la dose pour la partie 2. La partie 2 vise principalement à évaluer les capacités motrices à 12 mois, mesurées par le score Motor Function Measure 32 (MFM-32). Alors que la partie 2 (n=180) est en cours de réalisation, les résultats de la partie 1 sont disponibles.
A la ligne de base, les participants présentaient des capacités ou des limitations motrices très différentes. Certains ne peuvent plus se tenir assis, d’autres marchent encore. Chez certains, la scoliose était très prononcée, chez d’autres non.
Après 12 mois de traitement par Risdiplam, la concentration médiane de la protéine SMN dans le sang a été doublée. 43 patients ont pu participer à toutes les mesures, 58% d’entre eux s’étant améliorés de >3 points sur l’échelle MFM-32.
Les parties 2 des études FIREFISH et SUNFISH évaluent à présent l’efficacité de Risdiplam. Les résultats sont attendus au quatrième trimestre 2019 et au premier trimestre 2020.
InFo NEUROLOGIE & PSYCHIATRIE 2019 ; 17(3) : 40