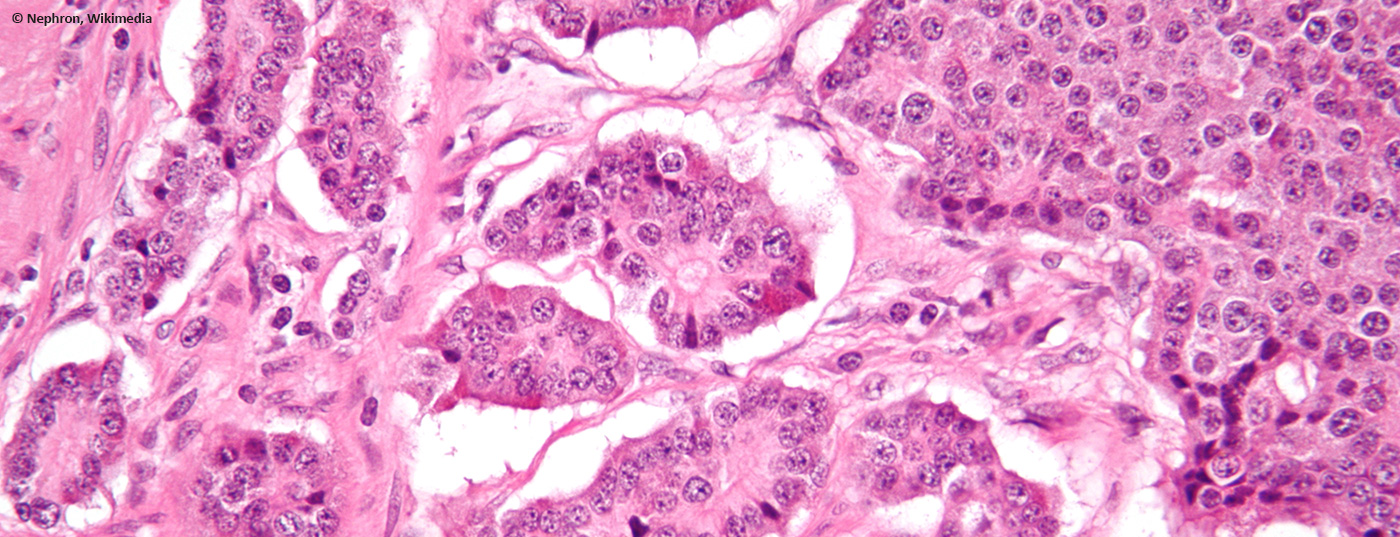
Les néoplasies neuroendocrines sont généralement sporadiques et proviennent souvent de la sphère gastro-entéro-pancréatique. En général, ils sont diagnostiqués par hasard, car ils sont souvent non fonctionnels. Par conséquent, il s’agit dans la plupart des cas d’une maladie tumorale déjà avancée, souvent métastasée.
Le terme “neuroendocrine” désigne des cellules présentant des caractéristiques histologiques du tissu glandulaire, généralement présentes de manière diffuse dans différents organes de l’organisme et capables de sécréter des hormones. Selon la fonction et la localisation, des amines (par exemple les catécholamines) ou des peptides (par exemple la somatostatine) sont produits et régulent l’activité des tissus environnants. Embryologiquement, elles ont longtemps été considérées comme faisant partie de la crête neurale, mais elles sont désormais classées dans l’endoderme, tout comme les cellules exocrines du tractus gastro-intestinal. Historiquement, ces cellules ont été regroupées dans un système neuroendocrinien diffus (autrefois également appelé APUD (“amine precursor uptake and decarboxylation”)). Cependant, comme ces termes n’ont pas de signification histopathologique ou clinique pertinente, ils ne devraient plus être utilisés.
Si ces cellules dégénèrent, on parle de néoplasie neuroendocrinienne (NEN). Ce terme générique englobe aussi bien les tumeurs neuroendocrines (TNE) à prolifération lente et les carcinoïdes du poumon que les carcinomes neuroendocrines (CNE), nettement plus agressifs et au pronostic défavorable. Toutes les recommandations de cet article seront donc basées sur cette classification.
Les néoplasies neuroendocrines surviennent généralement de manière sporadique, avec une incidence estimée à environ 5/100 000 habitants. Une accumulation familiale peut être observée dans les néoplasies endocriniennes multiples (MEN) I et II ainsi que dans des maladies rares comme le syndrome de von Hippel-Lindau ou la neurofibromatose de type 1 (Recklinghausen). La plupart des NEN proviennent de l’espace gastro-entéro-pancréatique (GEP-NEN), environ 25-30% proviennent des poumons [1].
Symptômes
Bien que la production d’hormones soit une caractéristique typique des néoplasies neuroendocrines, les tumeurs dites fonctionnelles – c’est-à-dire les tumeurs dont la production et la sécrétion d’hormones entraînent des symptômes – sont rares. Les troubles causés par les tumeurs fonctionnelles dépendent de la sécrétion respective de substances bioactives. Les insulinomes ou les gastrinomes, qui représentent la majeure partie de ces NEN fonctionnels, entraînent par exemple des hypoglycémies graves, potentiellement mortelles, ou des ulcérations gastriques multiples (syndrome de Zollinger-Ellison). Un autre tableau clinique typique est le syndrome carcinoïde, dans lequel une sécrétion excessive de sérotonine peut entraîner des diarrhées aqueuses sévères, une symptomatologie de flush et des bronchospasmes. Une complication tardive peut être une fibrose de l’endocarde, ce qui peut entraîner une insuffisance cardiaque avec une issue fatale (syndrome de Hedinger).
Cependant, jusqu’à 90% des NEN ne sont pas fonctionnels et sont diagnostiqués soit comme une découverte fortuite, soit dans le cadre de plaintes non spécifiques. Dans la plupart des cas, il s’agit d’une maladie tumorale avancée, déjà métastasée, en raison de son évolution indolente.
Diagnostic
Dans tous les cas, une biopsie est nécessaire pour confirmer le diagnostic. Le traitement histopathologique doit inclure la détermination des marqueurs typiques (synaptophysine, récepteurs de la somatostatine [SSTR]) et impérativement le taux de prolifération (Ki-67 ou MIB-1) ou le taux de mitose, car ils ont une importance considérable, tant sur le plan pronostique que thérapeutique. En cas de suspicion de syndrome carcinoïde, le dosage de l’acide 5-hydroxy-indolacétique (5-HIESS, un produit de dégradation de la sérotonine) dans les urines de 24 heures est diagnostique. D’autres valeurs de laboratoire prélevées à jeun, telles que la chromogranine A (CgA) et, le cas échéant, l’énolase spécifique des neurones (NSE), peuvent être utilisées comme marqueurs tumoraux. Selon la clinique, d’autres tests sont utilisés (par exemple, le test de jeûne dans le cas de l’insulinome). Une nouvelle méthode doit également être mentionnée ici comme perspective d’avenir : le “NETest” [2]. Il s’agit d’un diagnostic par PCR sur sang total (“liquid biopsy”), qui permet d’examiner 51 brins d’ARNm spécifiques de la NET. La valeur prédictive positive pour le diagnostic de néoplasie neuroendocrinienne est supérieure à 90%, tout comme la sensibilité et la spécificité. Les premiers rapports ont démontré son utilité à la fois pour le diagnostic et pour le suivi de la réponse au traitement. Mais pour l’instant, ce NETest n’est pas encore largement disponible.
Imagerie
En plus de l’imagerie habituelle, l’imagerie fonctionnelle de la médecine nucléaire joue un rôle crucial, à la fois dans le staging et en ce qui concerne le choix du traitement. Il s’agit avant tout de la TEP/TDM au DOTATE 68Ga, qui n’a cessé de remplacer ces dernières années la scintigraphie à l’octréotide, moins précise et plus coûteuse [3]. Grâce à cet examen TEP nettement plus sensible, il n’est pas rare de constater un upstaging par la mise en évidence de métastases invisibles au scanner. De plus, cela permet de détecter l’expression fréquente de SSTR2 à la surface des cellules des TNE, et donc d’évaluer l’utilisation éventuelle d’une thérapie par radionucléides (PRRT, voir ci-dessous). En cas d’indice de prolifération élevé ou d’absence d’expression de SSTR2 ou d’expression hétérogène, il est utile de réaliser en plus une TEP/TDM au FDG [4], car les lésions avides de FDG indiquent un comportement plus agressif et doivent, si possible, faire l’objet d’un examen biopsique supplémentaire.
Nouvelle classification de l’OMS
Au cours des dernières décennies, la classification des néoplasies neuroendocrines a connu des changements considérables grâce aux nouvelles connaissances histopathologiques et cliniques (tableau 1). La classification actuelle de l’OMS (2017) a notamment pris en compte la discordance histopathologique (indice de prolifération élevé, taux de croissance élevé) des NEN du pancréas (nouveau : panNEN).
mais faible taux de mitoses) et les caractéristiques cliniques (pronostic) sont prises en compte. Il en résulte une subdivision en NET G1, NET G2, NET G3 et NEC G3. Depuis la classification de 2010, le terme “carcinoïde” ne doit être utilisé que pour les TNE pulmonaires (tableau 2).

Traitement des NET non métastatiques et suivi
La seule option potentiellement curative pour les néoplasies neuroendocrines est l’ablation complète de la tumeur. Dans le tractus gastro-intestinal, elle peut être réalisée par endoscopie en fonction de la taille (jusqu’à 2 cm) et du situs. L’indication d’une résection chirurgicale doit toutefois être posée à bas seuil lorsqu’il existe des indices d’une infiltration de la muscularis propria (T2) ou de métastases ganglionnaires [5]. Les NET de l’appendice constituent une situation particulière. Dans la grande majorité des cas, il s’agit d’une découverte fortuite après une appendicectomie. La décision de réaliser une hémicolectomie droite complémentaire avec lymphadénectomie dépend de la taille de la tumeur (>2 cm), de la profondeur de pénétration (>3 mm) dans le mésoappendice, et de l’invasion vasculaire (V1) ou lymphatique (L1) [6].
Contrairement à d’autres entités tumorales, il n’y a pas d’indication de traitement adjuvant pour les tumeurs neuroendocrines. Un suivi régulier avec des endoscopies annuelles en cas de TNE de l’estomac ou du rectum est recommandé. Pour les TNE localement avancées, mais complètement enlevées chirurgicalement, une imagerie annuelle (généralement un scanner thoraco-abdominal avec produit de contraste i.v.) doit être réalisée à vie.
Option thérapeutique pour les NEN métastatiques
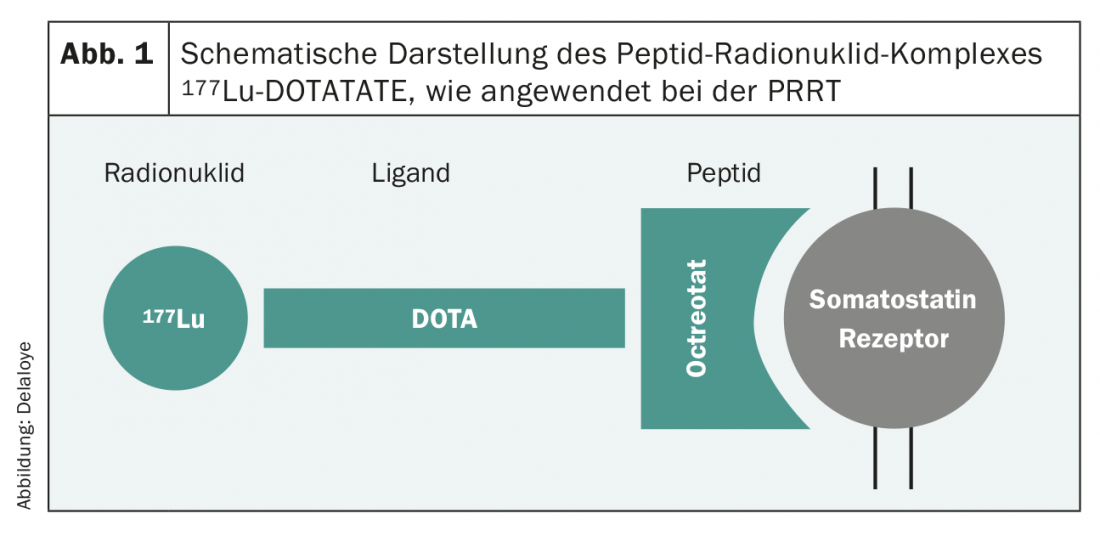
De nouveaux développements au cours de la dernière décennie ont amélioré de façon spectaculaire le paysage thérapeutique et, par conséquent, la survie des patients. Le nombre d’études de phase III pertinentes pour la pratique s’est développé de manière quasi exponentielle et les recommandations des sociétés savantes reposent sur des preuves de plus en plus solides. En principe, les options thérapeutiques pour les tumeurs G1 et G2 sont très similaires. Dans cette population de patients, une attention particulière doit être accordée aux effets secondaires du traitement, car il s’agit généralement de patients asymptomatiques. Dans les tumeurs exprimant SSTR2, de nombreuses études ont établi l’utilisation d’analogues de la somatostatine en première ligne [7,8], même dans les tumeurs non fonctionnelles. Ce traitement, généralement bien toléré, permet souvent d’obtenir un bon contrôle de la tumeur et donc de prolonger la survie sans progression. La thérapie par radionucléide récepteur de peptide (PRRT) est une autre option. Une procédure dans laquelle une substance radioactive (90Yttrium ou 177Lutetium) liée à un peptide affineur du récepteur de la somatostatine (octréotide/octréotate) (Fig. 1) est administrée par perfusion intraveineuse et permet une irradiation ciblée des cellules tumorales SSTR2-positives. Ce traitement est généralement appliqué quatre fois de suite, à huit semaines d’intervalle. Là encore, il s’agit d’un traitement qui est généralement très bien toléré et dont les résultats ont été démontrés il y a quelques années dans une vaste étude de phase III [9].
Au niveau moléculaire, l’utilisation de l’évérolimus comme inhibiteur de mTOR s’est établie. Le mécanisme de prolifération cellulaire autour de la voie PI3K-mTOR joue un rôle important dans les néoplasies neuroendocrines, comme dans d’autres tumeurs. Ainsi, l’évérolimus permet d’obtenir un bon contrôle de la tumeur [10], mais ce traitement est associé à beaucoup plus d’effets secondaires.
La chimiothérapie est également utilisée pour les TNE G2 à prolifération plus élevée et les TNE G3. Dans une étude de phase II, une activité antitumorale de la capécitabine et du témozolomide (CapTem) a été démontrée dans cette cohorte de patients [11]. Bien que les données de phase III fassent encore défaut, ce traitement a fait ses preuves dans la pratique et s’est rapidement imposé comme une alternative à l’ancienne combinaison de streptozotocine et de 5-fluorouracile (STZ+5FU). Le profil d’effets secondaires est également favorable et l’utilisation est simple.
Les néoplasies neuroendocrines de haut grade (notamment la NEC G3) sont traitées par une combinaison de platine et d’étoposide, de manière analogue au traitement des cancers bronchiques à petites cellules. Les nouvelles thérapies utilisant des inhibiteurs de points de contrôle n’ont eu que peu de succès jusqu’à présent et ne peuvent généralement pas être recommandées. Ils doivent être étudiés plus avant dans le cadre d’essais cliniques.
Messages Take-Home
- Les cellules présentant les caractéristiques histologiques du tissu glandulaire, généralement présentes de manière diffuse dans différents organes de l’organisme et capables de sécréter des hormones, sont appelées “neuroendocrines”. Si elles dégénèrent, on parle de néoplasie neuroendocrinienne (NEN).
- La plupart des NEN proviennent de la région gastro-entéro-pancréatique, et environ 25 à 30 % proviennent des poumons.
- Les tumeurs fonctionnelles, telles que les insulinomes ou les gastrinomes, sont rares, mais elles entraînent alors des hypoglycémies graves, potentiellement mortelles, ou des ulcérations gastriques multiples.
- Cependant, en règle générale, les NEN ne sont pas fonctionnels et sont diagnostiqués soit comme une découverte fortuite, soit dans le cadre de plaintes non spécifiques.
- La seule option potentiellement curative pour les néoplasies neuroendocrines non métastatiques est l’ablation complète de la tumeur. Contrairement à d’autres entités tumorales, il n’y a pas d’indication de traitement adjuvant pour les tumeurs neuroendocrines.
- Les options thérapeutiques pour les NEN métastatiques se sont considérablement améliorées. Pour les tumeurs exprimant SSTR2, l’utilisation d’analogues de la somatostatine s’est établie. Les néoplasies neuroendocrines de haut grade sont traitées par une combinaison de platine et d’étoposide, de manière analogue au traitement des cancers bronchiques à petites cellules.
Littérature :
- Cives M, et al : CA Cancer J Clin 2018 ; 68 : 471-487
- Modlin IM, et al : Endocr Relat Cancer 2014 ; 21(4) : 615-628
- Deppen A, et al : J Nucl Med 2016 ; 57(6) : 872-878
- Kayani I, et al : Cancer 2008 ; 112(11) : 2447-2455
- Delle Fave G, et al : Neuroendocrinology 2016 ; 103(2) : 119-124
- Pape UF, et al : Neuroendocrinology 2016 ; 103(2) : 144-152
- Rinke A, et al : J Clin Oncol 2009 ; 27(28) : 4656-4663
- Caplin ME, et al : N Engl J Med 2014 ; 371(3) : 224-233
- Strosberg J, et al : N Engl J Med 2017 ; 376(2) : 125-135
- Yao J, et al : Lancet 2016 ; 387 : 968-977
- Strosberg JR, et al : Cancer 2011 ; 117(2) : 268-275
InFo ONKOLOGIE & HÉMATOLOGIE 2019 ; 7(1) : 16-18