L’utilisation des quatre tests multigrades MammaPrint, Oncotype DX, EndoPredict et Prosigna peut être utile pour décider d’une chimiothérapie adjuvante. Chez quelles patientes doivent-ils être utilisés en particulier ?
Au cours des dernières décennies, la mortalité due au cancer du sein a heureusement diminué. Les raisons en sont le diagnostic plus précoce des cancers du sein, les nouvelles substances et également l’utilisation fréquente de la chimiothérapie adjuvante. La question se pose maintenant de savoir si l’on pourrait désescalader le traitement chez certaines patientes [1].
Décision basée sur des facteurs de risque cliniques et pathologiques
Jusqu’à présent, la décision de savoir quelle patiente devait recevoir ou non une chimiothérapie adjuvante était prise en fonction de facteurs de risque cliniques et pathologiques tels que la taille de la tumeur, le statut des ganglions lymphatiques, le grade de la tumeur, le taux de prolifération, l’expression des récepteurs hormonaux et le statut Her2.
Dans le cas des carcinomes triplégatifs (“basal-like”) et des tumeurs Her2-positives, il est indiscutable qu’une chimiothérapie adjuvante doit être administrée. Ils ont généralement un taux de prolifération élevé et ont tendance à se développer de manière plus agressive. Les deux groupes répondent généralement bien à la chimiothérapie.
La décision est un peu plus difficile à prendre pour les tumeurs lumineuses A bien différenciées et positives pour les récepteurs d’œstrogènes (RE) et les tumeurs lumineuses B moins bien différenciées et positives pour les RE, qui sont plus difficiles à distinguer les unes des autres. Jusqu’à présent, on utilisait le taux de prolifération, déterminé à l’aide d’un immunomarquage KI-67 pas toujours fiable, pour les distinguer.
Tests d’expression multigénique
Pour pouvoir déterminer avec une plus grande certitude quelle patiente doit recevoir une chimiothérapie en plus d’un traitement antihormonal dans le grand groupe des cancers du sein à récepteurs hormonaux positifs, il est donc nécessaire de pouvoir pronostiquer le risque de manière plus précise et individuelle.
Ainsi, il y a une vingtaine d’années, le développement de puces à ADNc a permis d’étudier plus précisément l’expression génétique des tumeurs. Ces tableaux ont permis de déterminer l’expression d’environ 500 gènes simultanément. Ils ont découvert que les différents types biologiques de carcinomes mammaires pouvaient également être distingués les uns des autres sur la base du modèle d’expression génétique.
Sur la base de ces études, des tests d’expression multigénique ont été développés pour une utilisation de routine en clinique. Ces tests se limitent aux gènes les plus importants, nécessaires pour distinguer les différents types de tumeurs en termes de pronostic, et permettent de prendre des décisions thérapeutiques individuelles.
Quatre tests d’expression multigénique de ce type sont désormais disponibles en Suisse (tableau 1) [2–4]:
- MammaPrint : le test est effectué de manière centralisée sur du matériel tumoral congelé ou fixé au formol et examine l’expression de 70 gènes. MammaPrint distingue un risque pronostique faible d’un risque pronostique élevé.
- Oncotype DX : le test est effectué de manière centralisée aux États-Unis sur du matériel inclus en paraffine et examine l’expression de 21 gènes. Il est pronostique pour le risque de récidive au cours des cinq premières années et donne une valeur numérique entre 0 et 100 (“recurrence score”) comme mesure du risque de récidive. Sur la base de l’Oncotype DX, il est également possible de tirer des conclusions sur l’efficacité des chimiothérapies [2,3].
- EndoPredict : le test est réalisé de manière décentralisée, y compris en Suisse, sur des tissus fixés au formol ou inclus en paraffine, teste l’expression de l’ARNm de 12 gènes et intègre des paramètres clinico-pathologiques (taille de la tumeur, nombre de ganglions lymphatiques axillaires atteints). Il ne s’agit donc pas d’un simple test génétique. La valeur pronostique pour la prédiction des métastases précoces et tardives est validée.
- Prosigna : le test examine l’expression de 50 gènes et peut être effectué localement si le laboratoire est équipé. Il a été développé pour déterminer le sous-type biologique, mais il a également une valeur pronostique en permettant d’estimer le risque individuel de récidive de la patiente.
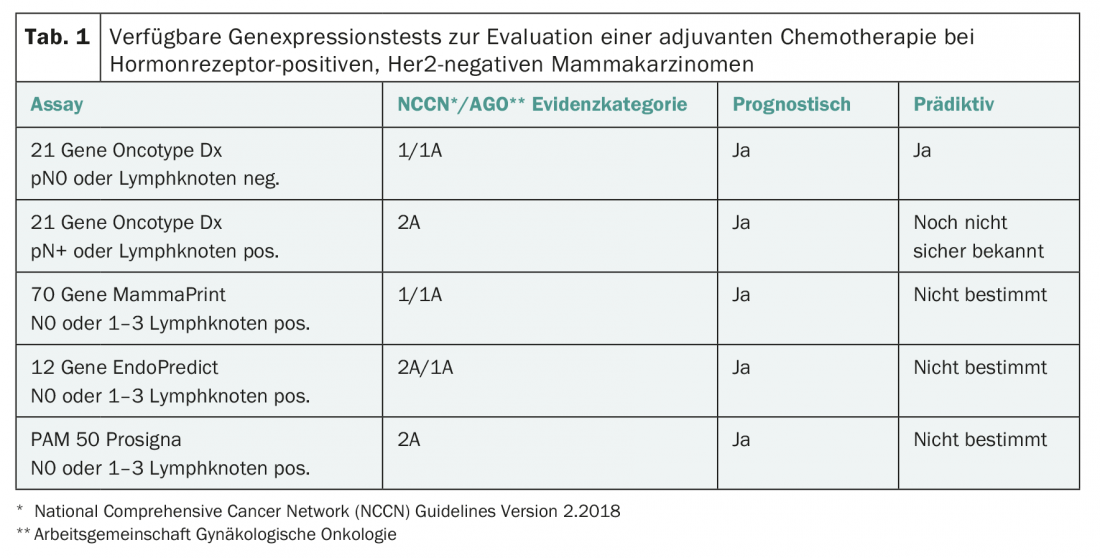
La valeur pronostique des quatre tests a été démontrée dans des études rétrospectives. Des données prospectives sont désormais disponibles pour Oncotype DX et MammaPrint (TAILORx, Mindact [5,6]). Les quatre tests sont recommandés comme tests pronostiques par les directives internationales (directives ASCO, ESMO, AGO, Consensus de St. Gall [1]) et sont désormais remboursés par les caisses d’assurance maladie. Cependant, il n’y a pas de corrélation à 100% entre les résultats des différents tests. Ainsi, en comparant EndoPredict et Oncotype DX, on a trouvé une concordance des résultats, certes significative mais plutôt modérée, de 76% [7].
Quand la chimiothérapie est-elle utile ?
La question se pose maintenant de savoir pour quel groupe à risque, défini par un tel test d’expression génétique, une chimiothérapie adjuvante est judicieuse. Cette question est examinée dans les études TAILORx et Mindact actuellement publiées.
L’étude TAILORx [5] est une étude prospective réalisée avec le test du gène 21, Oncotype DX. 10 273 femmes atteintes d’un cancer du sein Her2-négatif avec récepteurs hormonaux positifs et sans atteinte ganglionnaire ont été incluses. Le résultat du test fournit un “score de récidive” (RS) compris entre 1 et 100, une valeur comprise entre 1 et 11 prédisant un faible risque de récidive pour lequel aucune chimiothérapie n’est indiquée, et une valeur >25 indiquant un risque élevé pour lequel une chimiothérapie semble appropriée. L’incertitude régnait chez les femmes présentant un risque moyen compris entre 11 et 25, ce qui concerne la majorité des patientes (69%). Ce groupe de 9719 femmes a été randomisé en deux bras d’étude, avec et sans chimiothérapie. Toutes les patientes ont reçu un traitement antihormonal adjuvant. La période d’observation a été de neuf ans en moyenne. Après cette période, les deux groupes de traitement avaient des taux de survie sans maladie similaires, à savoir 83,3% dans le groupe traité exclusivement par antihormones et 84,3% dans le groupe ayant reçu une chimiothérapie supplémentaire. Il n’y avait pas de différence en termes de survie globale (93,9% vs 93,8%), en particulier chez les femmes de plus de 50 ans. Chez les patientes de plus de 50 ans et avec un RS de 0-25, on peut donc supposer que la chimiothérapie n’apporte aucun bénéfice supplémentaire. Chez les patientes plus jeunes, en particulier celles ayant un RS de 21-25, environ 6,5% ont bénéficié de la chimiothérapie.
L’étude Mindact [6] a été menée avec la signature de 70 gènes MammaPrint. Ce test distingue les tumeurs à faible risque génétique des tumeurs à haut risque génétique d’apparition de métastases à distance après cinq et dix ans. Mindact est une étude de phase III qui évalue l’utilité d’un microarray (MammaPrint) en tant qu’information supplémentaire sur les facteurs de risque cliniques dans la décision individuelle de recourir à une chimiothérapie adjuvante. Chez 6693 femmes, le risque génétique a été déterminé à l’aide de MammaPrint et le risque clinique à l’aide d'”Adjuvant Online” en tenant compte des facteurs de risque classiques. En cas de concordance entre le risque clinique et le risque génétique, le traitement était clair : les patientes présentant un faible risque génétique et un faible risque clinique ne recevaient pas de chimiothérapie et les patientes présentant un risque génétique élevé et un risque clinique élevé recevaient une chimiothérapie. Les patientes présentant un risque discordant, c’est-à-dire un risque génétique élevé et un risque clinique faible ou l’inverse, ont été randomisées en deux groupes de traitement avec ou sans chimiothérapie en plus du traitement antihormonal. Il s’est avéré que l’administration d’une chimiothérapie ne faisait pas de différence significative en termes de survie sans maladie dans les groupes discordants. Si l’on considère le groupe de 1 550 patientes à haut risque clinique et à faible risque génétique, on constate une différence de 1,5% seulement en faveur de la chimiothérapie en ce qui concerne la survie sans récidive à distance (“distant recurrence free survival”, DRFS) à cinq ans. Les patientes présentant un risque clinique faible et un risque génétique élevé n’ont pas bénéficié de la chimiothérapie en termes de DRFS. Ainsi, la conclusion que l’on peut tirer de cette étude est que l’on ne devrait proposer un test génétique qu’aux patientes à haut risque clinique et que l’on pourrait alors épargner la chimiothérapie aux patientes à faible risque génétique, à moins que les patientes n’insistent pour suivre une chimiothérapie afin de minimiser le risque de récidive de 1,5% supplémentaire. Mais ces patientes n’ont alors pas besoin d’un test génétique.
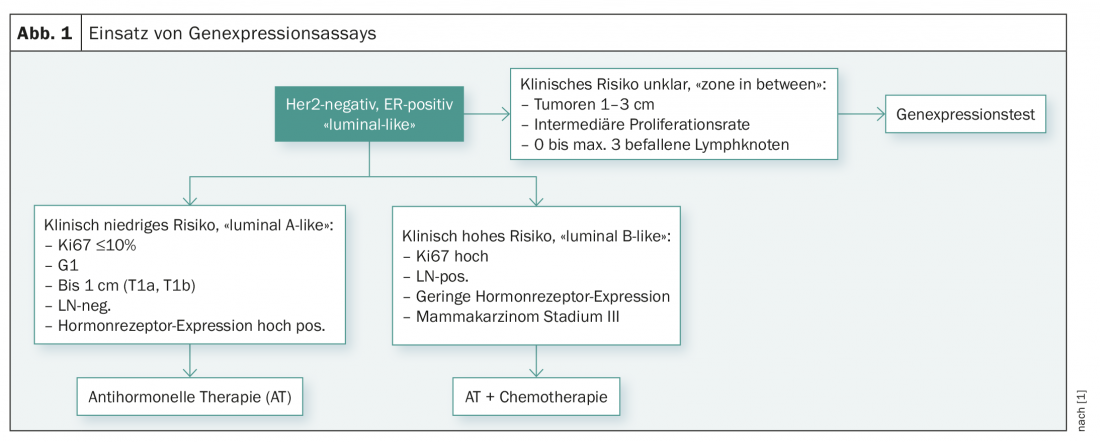
Réunion de consensus de Saint-Gall 2017
Lors de la réunion de consensus de Saint-Gall de 2017 à Vienne, ces études et l’utilisation de tests multigénérationnels ont également été discutées [1]. Pour l’instant, les experts ont considéré que les tests génétiques n’étaient indiqués que pour répondre à la question de savoir si une patiente avait besoin ou non d’une chimiothérapie adjuvante. Conformément aux recommandations actuelles du consensus, aucun test génétique ne devrait être effectué en cas de risque clinique faible (pT1a/b, G1, ER élevé, N0, faible taux de prolifération) et en cas de risque clinique clairement élevé (faible expression des récepteurs hormonaux, G3, taux de prolifération élevé, atteinte de nombreux ganglions lymphatiques ou au stade III). Le comité d’experts a estimé que la réalisation de tests génétiques ne s’imposait que chez les patientes dont le profil de risque clinique n’était pas tout à fait clair (taille de la tumeur 1-3 cm, atteinte de 0-3 ganglions lymphatiques axillaires et taux de prolifération intermédiaire) (fig. 1).
Littérature :
- Curigliano G, et al : De-escalating and escalating treatments for early-stage breast cancer : the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Annals of Oncology 2017 ; 28 : 1700-1712.
- Paik S, et al : A Multigene Assay to Predict Recurrence of Tamoxifen-Treated, Node-Negative Breast Cancer. N Engl J Med 2004 ; 351(27) : 2817-2826.
- Paik S, et al : Expression des gènes et bénéfice de la chimiothérapie chez les femmes atteintes d’un cancer du sein Node-Negative, Estrogen Receptor-Positive. J Clin Oncol 2006 ; 24 : 3726-3734.
- Markopoulos C, et al. : Preuves cliniques à l’appui des tests génomiques dans le cancer du sein précoce : tous les tests génomiques fournissent-ils les mêmes informations ? EJSO 2017 ; 43 : 909-920.
- Sparano JA, et al : Chimiothérapie adjuvante guidée par un test d’expression de 21 gènes dans le cancer du sein. N Engl J Med 2018 ; 379 : 111-121.
- Cardoso F, et al : 70-Gene Signature as an Aid to Treatment Decisions in Early-Stage Breast Cancer. N Engl J Med 2016 ; 375(8) : 717-729.
- Varga Z, et al : Comparaison des résultats du test EndoPredict et Oncotype DX dans le cancer du sein invasif à récepteurs hormonaux positifs. PLOS ONE 2013 ; 8(3) : e58483.
- Lux MP, et al : Budget Impact analysis of gene expression tests to aid Therapy decisions for breast cancer patients in Germany. The Breast 2018 ; 37 : 89-98.
Littérature complémentaire :
- Sørlie T, et al : Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. PNAS 2001 ; 98(19) : 10869-10874.
InFo ONKOLOGIE & HÉMATOLOGIE 2018 ; 6(6) : 26-29