Le volume des prescriptions de psychotropes augmente rapidement dans de nombreux segments. La prescription de psychotropes fait donc partie du quotidien, non seulement dans la pratique psychiatrique, mais aussi dans la pratique de la médecine générale. Que faut-il prendre en compte ?
La prescription de psychotropes fait partie du quotidien des médecins généralistes, et pas seulement des psychiatres. Les substances de ce groupe peuvent être utilisées pour traiter des troubles psychiques tels que la dépression, l’anxiété ou la schizophrénie, mais aussi pour traiter la douleur, les troubles du sommeil ou d’autres maladies psychosomatiques. En 2017, selon Interpharma, les médicaments contre les maladies du système nerveux central représentaient la plus grande part de marché de tous les médicaments distribués en Suisse, soit 16,3% [1].
Le volume des prescriptions de psychotropes augmente rapidement dans de nombreux segments : par exemple, les prescriptions d’antidépresseurs ont augmenté de plus de 40% au cours des dix dernières années. Dans ce contexte, la prescription d’ISRS (deux fois) et d’IRSN (trois fois) est en plein essor, tandis que la prescription d’antidépresseurs plus anciens tels que les tricycliques ou les inhibiteurs de la MAO est en baisse. Parmi les antipsychotiques, ce sont surtout les atypiques qui sont plus souvent prescrits (>60%), tandis que les typiques à forte puissance sont en légère baisse. La prescription de psychostimulants est à peu près constante et celle des tranquillisants est en baisse. Environ un tiers de toutes les prescriptions de psychotropes proviennent de médecins généralistes [2].
Le médecin généraliste joue un rôle clé dans la psychopharmacothérapie, puisqu’il connaît le mieux le patient dans l’ensemble de ses souffrances physiques et psychiques, qu’il peut identifier les contre-indications à la médication, comme par exemple une fonction rénale réduite, ou qu’il peut anticiper les interactions possibles en cas de polymédication. Il est également souvent le premier interlocuteur lorsque son patient souffre d’un burnout, de troubles de la concentration ou de démence. Le seuil d’inhibition pour une consultation chez le médecin généraliste est généralement beaucoup plus bas pour les patients que celui pour une visite chez le psychiatre. Le diagnostic différentiel avec les affections physiques se fait également ici, car de nombreuses maladies somatiques s’accompagnent d’une prévalence élevée de maladies dépressives comorbides. Par exemple, jusqu’à 27% des patients atteints de maladies cardiovasculaires et jusqu’à 75% des patients atteints de la maladie de Parkinson présentent des signes de dépression [3,4]. Enfin, de nombreux médicaments utilisés en médecine somatique, tels que les stéroïdes ou les bêtabloquants, provoquent également des effets indésirables fréquents de la dépression, ce qui devrait être pris en compte lors de leur utilisation.
De nombreux psychotropes nécessitent des examens de contrôle des organes de métabolisation ou d’élimination : contrôles ECG pour les substances susceptibles d’allonger l’intervalle QTc, examens hématologiques par exemple lors de la prise de clozapine, contrôle du poids et recherche d’un syndrome métabolique avec de nombreux antipsychotiques ou un suivi thérapeutique (Therapeutic Drug Monitoring – TDM) pour les substances à marge thérapeutique étroite comme le lithium. En règle générale, ces examens sont effectués dans le cadre de la pratique de la médecine générale. De nombreuses recommandations de traitement et directives internes aux cliniques ont été publiées sur les examens de contrôle utiles sous psychopharmacothérapie.
Antidépresseurs
Les maladies mentales représentent une part importante – et croissante – des cas de maladie dans le monde. La prévalence ponctuelle de la population active de souffrir d’une maladie mentale à un moment donné est de 20%. Pour la seule dépression, la prévalence à 12 mois de la population en Europe est de 7,9%. Dans les 33 pays de l’OCDE, la demande d’antidépresseurs est en augmentation. Parallèlement, les taux de suicide y baissent, ce qui est attribué à la déstigmatisation des maladies mentales, à une meilleure densité des soins et à une attention accrue portée aux maladies affectives [5]. Selon l’OMS, environ 350 millions de personnes dans le monde souffrent de dépression et le suicide tue plus de 800 000 personnes par an. Les coûts socio-économiques des maladies dépressives sont immenses : aux États-Unis, ils ont été estimés à 210 milliards pour l’année 2015 [6]. Le traitement d’une dépression conforme aux lignes directrices peut être consulté dans les recommandations de traitement des sociétés spécialisées nationales. Elle dépend du degré de gravité de la maladie (légère, modérée, sévère), des symptômes associés et des antécédents médicaux de chacun [7–10].
Pour quantifier la gravité de la maladie, on peut utiliser des scores tels que le Hamilton ou le Beck-Depression-Inventory [11,12]. Les dépressions graves qui entraînent une perte totale de fonctions dans la vie quotidienne ou qui sont marquées par des tendances suicidaires doivent être traitées en milieu hospitalier.
Pour les antidépresseurs, plus la dépression est sévère, plus il est probable que la pharmacothérapie soit bénéfique. De manière très simplifiée, on pourrait dire qu’une dépression légère ne devrait pas être traitée pharmacologiquement, qu’une dépression modérée peut l’être et qu’une dépression sévère doit absolument l’être. La pharmacothérapie fait toujours partie d’un concept clinique global à long terme qui prend en compte le contexte biographique, social, somatique et psychologique. Un traitement efficace de la dépression repose sur trois piliers : la psychothérapie, la pharmacothérapie et les mesures de soutien (fig. 1). Ces dernières comprennent notamment l’exercice physique, la luminothérapie et, le cas échéant, des techniques de stimulation ou de relaxation. L’électroconvulsivothérapie (ECT) peut être utilisée lorsque la maladie est grave. Ce concept doit être communiqué au patient. Pour une observance optimale de la pharmacothérapie, il convient de noter que de nombreux effets indésirables (EI), tels que les céphalées, les nausées ou les vertiges, surviennent généralement sous antidépresseurs immédiatement après le début du traitement, qu’ils sont en général rapidement réversibles, mais que les effets souhaités n’apparaissent qu’environ 14 jours après le début du traitement.
Les principaux antidépresseurs utilisés sont les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs sélectifs de la recapture de la sérotonine et de la noradrénaline (ISRSN), plus puissants, et les antidépresseurs tricycliques, la réboxétine en tant qu’inhibiteur sélectif de la recapture de la noradrénaline (ISRN), le moclobémide en tant qu’inhibiteur réversible de la MAO-A (RIMA), le bupropion en tant qu’inhibiteur sélectif de la recapture de la noradrénaline/dopamine (ISRND) et l’agomélatine, un agoniste des récepteurs 1/2 de la mélatonine et un antagoniste 5-HT-2C. La vortioxétine, qui agit principalement par inhibition du transporteur de la sérotonine (5 HT), a été ajoutée. Nous disposons également de la miansérine et de la trazodone, des antidépresseurs de deuxième génération. La kétamine en tant qu’antagoniste du NMDA est utilisée “off label” pour le traitement aigu des dépressions sévères.
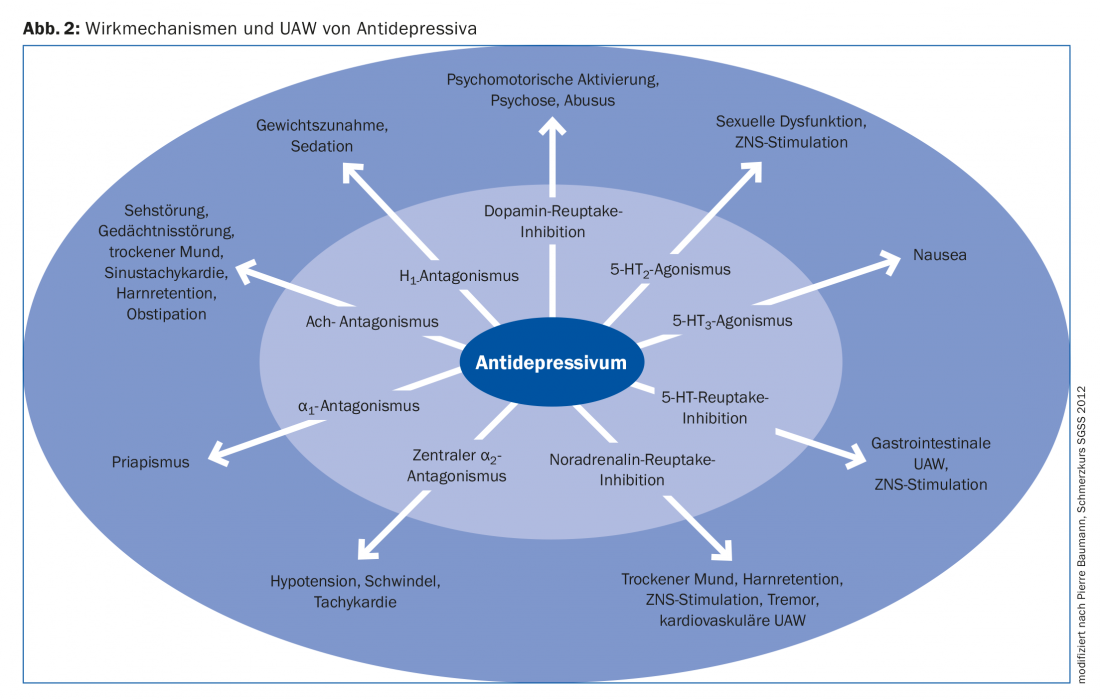
Le choix de l’antidépresseur se fait en fonction de l’anamnèse individuelle du patient, des symptômes associés à la dépression et de l’expérience du médecin. La connaissance précise du mécanisme d’action de chaque substance peut être utile à cet égard : Selon le système visé, il est possible d’évaluer le spectre d’action du médicament et de prévoir les éventuels effets indésirables. (Fig. 2). Par exemple, un patient dépressif souffrant de troubles du sommeil se verra plutôt prescrire de la trazodone, de l’amitriptyline ou de la mirtazapine en tant que somnifère, un patient obèse ne se verra pas prescrire de mirtazapine en raison de la fréquence des prises de poids significatives et un patient âgé ne se verra pas prescrire un tricyclique anticholinergique.
Est-il utile de prendre des antidépresseurs ?
Malgré une fréquence de prescription élevée et une longue expérience clinique de leur efficacité, l’utilisation des antidépresseurs est toujours remise en question. Des voix critiques remettant totalement en question l’efficacité des antidépresseurs et l’attribuant à des erreurs méthodologiques dans la conduite des études se sont élevées il y a environ dix ans [13].
Une nouvelle méta-analyse sur l’efficacité de 21 antidépresseurs, portant sur 116 477 patients déprimés dans 522 essais cliniques, a montré que le traitement antidépresseur est clairement supérieur à l’effet placebo. Les critères d’évaluation primaires étaient ici l'”efficacy” (taux de réponse des patients avec >50% de réduction sur une échelle de dépression) et l'”acceptability” (mesurée par la proportion de patients qui ont arrêté le traitement). Les critères d’évaluation secondaires étaient le score de dépression après traitement, le taux de rémission et l’abandon pour cause d’EI. La méta-analyse prend également en compte de nombreuses comparaisons individuelles de substances actives entre elles. En termes d’efficacité, c’est surtout l’amitriptyline qui s’est révélée efficace, avec un OR de 2,13 (IC à 95% : 1,89-2,41) contre placebo, suivie par la mirtazapine et l’IRSN. Dans les comparaisons individuelles, l’agomélatine, l’amitriptyline, l’escitalopram, la mirtazapine, la paroxétine, la venlafaxine et la vortioxétine étaient plus efficaces que les autres antidépresseurs (ORs 1,19-1,96). En ce qui concerne l’acceptabilité, l’agomélatine, le citalopram, l’escitalopram, la fluoxétine, la sertraline et la vortioxétine se sont avérés, sans surprise, supérieurs aux autres substances. Les tricycliques ont présenté les taux d’interruption de traitement les plus élevés [14].
Les antidépresseurs dans le traitement de la douleur
Les psychotropes ont également une place de choix dans la médecine somatique. La douleur neuropathique touche environ 8% de la population. Le traitement est souvent exigeant, multimodal et interdisciplinaire. Des techniques thérapeutiques, pharmacologiques et interventionnelles sont utilisées à cet effet. Les substances pharmacologiques de première ligne pour le traitement de la douleur neuropathique sont les antidépresseurs et les antiépileptiques. Ainsi, les antidépresseurs tricycliques amitriptyline, clomipramine, imipramine et trimipramine sont également autorisés en Suisse pour l’indication “états douloureux chroniques”. Du point de vue physiopathologique, cela a du sens, car ces substances peuvent influencer l’activité spinale et donc le traitement de la douleur dans la modulation top-down des efférences descendantes [15]. Ainsi, l’amitriptyline est la substance qui a le plus faible NNT (Number Needed to Treat) dans la douleur neuropathique périphérique, devant les antiépileptiques, les opioïdes et la gabapentine [16]. En outre, il existe un grand recoupement entre la dépression et la douleur : ainsi, une dépression est diagnostiquée chez 25% de tous les patients souffrant de douleurs chroniques et, inversement, des syndromes douloureux sont présents chez >50% des patients déprimés. L’administration d’antidépresseurs dans le cadre d’un traitement multimodal de la douleur est donc judicieuse et parfaitement établie.
Anxiolytiques et sédatifs
Des substances de différents groupes sont utilisées comme sédatifs. Il s’agit classiquement des benzodiazépines, des narcotiques et des barbituriques, mais aussi des antipsychotiques, des antidépresseurs sédatifs, des opioïdes, des antihistaminiques, de la clonidine et des substances actives à base de plantes. Selon le contexte clinique, ces substances peuvent être utilisées à bon escient, à condition de prendre en compte les effets indésirables potentiellement dangereux des médicaments ou les interactions, ainsi que le développement éventuel d’une dépendance. Les benzodiazépines sont utilisées de manière rationnelle et ponctuelle dans les troubles anxieux et paniques ou dans les douleurs thoraciques aiguës. Les benzodiazépines ont un effet anxiolytique, augmentent les concentrations de GABA dans le SNC, réduisent les taux plasmatiques de catécholamines périphériques, provoquent une vasodilatation coronarienne aiguë et ont un effet prophylactique contre les arythmies. Ainsi, ils sont également utiles d’un point de vue physiopathologique dans le traitement aigu d’un infarctus du myocarde. Une utilisation à long terme, comme par exemple en cas de troubles du sommeil chroniques, ne semble pas judicieuse.
Psychostimulants et neuroenhancers
L’utilisation de psychostimulants, principalement le méthylphénidate, mais aussi la lisdexamphétamine, est répandue et en augmentation. Le TDAH touche 3 à 5 % des enfants et adolescents suisses. Parmi eux, un quart est traité par méthylphénidate. Mais le médecin n’est pas seulement consulté pour des indications médicales, mais aussi parce que les patients se sentent de plus en plus incapables de faire face aux exigences élevées de leur environnement de travail. Environ 4% des personnes actives ou en formation en Suisse ont déjà pris des médicaments sur ordonnance pour améliorer leur humeur ou leurs performances cognitives (neuroenhancement) sans indication médicale. Chez les étudiants, 7,6% ont déjà pris des médicaments sur ordonnance pour améliorer leurs performances, dont le méthylphénidate pour 4,1% des répondants. Que la prise de substances améliorant la performance soit utile ou non, le prescripteur est de plus en plus confronté à ces demandes [17,18].
Antipsychotiques
Les effets des antipsychotiques comprennent des propriétés antipsychotiques, sédatives, extrapyramidales-motrices, endocriniennes, cardiaques et métaboliques. Il existe différentes affinités entre les récepteurs des différentes substances, qui déterminent le profil d’action souhaité et indésirable. Les indications incluent la schizophrénie et les psychoses maniaques, et les substances sont également utilisées dans les états d’excitation psychomotrice, en anesthésie et comme antiémétiques. La pharmacothérapie est la pierre angulaire du traitement aigu et à long terme des maladies schizophréniques. Elle entraîne une rémission chez 17 à 78% des patients atteints pour la première fois. En cas de récidive, entre 16% et 62% des personnes concernées répondent encore, selon les études, mais des doses plus élevées sont nécessaires pour obtenir une rémission et celle-ci n’est atteinte qu’après une longue période. La complexité du traitement des patients atteints de schizophrénie s’est considérablement accrue. La forme d’administration, la dose et également les thérapies combinées dépendent du stade de la maladie (première psychose, rechute), de la gravité de la maladie et de l’expression des symptômes (symptômes positifs/négatifs) ainsi que des EI. Au stade aigu, un traitement combiné avec des benzodiazépines est souvent indiqué. Un traitement conforme aux lignes directrices est généralement entre les mains du psychiatre et peut être consulté auprès des sociétés savantes (par ex. SGPP, DGPPN, WFSBP). Le médecin généraliste est généralement étroitement impliqué dans le suivi du patient sous traitement antipsychotique, car ce groupe de substances puissantes présente de nombreux EI potentiels, souvent graves, qui doivent être recherchés de manière étroite, car ils ne sont pas toujours évidents (fig. 3).

Cas particulier : traitement antipsychotique chez les patients gériatriques
Dans la pharmacothérapie gériatrique, les antipsychotiques sont souvent utilisés comme sédatifs, voire comme somnifères. Plus de 60% des patients atteints de démence reçoivent au moins un psychotrope, principalement des antipsychotiques, dans les maisons de soins. Il en est ressorti des indices d’une morbidité et d’une mortalité accrues dues, entre autres, à des événements cardiovasculaires, des chutes, des pneumonies et des accidents ischémiques. Le risque de mortalité est multiplié par 1,5 à 1,7 dans cette population de patients, ce qui a conduit la FDA à émettre un “avertissement boîte noire”. L’indication “démence” a été supprimée pour les antipsychotiques . Les bénéfices et les risques d’une prescription d’antipsychotiques doivent être examinés avec une attention particulière à un âge avancé [19–21].
Messages Take-Home
- La psychopharmacothérapie est souvent indiquée et n’est pas seulement efficace et utile pour les maladies mentales.
- Une part importante de tous les médicaments psychotropes est prescrite dans la pratique de la médecine interne générale. Les effets indésirables des médicaments y sont également surveillés.
- Une collaboration interdisciplinaire entre les spécialistes en médecine interne générale et en psychiatrie garantit la plus grande sécurité possible pour le patient.
Littérature :
- Interpharma : marché pharmaceutique suisse. Association des entreprises pharmaceutiques suisses pratiquant la recherche. Bâle 2018.
- Schwabe U, et al. (éd.) : Rapport sur les prescriptions de médicaments 2017. Springer 2017.
- Rudisch B, Nemeroff C : Epidémiologie des comorbidités de la maladie coronarienne et de la dépression. Biol Psychiatry 2003 Aug 1 ; 54(3) : 227-240.
- McDonald WM, et al : Prévalence, étiologie et traitement de la dépression dans la maladie de Parkinson. Biol Psychiatry 2003 Aug 1 ; 54(3) : 363-375.
- OCDE : Regards sur la santé 2017 : Indicateurs de l’OCDE. Publication de l’OCDE 2017.
- OMS : Prévenir le suicide : un impératif mondial. OMS 2014.
- Holsboer-Trachsler E, et al. : Le traitement somatique des troubles dépressifs unipolaires : Mise à jour 2016. Swiss Medical Forum 2016 ; 16(35) : 716-724.
- NICE-Guidelines : Depression in adults : recognition and management. Avril 2018
- Deutsche Gesellschaft für Psychiatrie, Psychotherapie und Nervenheilkunde (DGPPN) : S3-Leitlinie/Nationale Versorgungsleitlinie : Unipolare Depression. 2017.
- American Psychiatric Association : Practice Guideline for the Treatment of Patients With Major Depressive Disorder. 3ème éd. 2010.
- Hamilton M : A rating scale for depression. J Neurol Neurosurg Psychiatry 1960 ; 23 : 56-62.
- Beck AT, Ward CH, Mendelson M : Un inventaire pour mesurer la dépression. Arch Gen Psychiatry 1961 ; 4 : 561-571.
- Ioannidis JP : Efficacité des antidépresseurs : un mythe de la preuve construit à partir d’un millier d’essais randomisés ? Philos Ethics Humanit Med 2008 May 27 ; 3 : 14.
- Cipriani A, et al : Efficacité comparative et acceptabilité de 21 médicaments antidépresseurs pour le traitement aigu des adultes souffrant de troubles dépressifs majeurs : une revue systématique et une méta-analyse en réseau. Lancet 2018 Apr 7 ; 391(10128) : 1357-1366.
- Gilron I, et al : Combination pharmacotherapy for management of chronic pain : from bench to bedside. Lancet Neurol 2013 Nov ; 12(11) : 1084-1095.
- Finnerup NB, et al : Algorithme pour le traitement de la douleur neuropathique : une proposition basée sur l’évidence. Pain 2005 Dec 5 ; 118(3) : 289-305.
- OFSP : Médicaments améliorant les performances dans le cadre du neuroenhancement ainsi que sur la thématique de l’utilisation thérapeutique des médicaments contenant du méthylphénidate. 2014.
- Eckhard A : Médicaments améliorant les performances, signification, utilisation et effets. Rapport d’experts à l’attention de l’OFSP. 20 mai 2014.
- Steinberg M, Lyketsos CG : Atypical Antipsychotic use in patients with dementia : Managing safety concerns. Am J Psychiatry 2012 Sep ; 169(9) : 900-906.
- Danielsson B, et al : Antidépresseurs et antipsychotiques classés avec torsades de pointes risque d’arythmie et de mortalité chez les adultes âgés – une étude nationale suédoise. Br J Clin Pharmacol 2016 Apr ; 81(4) : 773-783.
- Gerhard T, et al : Comparative mortality risks of antipsychotic medications in community-dwelling older adults. Br J Psychiatry 2014 Jul ; 205(1) : 44-51.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(9) : 12-17