Il arrive régulièrement que le diagnostic de PPCM ne soit posé qu’au moment du choc cardiogénique, parce que l’insuffisance cardiaque s’est rapidement exacerbée ou que les symptômes ont été mal interprétés comme étant liés à la grossesse ou au post-partum. Selon une étude récente, la bromocriptine semble contribuer à la récupération de la fonction cardiaque.
Symptômes et diagnostic
Les symptômes cardinaux de la PPCM sont l’essoufflement progressif et la fatigue. Souvent, la maladie n’est diagnostiquée que tardivement, car on suppose qu’il s’agit d’un essoufflement lié à la grossesse ou d’une symptomatologie habituelle de fatigue après l’accouchement. Il n’est pas rare que la toux soit mal interprétée comme une infection broncho-pulmonaire. Il arrive régulièrement que le diagnostic de PPCM ne soit posé qu’au moment du choc cardiogénique, parce que l’insuffisance cardiaque s’est rapidement exacerbée ou que les symptômes ont été mal interprétés auparavant.
Il est difficile de distinguer les changements physiologiques en fin de grossesse, qui s’accompagnent d’une tachycardie sinusale, d’un essoufflement ainsi que d’œdèmes, d’une PPCM. Il est donc nécessaire de sensibiliser tous les médecins concernés à cette pathologie. En Allemagne, au Danemark et aux États-Unis, des évolutions très graves de la maladie sont décrites dans environ 15% des cas et la mortalité est de 2-4% [1–3]. Les cas mortels sont beaucoup plus fréquents en Afrique du Sud et en Turquie, où l’on rapporte un taux de mortalité de 15 à 24% [4,5].
En cas de suspicion de dyspnée liée à une insuffisance cardiaque, les marqueurs d’insuffisance cardiaque BNP ou NT-proBNP et la troponine T ou I enzyme cardiaque hautement sensible doivent être dosés dans le sérum. Si toutes les valeurs se situent dans la plage normale, une insuffisance cardiaque significative est pratiquement exclue. En cas de valeurs élevées, un examen plus approfondi doit être effectué. Selon les symptômes, cela peut se faire en ambulatoire chez le cardiologue ou en clinique. La procédure diagnostique la plus importante est l’échocardiographie. Si une fraction d’éjection réduite <45% est détectée pour la première fois et que les autres causes de la fonction cardiaque diminuée sont exclues, le diagnostic de PPCM est posé. D’autres diagnostics différentiels, tels que l’infarctus du myocarde ou l’embolie artérielle pulmonaire, doivent également être pris en compte.
Définition et épidémiologie
La PPCM est définie comme une insuffisance cardiaque systolique idiopathique avec une fraction d’éjection réduite <45%, qui survient dans les dernières semaines de la grossesse jusqu’à quelques mois après l’accouchement [6]. La PPCM est une pathologie à part entière et non, comme on le pense souvent, une aggravation d’une cardiomyopathie préexistante d’une autre origine. Les maladies cardiaques telles qu’une malformation cardiaque congénitale, une cardiomyopathie dilatée familiale ou une lésion cardiaque consécutive à une chimiothérapie et/ou une radiothérapie thoracique antérieures doivent être exclues. Cela n’est pas toujours possible en raison de l’absence de résultats antérieurs. Cependant, presque toutes les patientes font état d’un bien-être et d’une bonne résistance physique avant et souvent aussi pendant la grossesse. Certaines ont eu une échocardiographie normale dans le cadre d’un examen de routine antérieur, par exemple pour rechercher des palpitations ou une hypertension artérielle survenue pendant la grossesse. En cas de cardiomyopathie préexistante, les troubles liés à l’insuffisance cardiaque commencent généralement au cours de l’enfance. 1. à 2ème trimestre. La plupart des patientes atteintes de PPCM ne deviennent symptomatiques que pendant ou après l’accouchement ; à ce moment-là, la charge circulatoire augmente certes à court terme, car le volume de distribution du volume sanguin maternel diminue de manière aiguë en l’absence de circulation placentaire, mais elle diminue rapidement par rapport à la fin de la grossesse.
Il est difficile de séparer la PPCM de la myocardite. Dans une étude portant sur 1 230 patients atteints d’une cardiomyopathie d’origine indéterminée, les biopsies endomyocardiques ont permis de les distinguer les unes des autres [7]. D’autres études rapportent que des résultats positifs au virus apparaissent également chez des personnes en bonne santé [8]. Il est intéressant de noter que de nombreuses patientes des registres allemands ne présentent qu’une augmentation modérée ou nulle de la protéine C-réactive (CRP) [1]. En revanche, les réactions auto-immunes jouent probablement un rôle important dans la pathogenèse de la PPCM [9]. Une biopsie myocardique ou un cathétérisme cardiaque n’est généralement pas nécessaire en cas de PPCM typique.
L’incidence de la PPCM varie selon les régions. Au Nigeria, la PPCM semble être très fréquente dans certaines régions, avec 1 grossesse sur 100. Haïti avec 1 pour 299 et l’Afrique du Sud avec 1 pour 1000 grossesses sont également des points chauds [10]. Aux États-Unis, une incidence accrue de 1 pour 1149-3189 a été rapportée au cours des dernières décennies. En Allemagne, nous estimons qu’il y a 1 maladie pour 1000-1500 naissances.
Physiopathologie
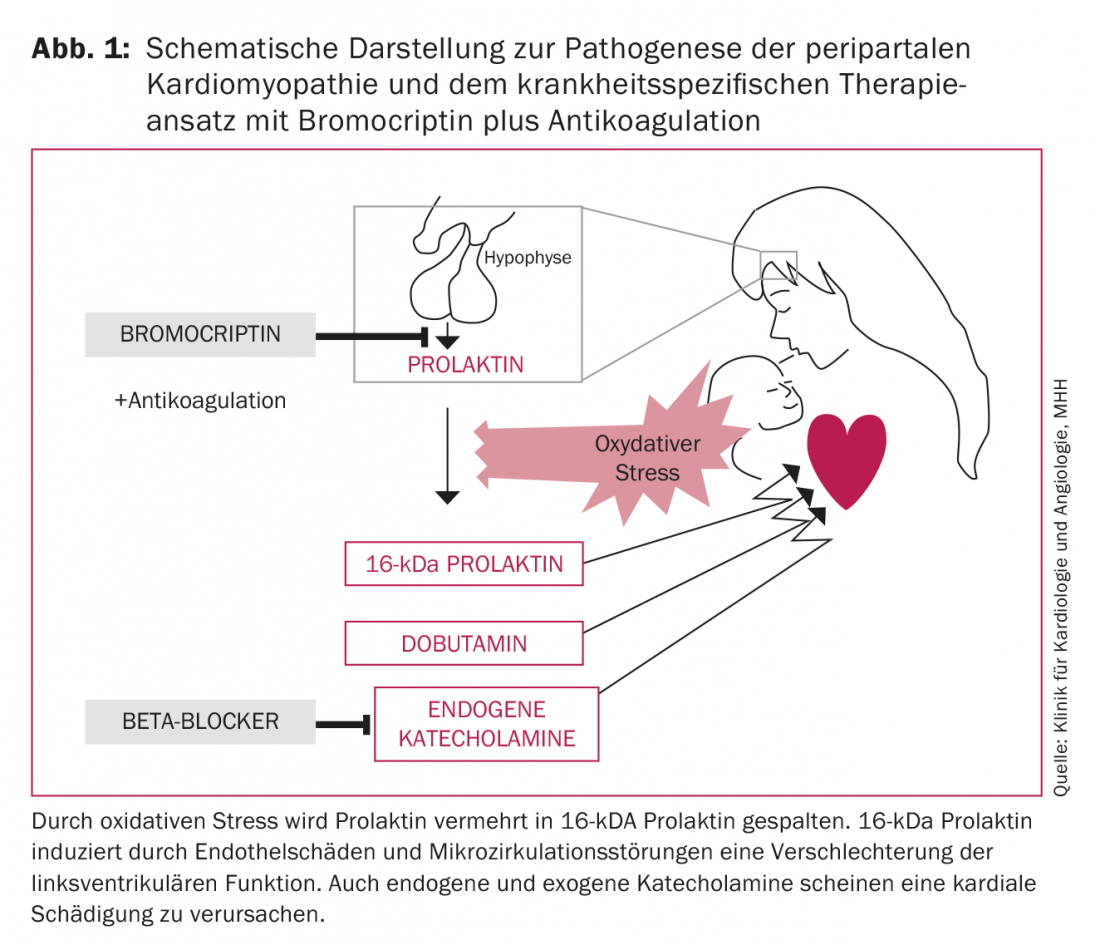
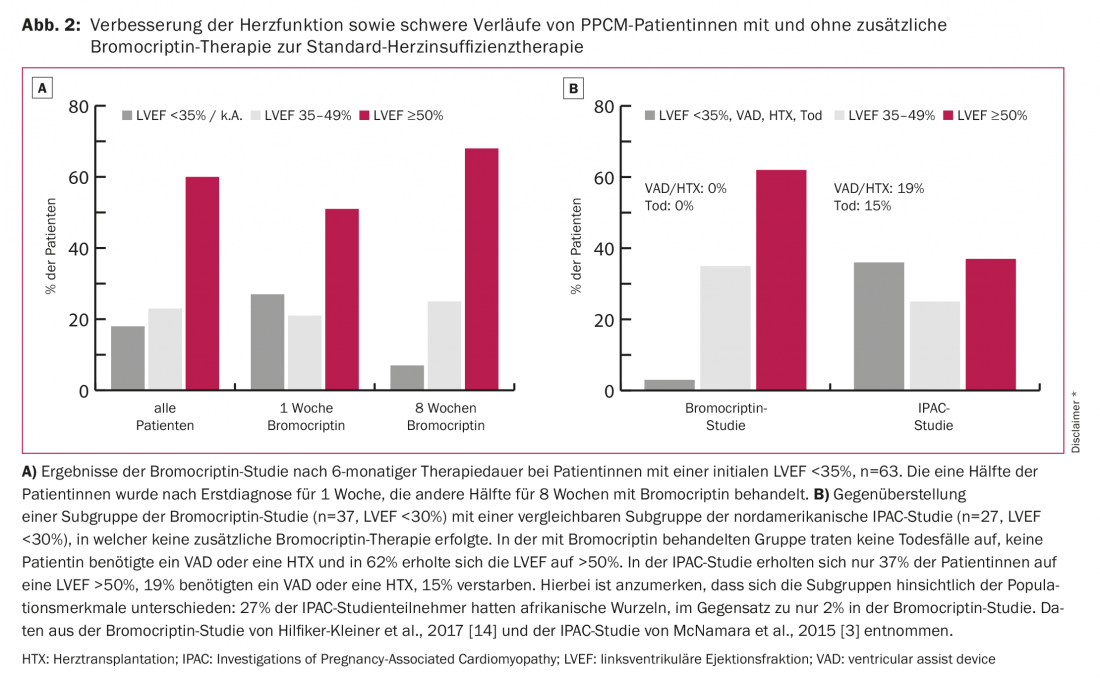
Les facteurs déclencheurs de la PPCM ne sont pas encore suffisamment élucidés. Actuellement, on pense que le tableau complet de la PPCM a une origine multifactorielle. Diverses étiologies telles que l’inflammation, l’infection virale ou bactérienne, la maladie auto-immune, les particularités génétiques et le stress oxydatif sont discutées. C’est en particulier à cette dernière observation que l’on doit, outre le traitement de l’insuffisance cardiaque, la première approche thérapeutique spécifique. Ainsi, Hilfiker-Kleiner et al. montrent que le stress oxydatif augmente le clivage de la prolactine en prolactine de 16 kDa. Ce produit de clivage de 16 kDa attaque les vaisseaux sanguins et en particulier l’endothélium, induisant ainsi un dysfonctionnement endothélial et une dégradation des capillaires. De plus, il agit comme un angiostatique et empêche ainsi la régénération des vaisseaux sanguins [11]. Il en résulte des lésions endothéliales, des troubles de la microcirculation et donc une détérioration de la fonction ventriculaire gauche (VG) (Fig. 1). Le traitement par la bromocriptine, un agoniste dopaminergique, inhibe la sécrétion de prolactine, empêche à 100% l’apparition d’une insuffisance cardiaque dans un modèle murin [11] et améliore significativement la fonction du VG chez les patientes PPCM [1,4,12,13]. L’évolution la plus favorable de la maladie, publiée à ce jour, a été observée dans l’étude multicentrique randomisée allemande récemment publiée sur le traitement par bromocriptine chez les patientes atteintes de PPCM [14]: aucun décès n’est survenu sous traitement par bromocriptine, aucune patiente n’a eu besoin d’une transplantation cardiaque ou d’un système d’assistance cardiaque mécanique et la fonction systolique du ventricule gauche s’est complètement rétablie dans 62% des cas (fig. 2).
*Cette figure a été traduite et réimprimée avec la permission d’Oxford University Press au nom de l’ESC. L’OUP et l’ESC ne sont pas responsables de l’exactitude de la traduction et n’assument aucune responsabilité à cet égard. Le traducteur est seul responsable de la traduction dans cette publication.
Thérapie
Les patientes hémodynamiquement stables et présentant des signes cliniques de décompensation cardiaque tels qu’une dyspnée et un œdème des jambes sont recompensées en milieu hospitalier par des diurétiques de l’anse et rapidement soumises à un traitement de l’insuffisance cardiaque composé d’un inhibiteur de l’ECA/antagoniste des récepteurs AT-1, d’un bêtabloquant et d’un antagoniste des récepteurs aux minéralocorticoïdes (ARM). Les préparations doivent être augmentées jusqu’à la dose maximale tolérée par le traitement standard de l’insuffisance cardiaque. Si une augmentation du dosage des bêtabloquants n’est pas possible en raison de valeurs tensionnelles hypotoniques (<90 mmHg systolique), il est recommandé de réduire la fréquence cardiaque avec l’ivabradine, car une réduction précoce de la fréquence cardiaque semble être associée à une amélioration de la fonction du VG [15]. En plus du traitement standard de l’insuffisance cardiaque, un traitement par bromocriptine doit être administré à une dose dépendant de la sévérité de l’évolution de la maladie (figure 3), car un traitement initial par bromocriptine atténue très probablement l’étendue de la maladie [14]. En raison des propriétés prothrombogènes potentielles de la bromocriptine, une anticoagulation est obligatoire, au moins à des doses prophylactiques contre la thrombose.
Les patientes compromises sur le plan hémodynamique et/ou respiratoire doivent être traitées en unité de soins intensifs. Si la pression artérielle systolique >est de 110 mmHg, des vasodilatateurs peuvent également être utilisés. En cas d’instabilité hémodynamique et d’indication à un traitement par catécholamines, il faut penser très tôt à l’implantation d’un système d’assistance circulatoire temporaire, comme une pompe cardiaque implantable (Impella®), et en cas d’insuffisance circulatoire et pulmonaire, penser en plus à une oxygénation veino-artérielle par membrane extracorporelle (ECMO). C’est la seule façon de soulager le cœur tout en économisant, voire en supprimant totalement, les catécholamines. L’utilisation des catécholamines, et en particulier de la dobutamine, semble associée à une augmentation de la mortalité et devrait être évitée dans la mesure du possible [16,17]. Le lévosimendan, un inotrope qui n’augmente pas la consommation d’oxygène du cœur, est probablement plus avantageux et a montré des résultats prometteurs dans une petite étude [18]. L’évolution de la maladie varie considérablement d’un individu à l’autre.
Si une stabilisation hémodynamique peut être obtenue par le biais des thérapies susmentionnées, notre expérience montre qu’une récupération lente est encore possible après plusieurs semaines. Il est essentiel de diagnostiquer et de traiter les comorbidités telles que les infections utérines ou les mammites. Une approche interdisciplinaire est particulièrement nécessaire pour ces patientes gravement malades. Si, malgré ces mesures, le sevrage du système d’assistance percutanée temporaire ne peut être obtenu après environ 14 jours, des systèmes d’assistance permanents tels qu’un “ventricular assist device” (VAD) implanté chirurgicalement sont utilisés.
Une inscription pour une transplantation cardiaque doit être effectuée si la fonction cardiaque ne s’est pas améliorée après 6 à 12 mois et si l’explantation du VAD ne semble pas possible. Nous traitons les patientes en soins intensifs, sous respiration artificielle ou nécessitant une assistance circulatoire mécanique, avec jusqu’à 20 mg de bromocriptine par jour pendant au moins huit semaines, en fonction du taux de prolactine, avec une réduction progressive de la dose en fonction de l’évolution clinique et sous contrôle du taux de prolactine (Fig. 3).
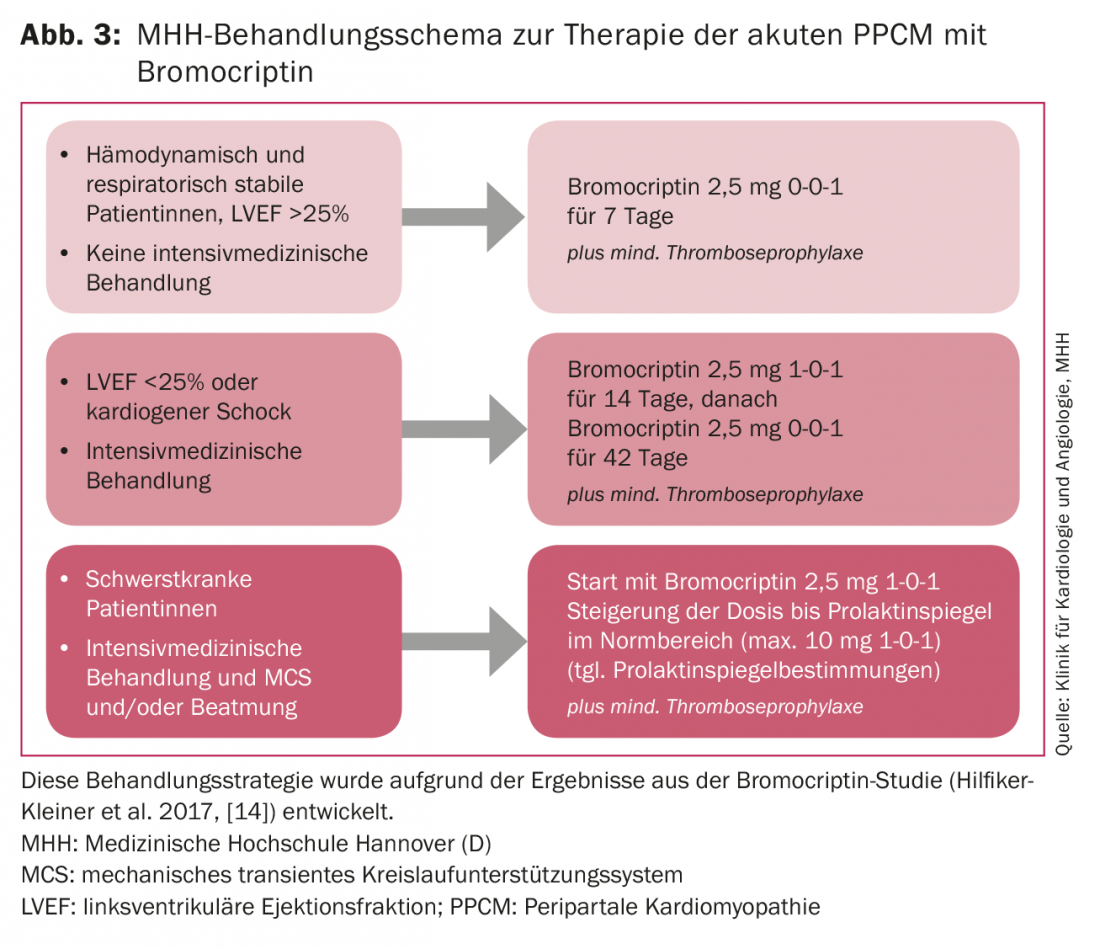
Les systèmes d’assistance circulatoire peuvent entraîner une augmentation des taux de prolactine, qui doivent donc être étroitement contrôlés. Des évolutions aussi dramatiques sont heureusement rares en Allemagne et la planification du traitement exige toujours des décisions au cas par cas. Le transfert précoce vers un centre expérimenté est nécessaire. Une stratégie de traitement recommandée pour les patientes PPCM est résumée dans l’algorithme BOARD : Bromocriptine, traitement de l’insuffisance cardiaque par voie orale, anticoagulation, vasorelaxants et diurétiques [19].
Patientes enceintes
Le traitement de l’insuffisance cardiaque par les inhibiteurs de l’ECA, les antagonistes de l’AT-1 et les antagonistes des récepteurs des minéralocorticoïdes est contre-indiqué pendant la grossesse. Les bêtabloquants peuvent et doivent être utilisés pendant la grossesse en cas de PPCM, les diurétiques doivent être utilisés avec prudence et uniquement en cas de congestion veineuse pulmonaire symptomatique, car il existe un risque d’insuffisance de perfusion placentaire.
La grossesse peut être poursuivie chez les patientes stables sur le plan cardiopulmonaire, sous réserve d’un suivi cardiologique et gynécologique étroit. L’accouchement par voie vaginale est possible, mais la procédure d’accouchement doit être décidée individuellement en équipe par les obstétriciens et les cardiologues traitants. Pour réduire le stress cardiaque important en fin de grossesse, la césarienne primaire est souvent programmée à partir de la 36e semaine de grossesse.
Chez les patientes hémodynamiquement instables, l’accouchement doit être recherché immédiatement, quel que soit l’âge de l’enfant, et le cas échéant, il doit être réalisé dans les meilleurs délais. induire la maturité pulmonaire de l’enfant. Dans ce cas, la césarienne primaire sous rachianesthésie et péridurale combinées est recommandée [20].
Après l’accouchement, les patientes PPCM sous bromocriptine doivent être allaitées et la prise de bromocriptine doit être poursuivie, de manière à inhiber la formation du produit de clivage de la prolactine de 16 kDa, qui est l’un des facteurs de la maladie, et à éviter le stress métabolique supplémentaire que l’allaitement entraîne pour la mère. Les inhibiteurs de l’ECA et les antagonistes des récepteurs aux minéralocorticoïdes (ARM) passent dans le lait maternel. Par conséquent, seul le sevrage de l’enfant permet un traitement optimal de l’insuffisance cardiaque.
Suivi
Le traitement de l’insuffisance cardiaque doit être conforme aux directives de la Société européenne de cardiologie [21]. Contrairement aux autres cardiomyopathies, la PPCM présente un pourcentage élevé de rémissions. Aujourd’hui, >90% des patientes en Allemagne s’améliorent et >60% présentent une fonction VG complètement récupérée de ≥50%. La régénération de la fonction du VG prend plus ou moins de temps : chez certaines patientes, la fonction du VG redevient normale après quelques semaines seulement, alors que chez d’autres, le processus de guérison peut prendre plusieurs mois, voire plusieurs années.
Par conséquent, les patientes présentant une FEVG <35% doivent d’abord être équipées d’un gilet défibrillateur portable afin de les protéger contre le risque accru de mort subite d’origine cardiaque [22]. Le cas échéant, il devrait être porté bien au-delà de la période de 3 mois avant de prendre une décision concernant un défibrillateur implantable.
Même après une récupération complète de la fonction VG, nous recommandons de poursuivre le traitement établi de l’insuffisance cardiaque pendant au moins six mois. Ce n’est qu’ensuite, en commençant par l’ARM, que les substances peuvent être réduites et arrêtées une à une, sous contrôle échocardiographique régulier [23]. Il y a toujours des patientes dont la fonction VG se détériore sous un traitement réduit de l’insuffisance cardiaque, de sorte qu’un traitement à long terme est nécessaire.
Une nouvelle grossesse présente un risque accru de récidive de la MCPP chez toutes les patientes atteintes de MCPP, en particulier si la fonction cardiaque n’a pas récupéré à une FEVG >50% [24]. Cela doit être discuté avec les patientes et leurs partenaires. Si une nouvelle grossesse – prévue ou non – survient, nous vous recommandons de consulter un centre spécialisé dans la PPCM. Un traitement existant contre l’insuffisance cardiaque doit être modifié si nécessaire afin de prévenir d’éventuels effets secondaires sur le fœtus. La grossesse doit faire l’objet d’un suivi étroit et interdisciplinaire et l’accouchement doit être soigneusement planifié. Un traitement immédiat par bromocriptine et un médicament contre l’insuffisance cardiaque après l’accouchement permettent généralement d’espérer un pronostic favorable. Lors de la consultation, il convient de garder à l’esprit qu’un avortement précoce n’empêche pas nécessairement l’apparition d’une PPCM. D’autre part, la grossesse suivante se déroule sans complications graves chez de nombreuses patientes, même avec une fonction VG réduite.
Résumé
La PPCM est une insuffisance cardiaque souvent aiguë, mais aussi subaiguë, qui survient juste avant, pendant ou quelques mois après l’accouchement. Outre les symptômes cliniques, des taux élevés de BNP ou de NT-proBNP et la mise en évidence par échocardiographie d’une fonction VG réduite <45% sont des éléments d’orientation. Pour éviter une évolution fatale, il est indispensable de poser un diagnostic et de mettre en place un traitement rapidement. Un traitement à long terme de l’insuffisance cardiaque est souvent nécessaire, en plus d’un traitement initial par bromocriptine. Une nouvelle grossesse, même après récupération complète de la fonction du VG, présente un risque accru de récidive et doit impérativement être prise en charge dans des centres experts.
Messages Take-Home
- La cardiomyopathie du péripartum (PPCM) désigne une faiblesse cardiaque survenant autour de la date de l’accouchement chez des femmes auparavant en bonne santé.
- La détresse respiratoire avant ou après l’accouchement ne doit pas être banalisée comme étant associée à la grossesse ou comme étant une infection broncho-pulmonaire sans diagnostic supplémentaire.
- En cas de premier diagnostic d’insuffisance cardiaque péri-partum, il convient de consulter et, le cas échéant, de se faire traiter par un centre expérimenté, car des cas mortels surviennent régulièrement.
- Outre le traitement standard de l’insuffisance cardiaque, un traitement par bromocriptine semble améliorer la récupération de la fonction cardiaque.
Littérature :
- Haghikia A, et al : Phenotyping and outcome on contemporary management in a German cohort of patients with peripartum cardiomyopathy. Basic Res Cardiol 2013 ; 108 : 366.
- Ersbøll AS, et al : Peripartum cardiomyopathy in Denmark : a retrospective, population-based study of incidence, management and outcome. Eur J Heart Fail 2017 Jun 8. doi : 10.1002/ejhf.882. [Epub ahead of print].
- McNamara DM, et al : Résultats cliniques pour la cardiomyopathie du péripartum en Amérique du Nord. Résultats de l’étude IPAC (Investigations of Pregnandy-Associated Cardiomyopathy). J Am Coll Cardiol 2015 ; 66 : 905-914.
- Sliwa K, et al : Evaluation of bromocriptine in the treatment of acute severe peripartum cardiomyopathy : a proof-of-concept pilot study. Circulation 2010 ; 121(13) : 1465-1473.
- Biteker M, et al : Retard de récupération dans la cardiomyopathie du péripartum : une indication pour un suivi à long terme et une thérapie soutenue. Eur J Heart Fail 2012 ; 14(8) : 895-901.
- Sliwa K, et al : Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy : a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. Eur J Heart Fail 2010 ; 12 : 767-778.
- Felker GM, et al : Causes sous-jacentes et survie à long terme chez les patients atteints d’une cardiomyopathie initialement non diagnostiquée. N Engl J Med 2000 ; 342(15) : 1077-1084.
- Selle T, et al : Reviewing peripartum cardiomyopathy : current state of knowledge. Future Cardiol 2009 ; 5 : 175-189.
- Haghikia A, et al : Evidence of autoantibodies against cardiac troponin I and sarcomeric myosin in peripartum cardiomyopathy. Basic Res Cardiol 2015 ; 110(6) : 60.
- Hilfiker-Kleiner D, Sliwa K : Pathophysiology and epidemiology of peripartum cardiomyopathy. Nat Rev Cardiol 2014 ; 11(6) : 364-370.
- Hilfiker-Kleiner D, et al : A cathepsin D-cleaved 16 kDa form of prolactin mediates postpartum cardiomyopathy. Cell 2007 ; 128 : 589-600.
- Jahns B, et al : Cardiomyopathie du péripartum – une nouvelle option de traitement par inhibition de la sécrétion de prolactine. Am J Obstet Gynecol 2008 ; 199(4) : e5-6.
- Meyer GP, et al : Bromocriptine treatment associated with recovery from peripartum cardiomyopathy in siblings : two case reports 2010 ; 4 : 80.
- Hilfiker-Kleiner D, et al : Bromocriptine for the treatment of peripartum cardiomyopathy : a multicentre randomized study. Eur Heart J 2017 ; 38(35) : 2671-2679.
- Haghikia A, et al : Traitement précoce par ivabradine chez les patients atteints de cardiomyopathie aiguë du péripartum : sous-analyse du registre allemand PPCM. Int J Cardiol 2016 ; 216 : 165-167.
- Stapel B, et al : Une faible expression de STAT3 sensibilise aux effets toxiques de la stimulation des récepteurs β-adrénergiques dans la cardiomyopathie du péripartum. Eur Heart Jour 2017 ; 36 : 349-361.
- Bauersachs J, et al : Current management of patients with severe acute peripartum cardiomyopathy : practical guidance from the Heart Failure Association of the European Society of Cardiology Study Group on peripartum cardiomyopathy. Eur J Heart Fail 2016 ; 18(9) : 1096-1105.
- Labbene I, et al : Effets décongestionnants du levosimendan dans les chocs cardiogéniques induits par la cardiomyopathie du post-partum. Anaesth Crit Care Pain Med 2017 ; 36(1) : 39-42.
- Arrigo M, et al : Bromocriptine for the treatment of peripartum cardiomyopathy : welcome on BOARD. Eur Heart J 2017 ; 38(35) : 2680-2682.
- Société européenne de gynécologie (ESG), Association européenne de cardiologie pédiatrique (AEPC), Société allemande de médecine de genre (DGesGM), et al. : Lignes directrices de l’ESC sur la prise en charge des maladies cardiovasculaires pendant la grossesse. The Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart Jour 2011 ; 32 : 3147-3197.
- Ponikowski P, et al : 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail 2016 ; 18 : 891-975.
- Duncker D, et al : Risk for life-threatening arhythmia in newly diagnosed peripartum cardiomyopathy with low ejection fraction : a German multi-centre analysis. Clin Res Cardiol 2017 ; 106(8) : 582-589.
- Hilfiker-Kleiner D, et al : Peripartum cardiomyopathy : current management and future perspectives. Eur J Heart Fail 2015 ; 36 : 1090-1097.
- Hilfiker-Kleiner D, et al : Outcome of subsequent pregnancies in patients with an history of peripartum cardiomyopathy. Eur J Heart Fail 2017 Mar 27. doi : 10.1002/ejhf.808. [Epub ahead of print].
CARDIOVASC 2018 ; 17(1) : 8-12