Les nouveaux traitements de l’hépatite C chronique sont désormais accessibles à tous les patients infectés, quel que soit le stade de fibrose. Grâce aux combinaisons DAA, la maladie peut être guérie dans plus de 95% des cas.
Selon les estimations de l’OMS, environ 71 millions de personnes dans le monde sont infectées par le virus de l’hépatite C (VHC) et environ 400 000 personnes meurent chaque année des suites d’une infection par le virus de l’hépatite C. Les personnes infectées par le virus de l’hépatite C sont souvent des enfants et des adolescents. C’est pourquoi l’élimination des infections par les virus des hépatites B et C en tant que maladies potentiellement mortelles d’ici 2030 (en réduisant le taux de nouvelles infections de 90% et la mortalité de 65%) a été formulée comme l’un des grands objectifs médicaux pour les prochaines années [1,2].
On estime qu’environ 40 000 personnes sont touchées par le virus de l’hépatite C en Suisse, ce qui correspond à environ 0,5% de la population, mais il faut encore compter avec un nombre considérable de personnes non diagnostiquées [3].
Transmission et constitution du virus
La transmission du virus se fait par voie parentérale, aujourd’hui principalement par le partage d’aiguille lors de la consommation de drogues par voie intraveineuse et en raison du manque de normes d’hygiène dans les activités médicales. Auparavant, de nombreuses transmissions avaient lieu par le biais de produits sanguins infectés avant 1990 ainsi que par le manque de normes d’hygiène, par exemple lors de la réalisation de tatouages. La contamination est également possible par voie anale et verticale de la mère à l’enfant (environ 5% de risque de transmission) [4].
Le virus de l’hépatite C est un virus à ARN simple brin et possède trois protéines structurales (core, E1, E2) et sept protéines non structurales (p7, NS2, NS3, NS4A, NS4B, NS5A et NS5B) [5]. Il présente une grande variabilité génétique, ce qui se traduit par six génotypes différents avec d’autres sous-types. L’infection par le génotype 1 est la plus fréquente dans le monde (environ 46%), le génotype 1 étant également responsable de près de la moitié des infections en Suisse [6,7].
Formes d’évolution, diagnostic, traitement
Dans l’infection par le VHC, on distingue une forme aiguë d’une forme chronique. L’hépatite C aiguë est souvent asymptomatique, avec des symptômes non spécifiques tels que fatigue, douleurs abdominales, myalgies et, rarement, un ictère. Elle évolue de manière chronique dans environ 50 à 80% des cas.
Une petite étude multicentrique allemande a montré qu’un traitement antiviral de six semaines par sofosbuvir/lédipasvir chez un total de 20 patients atteints d’une infection aiguë par le virus de l’hépatite C de génotype 1 a entraîné dans tous les cas une réponse virologique durable et a ainsi permis d’éviter la chronicité de l’infection virale [8]. Cependant, comme l’infection aiguë par le virus de l’hépatite C n’est que rarement diagnostiquée en raison de la symptomatologie non spécifique et qu’elle peut souvent être asymptomatique, le traitement de l’hépatite C aiguë ne joue qu’un rôle secondaire par rapport au traitement de l’hépatite C chronique.
Une infection chronique par le VHC peut rester longtemps asymptomatique et ne provoquer que tardivement des symptômes non spécifiques tels que la fatigue, la baisse des performances, les troubles abdominaux supérieurs, les démangeaisons ou les douleurs articulaires. Des manifestations extra-hépatiques telles que la cryoglobulinémie, la néphropathie à médiation par le complexe immunitaire du VHC ou le lymphome à cellules B non hodgkinien peuvent également survenir. Environ 20 à 30% des patients atteints de VHC chronique développent une cirrhose du foie au cours des 30 années suivantes. Les facteurs de risque pour la progression de la fibrose du tissu hépatique sont principalement l’âge >40 ans au moment de la contamination, la consommation d’alcool de plus de 50 g par jour et le sexe masculin [9].
L’incidence du carcinome hépatocellulaire dans la cirrhose associée à l’hépatite C est d’environ 3-6% [10].
Dans le cadre de la Swiss Hepatitis C Cohort Study, il a été constaté qu’environ 61% des patients atteints de VHC chronique étaient nés entre 1955 et 1974 [11]. En particulier chez les patients nés dans ces années-là et présentant des antécédents de risque (abus de drogues par voie intraveineuse, transfusions sanguines avant 1990, tatouages), il faut également penser au dépistage anti-VHC (fig. 1) en cas de fatigue persistante ou d’autres symptômes non spécifiques, et envisager un traitement si le résultat est positif. Sinon, les groupes à risque habituels tels que les personnes ayant des transaminases élevées, infectées par le VIH ou le VHB, consommant des drogues par voie intraveineuse/intranasale ou portant des piercings/des tatouages, les patients sous dialyse et les enfants nés de mères infectées par le VHC doivent être testés.
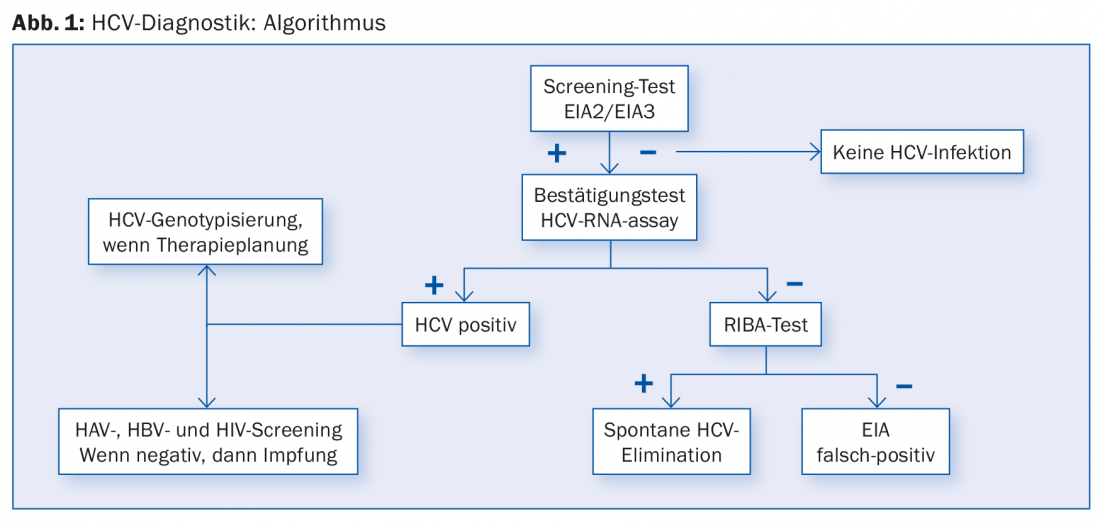
Cependant, un test de recherche anti-VHC peut parfois être faussement positif (Fig. 1). Il convient donc de toujours effectuer une PCR de l’ARN du VHC en cas de test de recherche positif. Si la PCR du VHC est négative, il s’agit soit d’une infection par le VHC subie, soit d’un test de recherche faussement positif. Dans ce cas, un autre test immunologique, appelé test RIBA (“recombinant immunoblot assay”), peut aider. Ce test de confirmation est plus précis que le test de dépistage anti-HCV. Si le test RIBA est positif, il s’agit d’une hépatite C passée, si le résultat est négatif et que la PCR VHC est également négative, on peut clairement supposer que le test de dépistage anti-VHC est faussement positif et qu’aucun autre examen n’est nécessaire.
Pendant longtemps, le traitement de l’hépatite C a consisté en une combinaison d’interféron alpha pégylé et de ribavirine, qui pouvait durer jusqu’à 18 mois dans le pire des cas. Le traitement n’a répondu que chez 50 à 70% des patients avec l’apparition simultanée d’effets secondaires parfois importants tels que des effets hématotoxiques, des symptômes pseudo-grippaux, de la fatigue ou des symptômes psychiatriques. Le développement des nouveaux antiviraux à action directe (DAA) a révolutionné le traitement du VHC. Au lieu d’une longue thérapie à l’interféron avec des effets secondaires et des taux de réussite modérés, le traitement par une combinaison d’AAD se déroule aujourd’hui avec des taux de réussite de plus de 95% et une très bonne tolérance, sans effets secondaires importants [12].
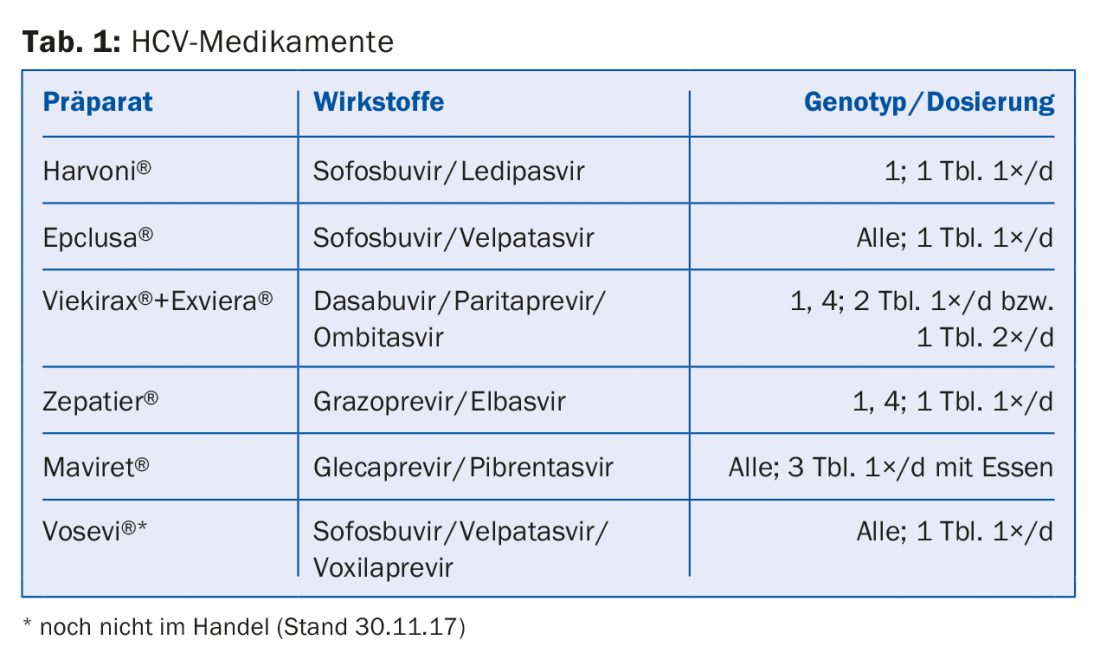
Les inhibiteurs de la NS5A du VHC, tels que le lédipasvir ou le velpatasvir, inhibent la protéine virale NS5A, qui joue un rôle dans la réplication du VHC et la modulation de la fonction cellulaire, et se terminent par le suffixe -asvir. Parmi les inhibiteurs de la polymérase NS5B ARN-dépendants, on distingue les inhibiteurs nucléosidiques (NI), comme le sofosbuvir, des inhibiteurs non nucléosidiques (NNI), comme le dasabuvir – ils se terminent par le suffixe -buvir. Les inhibiteurs de protéase tels que le grazoprévir ou le glécaprévir inhibent la sérine protéase NS3/A4 propre au virus et se terminent par le suffixe -previr. Le tableau 1 présente une sélection des médicaments actuellement autorisés et remboursés en Suisse.
Indicateurs de réussite de la thérapie
Le succès d’un traitement antiviral est évalué douze semaines après la fin du traitement. Si l’ARN viral n’est plus détectable par biologie moléculaire par PCR, on parle de réponse virologique soutenue (“sustained virological response”, SVR), de sorte que les patients peuvent être considérés comme exempts de virus et guéris.
Des méta-études montrent que la probabilité d’un retour ultérieur du virus dans les cinq ans suivant l’arrêt du traitement est inférieure à 1% dans la population normale et d’environ 10% dans la population à haut risque (consommation continue de drogue par voie intraveineuse, population carcérale). Cependant, chez les personnes atteintes, la réinfection par le virus, souvent avec un génotype différent, est beaucoup plus fréquente que la rechute ultérieure [13].
D’autres études montrent que l’obtention d’une RVS réduit à la fois la mortalité associée au foie et la mortalité extra-hépatique de l’infection par le virus de l’hépatite C [14]. En outre, l’obtention d’une RVS est également associée à une amélioration de la qualité de vie, ce qui en fait un critère d’évaluation établi pour les patients dans le cadre du traitement de l’hépatite C [14].
Si une RVS est obtenue chez les patients sans cirrhose, un contrôle en laboratoire de l’ARN du VHC doit être effectué environ douze mois plus tard. Si le test reste négatif, les patients sont considérés comme définitivement guéris et, en l’absence d’autres facteurs de risque hépatologique, ils n’ont pas besoin d’être suivis. Les patients atteints de cirrhose doivent continuer à être vus tous les six mois pour un contrôle clinique et de laboratoire, ainsi que pour un dépistage échographique du carcinome hépatocellulaire (CHC), même après l’obtention d’une RVS.
Récidive du CHC
Deux études de cohorte distinctes menées à Bologne [15] et à Barcelone [16] ont révélé que les patients dont le CHC avait été traité précédemment présentaient inexplicablement une récidive de CHC six mois après la fin du traitement antiviral dans 29% et 27,6% des cas respectivement. Chez les patients sans antécédents de CHC, un CHC a été détecté dans environ 3,2% des cas dans chacune des deux études. Cette association n’a pas été confirmée dans d’autres études. Cependant, les études sur ce sujet sont encore peu nombreuses. En attendant de disposer de plus de données sur ce sujet, nous recommandons en pratique un examen échographique du foie avant et après le traitement antiviral.
Planification de la thérapie
Jusqu’à récemment, le traitement par les AAD n’était accessible en Suisse qu’aux patients présentant une fibrose hépatique de grade 2 ou plus, en raison de leur prix élevé. Depuis le 1er octobre 2017 au plus tard, la baisse significative des prix a rendu la limitation caduque ; le traitement par AAD est depuis lors remboursé par l’assurance maladie pour tous les patients infectés par le VHC, indépendamment du stade de fibrose.
Les facteurs suivants doivent être pris en compte dans le choix et la durée du traitement : Le génotype du VHC, la cirrhose/l’absence de cirrhose, le fait d’être sous traitement/d’avoir suivi un traitement (et si oui, lequel) et les comorbidités.
Les combinaisons d’AAD recommandées dans les lignes directrices de la SASL (Swiss Association for the Study of the Liver) d’août 2017 sont présentées sous une forme modifiée dans les tableaux 2 à 5 pour chaque constellation [17]. En outre, les recommandations thérapeutiques pour le médicament Maviret® (glécaprévir/pibrentasvir), récemment autorisé, sont également énumérées conformément à l’information professionnelle [18]. Celui-ci peut être utilisé et prescrit depuis le 1er décembre 2017.
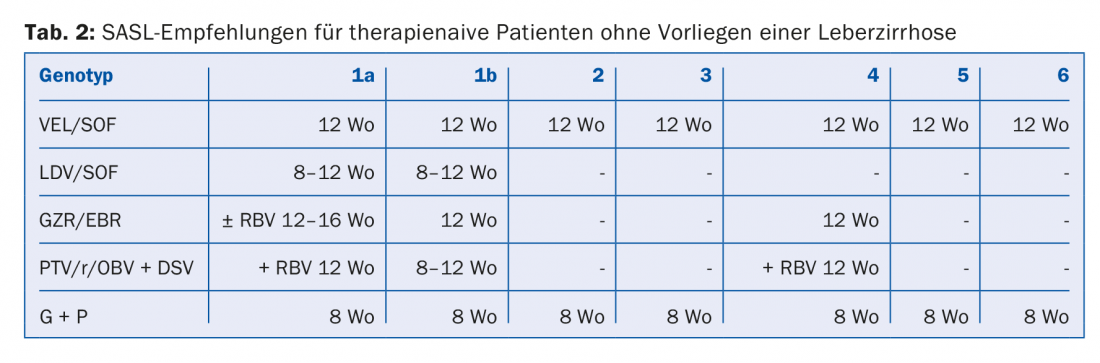
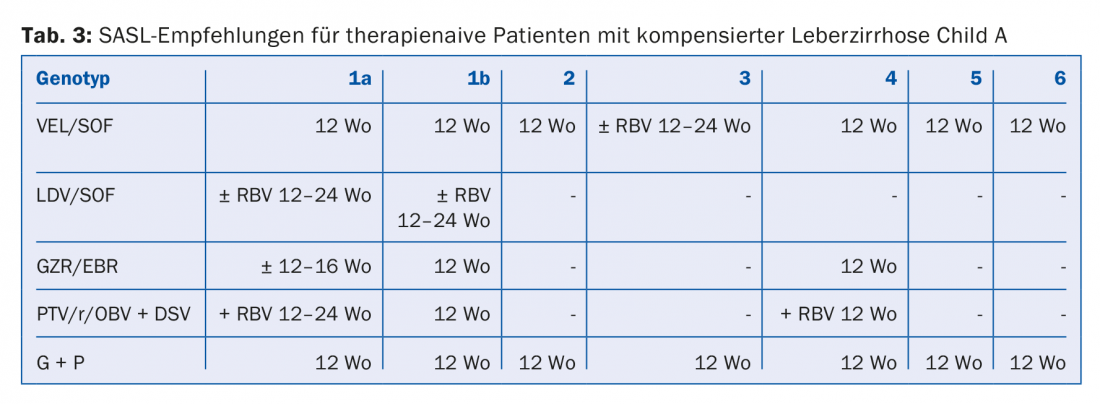
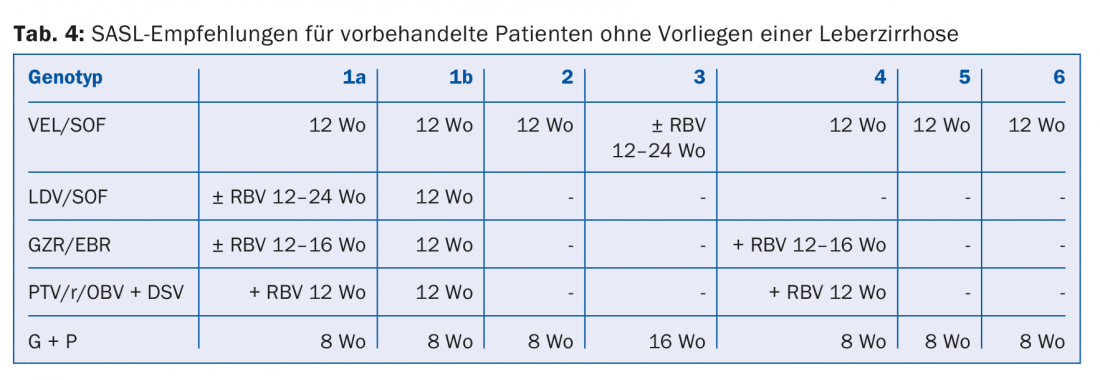
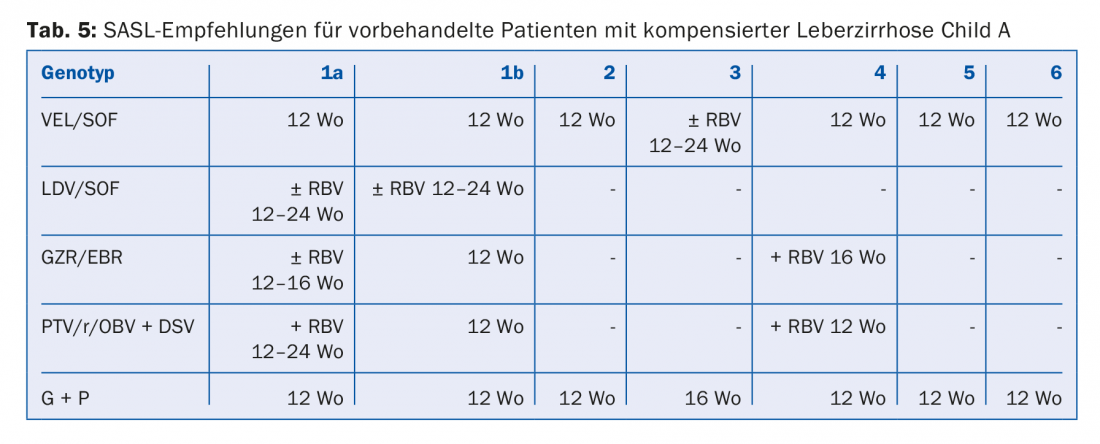
En raison de la mise à jour constante des recommandations thérapeutiques, il est conseillé de déterminer le traitement individuel, par exemple sur le site www.sasl.ch ou l’application pour smartphone SASL HCV Advisor.
Les combinaisons d’AAD sofosbuvir/velpatasvir et glécaprévir/pibrentasvir, dont l’avantage réside dans leur efficacité pangénotypique élevée, méritent d’être soulignées. L’association glécaprévir/pibrentasvir ne nécessite en outre qu’une durée totale de traitement de huit semaines et a été très bien tolérée dans les études, les effets secondaires les plus fréquents étant les céphalées (18-19%) et la fatigue (9-12%) [19]. Par conséquent, cette combinaison peut être considérée comme particulièrement avantageuse pour les patients dont l’observance est difficile.
Échec du traitement
L’échec d’un traitement par une combinaison d’AAD est généralement dû à une situation virologique complexe avec la sélection de variants viraux résistants (“resistance-associated variants”, RAV), raison pour laquelle un nouveau traitement par une combinaison d’AAD + ribavirine devrait être initié dans un centre spécialisé après un test de résistance [20].
Alternativement, un traitement avec les nouveaux antiviraux glécaprévir/pibrentasvir ou sofosbuvir/velpatasvir/voxilaprévir peut être envisagé. Pour l’association sofosbuvir/velpatasvir/voxilaprévir pendant 12 semaines, deux grandes études de phase 3 (POLARIS 1 et 4) ont permis d’obtenir respectivement un taux de RVS de 96% et 98% dans tous les génotypes en cas d’échec préalable du traitement par une association d’AAD [21]. Ce dernier devrait être autorisé en Suisse début 2018.
Interactions et contre-indications
Si d’autres médicaments sont pris pendant le traitement antiviral, il est essentiel de déterminer leur potentiel d’interaction avec les AAD (par exemple sur le site www.hep-druginteractions.org ou sur www.compendium.ch).
En particulier, les antiarythmiques, les antibiotiques, les antidépresseurs ou les anticonvulsivants qui inhibent la glycoprotéine P ou interagissent avec le système CYP s’avèrent souvent problématiques. Ainsi, la prise simultanée de sofosbuvir et d’amiodarone peut entraîner des bradyarythmies potentiellement mortelles [22].
En présence d’une insuffisance rénale chronique avec un DFGe <30 ml/min, des associations sans sofosbuvir doivent être utilisées [23]. En outre, le traitement est contre-indiqué pendant la grossesse, car aucune étude n’a pu exclure un éventuel effet tératogène des AAD.
La prise d’inhibiteurs de protéase doit être évitée chez les patients atteints de cirrhose Child B/C et ayant des antécédents de décompensation, car ils atteignent une concentration beaucoup plus élevée [23].
Ce n’est que si les médecins de premier recours et les spécialistes agissent de concert qu’il sera possible d’atteindre l’objectif commun de la stratégie suisse contre l’hépatite et de l’OMS, à savoir l’élimination du VHC d’ici 2030.
Messages Take-Home
- Avec la chute des limites pour la plupart des combinaisons d’AAD (“antiviraux à action directe”), le traitement de l’hépatite C chronique est accessible à tous les patients infectés, quel que soit le stade de fibrose, et est pris en charge par l’assurance maladie.
- Grâce aux nouvelles combinaisons d’AAD, l’hépatite C chronique peut être guérie dans plus de 95% des cas sans apparition d’effets secondaires importants.
- Si une situation SVR (“sustained virological response”) est atteinte, la probabilité d’une rechute tardive de l’infection par le virus de l’hépatite C est inférieure à 1%.
- Les associations d’AAD pangénotypiques sofosbuvir/velpatasvir ou sofosbuvir/velpatasvir/voxilaprévir et glécaprévir/pibrentasvir devraient encore simplifier le traitement de l’infection chronique par le virus de l’hépatite C à l’avenir.
Littérature :
- OMS : Fiche d’information sur l’hépatite C. www.who.int/mediacentre/factsheets/fs164/en/
- OMS : Rapport mondial sur les hépatites 2017. http://apps.who.int/iris/bitstream/10665/255016/1/9789241565455-eng.pdf?ua=1
- Zahnd C, et al. : Analyse de Situation des Hepatites B et C en Suisse. OFSP mars 2017.
- Yeung CY, et al : Transmission verticale du virus de l’hépatite C – Connaissances actuelles et perspectives. World J Hepatol 2014 ; 6 : 643-651.
- Webster DP, et al : Hépatite C. Lancet 2015 ; 385 : 1124-1135.
- Messina JP, et al. : Distribution mondiale et prévalence des génotypes du virus de l’hépatite C. Hepatology 2015 ; 61(1) : 77-87.
- Bruggmann P : L’épidémiologie de l’hépatite C en Suisse et le rôle des soins primaires. Pratique 2016 ; 105(15) : 885-889.
- Deterding K, et al : Ledipasvir plus sofosbuvir combinaison à dose fixe pendant 6 semaines chez les patients atteints d’une monoinfection par le virus de l’hépatite C de génotype 1 (HepNet Acute HCV IV) : une étude de phase 2 en ouvert, à un seul bras. Lancet Infect Dis 2017 ; 17 : 215-222.
- Poynard T, et al : Histoire naturelle de la progression de la fibrose hépatique chez les patients atteints d’hépatite C chronique. Les groupes OBSVIRC, METAVIR, CLINIVIR et DOSVIRC. Lancet 1997 ; 349 : 825-832.
- Fattovich G, et al : Carcinome hépatocellulaire dans la cirrhose : incidence et facteurs de risque. Gastroenterology 2004 ; 127 : 35-50.
- Bruggmann P, et al : Birth year distribution in cases of hepatitis C in Switzerland. Eur J Public Health 2015 Feb ; 25(1) : 141-143.
- Zeuzem S : Options de traitement de l’hépatite C. Dtsch Arztebl Int 2017 Jan ; 114(1-2) : 11-21.
- Simmons B, et al : Risk of late relapse or reinfection with hepatitis C virus after achieving a sustained virological response – a systematic review and meta-analysis. Clin Infect Dis 2016 ; 62 : 683-694.
- Lee MH, et al : Chronic hepatitis C virus infection increasis mortality from hepatic and extrahepatic diseases – a community-based long-term prospective study. J Infect Dis 2012 ; 206 ; 469-477.
- Conti F, et al : Apparition précoce et récidive du carcinome hépatocellulaire dans la cirrhose liée au VHC traitée avec des antiviraux à action directe. J of Hepatol 2016 ; 65(4) : 727-733.
- Reig M, et al : Unxpected high rate of early tumor recurrence in patients with HCV-related HCC undergoing interferon-free therapy. J of Hepatol 2016 Oct ; 65(4) : 719-726.
- SASL : Lignes directrices. https://sasl.unibas.ch/guidelines/SASL-SSI_HepC_EOS_Aug2017.pdf (last accessed 16 October 2017).
- Information professionnelle Maviret®. www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/004430/WC500233677.pdf (last accessed 16 October 2017).
- Zeuzem S : ENDURANCE-1 : A Phase 3 Evaluation of the Efficacy and Safety of 8- versus 12-week Treatment with Glecaprevir/Pibrentasvir (formerly ABT-493/ABT-530) in HCV Genotype 1 Infected Patients with or without HIV-1 Co-infection and without Cirrhosis. The AASLD Liver Meeting, Boston 2016 ; Oral Presentation.
- Vermehren J, et al : Retreatment of patients who failed DAA-combination therapies – Real world experience from a large hepatitis C resistance database. J Hepatol 2016 ; 64 ; p188.
- Bourlière M, et al : Sofosbuvir, Velpatasvir, Voxilaprevir for previously treated HCV Infection. N Engl J Med 2017 ; 376 : 2134-2146.
- Fontaine H, et al : Bradyarrhythmias associated with sofosbuvir treatment. N Engl J Med 2015 ; 373 : 1886-1888.
- EASL : Recommandations sur le traitement de l’hépatite C 2016. J Hepatol 2017 Jan ; 66(1) : 153-194.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(1) : 24-28