En cas de diagnostic initial de tumeur pendant la grossesse, il existe des procédures thérapeutiques établies pour les deuxième et troisième trimestres. Si une grossesse survient après un traitement contre une tumeur, une surveillance attentive est nécessaire. Les menaces d’accouchement prématuré et les retards de croissance fœtale peuvent ainsi être détectés à un stade précoce.
En Suisse, plus de 38 500 personnes sont atteintes d’un cancer chaque année. 13% des tumeurs apparaissent avant l’âge de 50 ans, c’est-à-dire qu’elles touchent généralement encore la phase fertile de la vie. Chaque année, on enregistre environ 190 nouveaux cas chez les enfants. Les plus fréquentes sont les leucémies (34%), les tumeurs du système nerveux central (21%) et les lymphomes (11%). Les chances de guérison se sont considérablement améliorées et atteignent aujourd’hui 80% [1].
Les thérapies cytotoxiques (radiothérapie et chimiothérapie) peuvent perturber temporairement ou définitivement la fonction testiculaire et ovarienne. L’étendue des lésions gonadiques dépend du type et de l’intensité du traitement ainsi que de facteurs individuels tels que l’âge biologique. En raison de l’augmentation des taux de survie, de plus en plus de patients sont confrontés aux effets à long terme de la chimiothérapie ou de la radiothérapie. Les gonades (ovaires et testicules) étant particulièrement sensibles à ce type d’exposition, la question de l’impact sur la grossesse se pose également souvent.
D’autre part, les statistiques montrent que les parents sont beaucoup plus âgés à la naissance de leur premier enfant qu’il y a des décennies. Nous sommes donc de plus en plus confrontés au problème de la planification familiale au moment du diagnostic ou du traitement du cancer. C’est pourquoi la fréquence des diagnostics de tumeurs pendant la grossesse augmente également, la prévalence étant de un à deux cas pour 1000 grossesses [2].
Fertilité féminine après un traitement oncologique
Les traitements oncologiques peuvent inclure, selon le type de tumeur, des mesures chirurgicales, une radiothérapie, une chimiothérapie, des procédures endocrinologiques ou immunologiques.
Les considérations sur l’influence des traitements oncologiques sur le désir d’enfant ultérieur se concentrent généralement sur les restrictions de la fonction gonadique, mais les effets sur l’utérus et les maladies maternelles concomitantes doivent également être pris en compte. Une radiothérapie peut par exemple provoquer une fibrose qui empêche le développement de l’enfant dans les délais prévus jusqu’à la date prévue de l’accouchement. La radiothérapie de l’abdomen ou du pelvis peut multiplier par 1,5 à 2 le risque d’avortement spontané. Outre une lésion directe de l’endomètre, une fibrose du myomètre ou des vaisseaux sanguins qui l’irriguent a été évoquée comme cause possible [3].
Le traitement d’une tumeur peut également réduire la capacité de l’organisme maternel à supporter une grossesse ultérieure, par exemple en diminuant la fonction du cœur, des reins ou des poumons. Par exemple, si un traitement par anthracyclines entraîne une cardiomyopathie, la fonction circulatoire maternelle est réduite pendant la grossesse [4].
Si les ovaires, l’utérus ou les testicules sont touchés par des tumeurs, l’ablation chirurgicale de ces organes entraîne inévitablement la perte de la fertilité. Dans ces cas, seuls le don d’ovules ou de spermatozoïdes, la maternité de substitution ou l’adoption permettent en principe de réaliser le désir d’enfant.
La chimiothérapie ou la radiothérapie peuvent affecter les gonades en détruisant les follicules primordiaux dans les ovaires ou les spermatogonies dans les testicules. La toxicité d’une chimiothérapie est déterminée par la substance active, la dose, la forme d’application et la combinaison. L’ampleur de la gonadotoxicité est liée à la maladie, à l’âge, au sexe et à la fertilité avant le traitement de la tumeur. Une atteinte de l’axe hypothalamo-hypophysaire est également possible. L’effet local d’une radiothérapie dépend du champ d’irradiation, de la dose de rayonnement et du fractionnement.
Les traitements endocriniens – souvent utilisés pour le cancer du sein – ont un impact sur la fonction ovarienne et l’endomètre [5].
Il existe peu de données sur les effets de l’immunothérapie sur la fertilité [6].
Les cytostatiques sont plus ou moins nocifs pour les gonades. Si le planning familial n’est pas terminé, les cytostatiques fortement gonadotoxiques (tab. 1) doivent être évités. Les cytostatiques présentant un faible risque d’atteinte ovarienne sont par exemple le méthotrexate, le 5-fluorouracil, la vincristine, la vinblastine, la bléomycine et l’actinomycine. Le risque d’aménorrhée permanente varie considérablement d’un régime à l’autre.
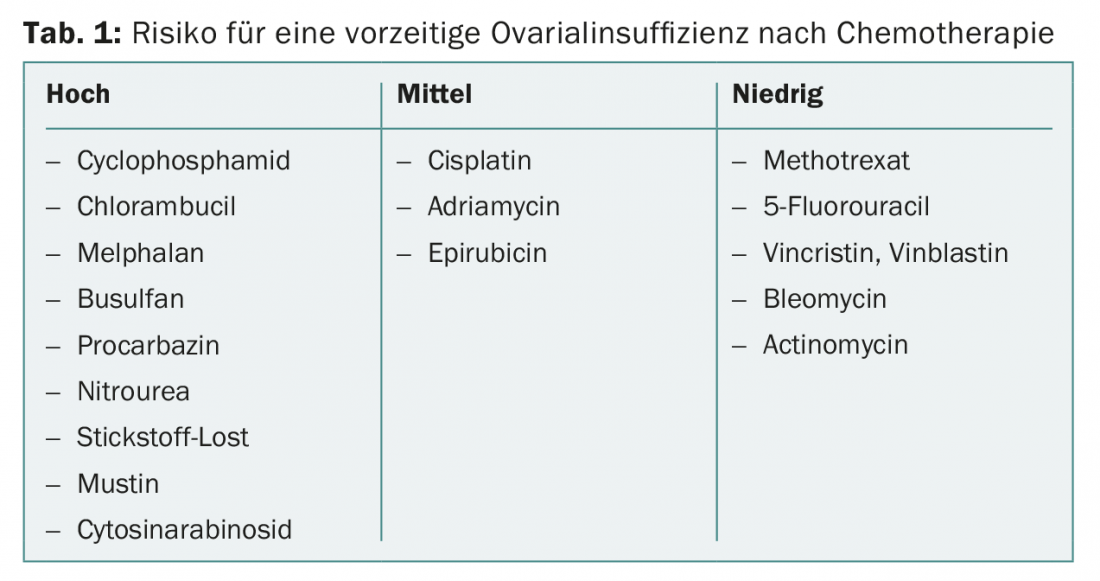
Les traitements considérés comme fortement gonadotoxiques sont ceux qui ont une probabilité d’au moins 80% d’entraîner une aménorrhée ou une azoospermie persistante. Il s’agit par exemple d’une irradiation du corps entier dans le cadre d’une transplantation de cellules souches. Chez les femmes de plus de 40 ans, 40 à 100 % d’entre elles sont susceptibles d’être ménopausées dans l’année qui suit la chimiothérapie par cyclophosphamide [7].
Les traitements considérés comme modérément gonadotoxiques sont ceux qui entraînent une aménorrhée dans 40 à 60% des cas. Il s’agit par exemple d’une chimiothérapie adjuvante pour le cancer du sein chez les femmes âgées de 30 à 39 ans ou d’une chimiothérapie de seconde ligne pour le M. Hodgkin.
Par exemple, la chimiothérapie de première ligne selon le schéma ABVD pour le M. Hodgkin présente une faible gonadotoxicité. 45% des femmes d’un âge moyen de 26 ans et 53% des hommes d’un âge moyen de 28 ans ont obtenu une grossesse après une chimiothérapie ABVD [8].
Le nombre de follicules primordiaux présents à la naissance diminue continuellement dans l’organisme féminin jusqu’à la ménopause. Ce processus est accéléré par les thérapies cytotoxiques, de sorte que la perte de la fonction ovarienne survient plus tôt. Les femmes qui ont survécu à long terme et qui ont souffert d’une tumeur maligne dans leur enfance sont ménopausées beaucoup plus tôt que leurs sœurs et ne devraient donc pas satisfaire un désir d’enfant existant trop tard.
La probabilité d’une perte complète de la fonction ovarienne augmente avec l’âge. Les femmes de plus de 40 ans ont une réserve d’ovules plus faible, de sorte qu’il faut s’attendre à une perte de fonction permanente chez elles dès la radiothérapie à des doses comprises entre 5 et 6 Gy. En revanche, les femmes plus jeunes peuvent éventuellement tolérer jusqu’à 20 Gy. La radiothérapie pelvienne pendant l’enfance ou l’adolescence peut entraîner une réduction du volume de l’utérus, une diminution de l’épaisseur de l’endomètre ou une perte d’élasticité des muscles utérins.
Une insuffisance ovarienne aiguë est survenue chez 215 (6,3%) des 3390 patientes de la Childhood Cancer Survivor Study (CCSS) aux États-Unis [9]. Parmi les 5149 femmes survivantes âgées de 15 à 44 ans, le taux de grossesse était inférieur de 19% par rapport aux frères et sœurs non exposés (RR 0,81 ; IC 95% 0,73-0,90).
Des cycles irréguliers indiquent souvent un début de ménopause précoce. Une baisse de l’AMH (hormone anti-Müller) ou de l’inhibine B ainsi qu’une augmentation de la FSH le troisième jour du cycle et l’absence de détection échographique de follicules matures témoignent d’un trouble de la fonction ovarienne et constituent un critère diagnostique approprié.
Fertilité masculine après le traitement d’une tumeur
Chez les hommes, des doses de rayonnement de 0,1 Gy peuvent déjà entraîner une oligospermie temporaire. Des doses plus élevées entraînent souvent une interruption complète de la production de spermatozoïdes. Cependant, un retour de la fertilité a parfois été enregistré après plusieurs années. Les doses de radiation supérieures à 6 Gy provoquent souvent une infertilité permanente. Les données sur les niveaux de doses de rayonnement en cas de perte de fertilité varient considérablement dans la littérature [10].
30% des traitements des tumeurs de l’enfance entraînent des effets gonadotoxiques chez les garçons, avec une infertilité permanente [11]. L’ampleur et la durée des dommages dépendent du cytostatique administré et de la dose totale. En particulier, les alkylants tels que le busulfan, le cisplatine, le cyclophosphamide, l’ifosfamide et la procarbazine sont connus pour provoquer une infertilité persistante [12]. La plupart des chimiothérapies pédiatriques consistent en des combinaisons de plusieurs cytostatiques, dont les effets synergiques peuvent entraîner une infertilité même à de faibles doses de chaque agent.
Outre les spermogrammes pathologiques, un faible taux d’inhibine B et un taux élevé de FSH témoignent de l’ampleur de la baisse de la fertilité masculine.
Protection de la fertilité
Si des traitements gonadotoxiques sont nécessaires chez des patients en âge de procréer, une information détaillée sur les options de préservation de la fertilité doit être fournie de nos jours.
Dans le cadre du concept thérapeutique, il convient donc de discuter des mesures de médecine de la reproduction avec cryoconservation des ovules et des spermatozoïdes. Si cela ne pose pas de problème pour le sperme, la cryoconservation d’embryons fécondés après fécondation in vitro soulève quelques points critiques : La stimulation hormonale de l’ovaire pour obtenir des ovocytes retarde non seulement la chimiothérapie, mais peut aussi éventuellement stimuler la croissance tumorale dans le cas de tumeurs à récepteurs hormonaux positifs.
Si le traitement d’une tumeur a entraîné une azoospermie, les spermatozoïdes peuvent également être extraits chirurgicalement du tissu testiculaire à l’aide de la technique d’extraction de sperme testiculaire (TESE).
En revanche, les mesures de préservation de la fertilité chez les femmes sont beaucoup plus compliquées et n’en sont parfois qu’au stade expérimental.
L’intérêt de protéger l’ovaire en “immobilisant” l’axe hypophyse-ovaire pendant la chimiothérapie par agonistes de la LHRH fait l’objet de controverses [13].
Le traitement de stimulation ovarienne pour obtenir des ovocytes et la cryoconservation d’ovocytes fécondés sont des procédures de routine bien établies dans le cadre de la fécondation in vitro. Les centres spécialisés en médecine de la reproduction pratiquent également la cryoconservation d’ovules non fécondés. Une stimulation ovarienne pour obtenir des ovocytes peut être réalisée chez les femmes post-pubères jusqu’à l’âge de 40 ans environ. Les chances de grossesse après cryoconservation d’ovules fécondés avant traitement cytotoxique sont estimées à 40% chez les patientes âgées de 18 à 25 ans, à environ 35% entre 26 et 30 ans, à environ 30% entre 31 et 35 ans et à environ 25% entre 36 et 40 ans ; ces chiffres représentent les taux de grossesse cumulés après plusieurs cycles de décongélation [14].
En revanche, le prélèvement laparoscopique et la cryoconservation de tissu ovarien est une technique encore expérimentale de préservation de la fertilité. Les femmes jeunes avec une réserve ovarienne élevée sont particulièrement adaptées à cette pratique. Toutefois, en cas de transplantation de tissu ovarien, le risque potentiel de transmission de cellules malignes doit également être pris en compte [15].
En cas d’irradiation thérapeutique du pelvis, la transposition chirurgicale des ovaires (ovoporopexie) est une option qui permet de retirer le tissu ovarien du champ d’irradiation immédiat.
Taux de grossesse après diagnostic de tumeur
Il existe souvent une incertitude quant à l’intervalle de temps nécessaire entre la fin de la chimiothérapie et le début de la grossesse. Il est souvent conseillé de respecter un intervalle de deux ans après la fin du traitement de la tumeur, d’autant plus que les tumeurs agressives présentent le plus grand risque de récidive peu après le traitement de la tumeur.
Parmi les anciens patients d’oncologie pédiatrique d’un âge moyen d’environ 24 ans, le taux de désir d’enfant était de 77%, contre 90% dans la population générale du même âge. Dans ce contexte, les personnes concernées ont surtout exprimé des craintes que leur enfant soit également atteint d’un cancer ou que leur propre maladie se déclare à nouveau [16].
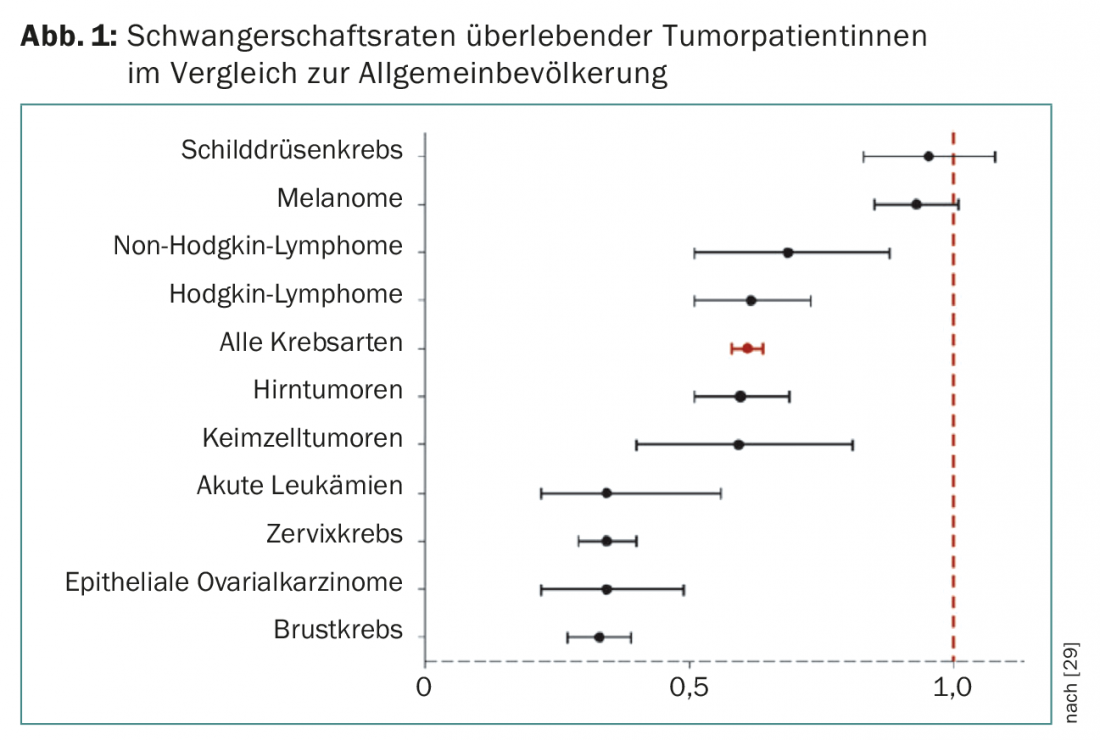
Les taux de grossesse des patientes atteintes d’une tumeur et traitées avec succès sont, selon le type de tumeur (fig. 1) , nettement inférieurs aux données de la population générale comparable [17].
Pronostic des tumeurs après une grossesse
En fonction du type de tumeur, les personnes concernées s’inquiètent parfois aussi de la mesure dans laquelle une grossesse pourrait aggraver le pronostic de la maladie maternelle sous-jacente. Cependant, il est évident qu’une grossesse ultérieure n’a pas d’influence négative sur le pronostic. Cela vaut également pour les tumeurs hormonodépendantes comme le cancer du sein [18]. Dans une étude récente, aucune différence de survie sans maladie n’a été observée chez 333 patientes atteintes d’un cancer du sein à récepteurs d’œstrogènes positifs suivies d’une grossesse, par rapport à un collectif témoin sans grossesse, après un suivi de 7,2 ans [19]. Une méta-analyse de 14 études sur le pronostic du cancer du sein a révélé un taux de mortalité inférieur de 41% après la survenue d’une grossesse par rapport aux patientes atteintes d’un cancer du sein sans grossesse [20]. Mais cela peut aussi s’expliquer par le fait que les patientes ayant un bon pronostic après un traitement contre la tumeur ont davantage le courage de réaliser leur désir d’enfant.
Effets du traitement oncologique sur la descendance
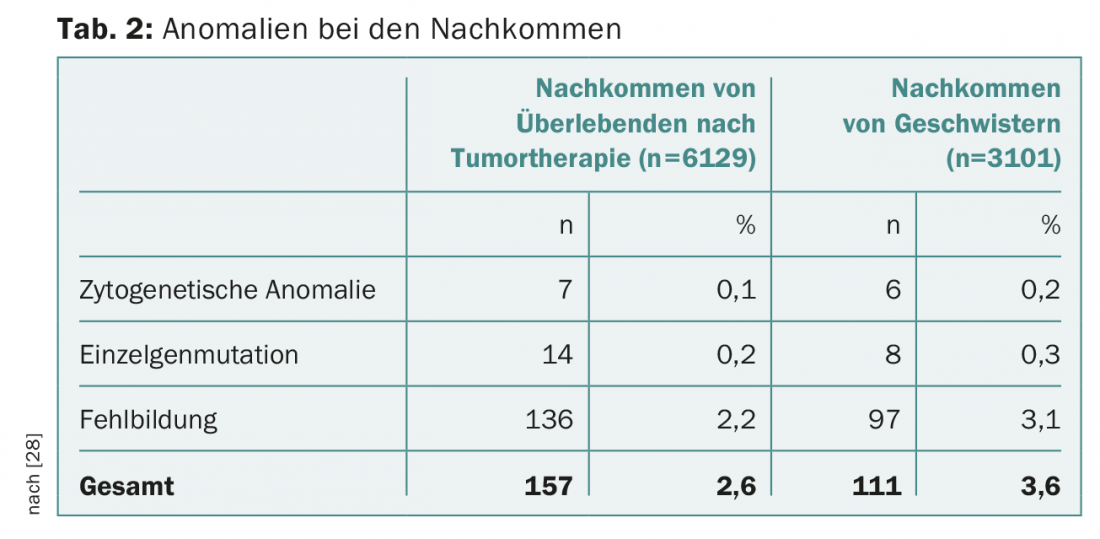
Après un traitement contre la tumeur, les futurs parents se posent souvent des questions sur les dommages possibles pour la descendance. Selon les connaissances actuelles, le risque de malformation des enfants n’est pas augmenté après une chimiothérapie parentale. Le suivi de plus de 4000 grossesses après chimiothérapie maternelle n’a pas montré d’augmentation du taux de malformations infantiles [21]. La base de données du National Cancer Institute américain contient plus de 10 000 patients atteints d’une tumeur maligne pendant l’enfance ou l’adolescence et traités entre 1970 et 1986. Un poids de naissance inférieur au dixième percentile a été enregistré significativement plus souvent, avec 18,2% vs 7,8% (OR 4,0 ; IC 95% 1,6-9,8 ; p=0,003), en particulier après une radiothérapie utérine de 5 Gy [22]. Cependant, aucune augmentation des anomalies congénitales des organes, des syndromes cytogénétiques ou des défauts génétiques n’a été observée chez les descendants (tableau 2).
Une étude de cohorte rétrospective utilisant les données des registres du cancer et des naissances de quatre régions des États-Unis a analysé les descendants de 1 898 patientes atteintes de tumeurs diagnostiquées pour la première fois avant l’âge de 20 ans (période : 1973-2000) par rapport à un groupe témoin non exposé (n=14 278). Il en est ressorti une augmentation significative des naissances prématurées (RR 1,54 ; IC à 95% 1,30-1,83) et des naissances d’un poids inférieur à 2500 g (RR 1,31 ; IC à 95% 1,10-1,57). Cependant, là encore, aucune augmentation des taux de malformations, de mort fœtale intra-utérine ou d’aberrations chromosomiques n’a été observée dans la descendance [23]. Une évaluation correspondante des grossesses de patients masculins ayant survécu à une tumeur (n=470) n’a montré aucune augmentation des naissances prématurées, des retards de croissance, des taux de malformations ou des aberrations chromosomiques [24].
Une revue récente examine les résultats reproductifs après un traitement réussi de la leucémie et du lymphome pendant l’enfance et l’adolescence, en prenant en compte 18 études pertinentes [3] : Chez les survivants à long terme, aucune augmentation des avortements spontanés, du diabète ou de l’anémie maternels, des enfants mort-nés, des malformations infantiles ou des tumeurs n’a été constatée chez la descendance. Cependant, le taux de naissances vivantes était inférieur à celui d’un groupe témoin non exposé, tandis que les naissances prématurées et les faibles poids à la naissance étaient plus fréquents.
Traitement des tumeurs pendant la grossesse
Si une tumeur est diagnostiquée pour la première fois pendant la grossesse, il existe des méthodes thérapeutiques tout à fait tolérables pour la mère et le fœtus. Le choix du traitement doit être fait en mettant en balance le bien-être maternel et le bien-être fœtal.
Le cancer du sein, le cancer du col de l’utérus, les hémopathies malignes et les mélanomes représentent 70% de tous les diagnostics de tumeurs pendant la grossesse [25].
La décision de commencer un traitement systémique pendant la grossesse dépend du stade de la tumeur, de l’âge gestationnel, du type de tumeur, des bénéfices attendus et des risques à craindre. Comme les cytostatiques peuvent affecter l’organogenèse, il existe un risque de malformation de 10 à 20 % en cas de chimiothérapie au premier trimestre. En revanche, le taux de malformations lors de l’administration de cytostatiques au cours des deuxième et troisième trimestres correspond au risque général de base de 3-5% [26]. C’est pour le cancer du sein que l’on dispose de la plus grande expérience en matière de grossesse : Les régimes thérapeutiques à base d’anthracyclines comme le FEC (5-fluorouracile, épirubicine, cyclophosphamide) ou le FAC (5-fluorouracile, doxorubicine, cyclophosphamide) ont fait leurs preuves [27]. Les taxanes et les composés du platine peuvent également être utilisés pendant la grossesse.
Pour les immunothérapies, les preuves sont actuellement insuffisantes pendant la grossesse. L’hormonothérapie doit être évitée pendant la grossesse. En ce qui concerne l’issue de la grossesse, une augmentation modérée des naissances prématurées et des restrictions de croissance se dessine.
Littérature :
- Office fédéral de la statistique (OFS) : Rapport suisse sur le cancer 2015. Situation et développements. Neuchâtel 2016.
- Eibye S, Kjaer SK, Mellemkjaer L : Incidence du cancer lié à la grossesse au Danemark 1997-2006. Obstet Gynecol 2013 ; 122 : 608-617.
- Shliakhtsitsava K, et al : Pregnancy and child health outcomes in pediatric and young adult leukemia and lymphoma survivors : a systematic review. Leuk Lymphoma 2018 ; 59(2) : 381-397.
- Kort JD, et al : Fertility issues in cancer survivorship. CA Cancer J Clin 2014 Mar-Avr ; 64(2) : 118-134.
- Lambertini M, et al : Cancer and fertility preservation : international recommendations from an expert meeting. BMC Med 2016 ; 14 : 1.
- Balachandren N, Davies M : Fertilité, réserve ovarienne et cancer. Maturitas 2017 ; 105 : 64-68.
- Gadducci A, Cosio S, Genazzani AR : Fonctionnement de l’ovaire et problèmes de gestation chez les survivantes du cancer du sein. Gynecol Endocrinol 2007 ; 23(11) : 625-631.
- Boltežar L, Pintarić K, Jezeršek Novaković B : Fertility in young patients following treatment for Hodgkin’s lymphoma : a single center survey. J Assist Reprod Genet 2016 ; 33(3) : 325-333.
- Metzger ML, et al : La santé reproductive féminine après les cancers de l’enfance, de l’adolescence et de la jeune adulte : lignes directrices pour l’évaluation et la gestion des complications reproductives féminines. J Clin Oncol 2013 ; 31(9) : 1239-1247.
- Bruhn C : Grossesse après ou pendant un cancer. Dtsch Med Wochenschr 2014 ; 139 : 1146-1147.
- Green DM, et al : Fertilité des survivants masculins du cancer de l’enfant : un rapport de l’étude sur les survivants du cancer de l’enfant. J Clin Oncol 2010 ; 28(2) : 332-339.
- Ginsberg JP : Educational paper : the effect of cancer therapy on fertility, the assessment of fertility and fertility preservation options for pediatric patients. Eur J Pediatr 2011 ; 170(6) : 703-708.
- Senra JC, et al : Gonadotropin-releasing hormone agonists for ovarian protection during cancer chimiotherapy : systematic review and meta-analysis. Ultrasound Obstet Gynecol 2017 Oct 21. DOI : 10.1002/uog.18934 [Epub ahead of print].
- Wunder C, et al : Recommandations suisses pour la préservation de la fertilité des patients en âge de procréer avant les thérapies cytotoxiques. Forum Med Suisse 2012 ; 37 : 708-709.
- American Society for Reproductive Medicine, Practice Committee : Ovarian tissue cryopreservation : a committee opinion. Fertil Steril 2014 ; 101(5) : 1237-1243.
- Reinmuth S, et al. : Avoir des enfants après avoir survécu à un cancer pendant l’enfance ou l’adolescence – résultats d’une enquête berlinoise. Klin Padiatr 2008 ; 220 : 159-165.
- Stensheim H, et al : Pregnancy after adolescent and adult cancer : a population-based matched cohort study. Int J Cancer 2011 ; 129 : 1225-1236.
- Partridge AH, Ruddy KJ : Fertilité et traitement adjuvant chez les jeunes femmes atteintes d’un cancer du sein. Breast 2007 ; 16(Suppl 2) : S175-181.
- Lambertini M, et al : Long-term Safety of Pregnancy Following Breast Cancer According to Estrogen Receptor Status. J Natl Cancer Inst 2017 Oct 26. DOI : 10.1093/jnci/djx206 [Epub ahead of print].
- Azim HA Jr, et al : Safety of pregnancy following breast cancer diagnosis : a meta-analysis of 14 studies. Eur J Cancer 2011 ; 47(1) : 74-83.
- Hawkins MM : Pregnancy outcome and offspring after childhood cancer. BMJ 1994 ; 309(6961) : 1034.
- Green DM, et al : Insuffisance ovarienne et résultats de la reproduction après traitement du cancer de l’enfant : résultats de l’étude sur les survivants du cancer de l’enfant. J Clin Oncol 2009 ; 27(14) : 2374-2381.
- Mueller BA, et al : Pregnancy outcomes in female childhood and adolescent cancer survivors : a linked cancer-birth registry analysis. Arch Pediatr Adolesc Med 2009 ; 163(10) : 879-886.
- Chow EJ, et al : Reproductive outcomes in male childhood cancer survivors : a linked cancer-birth registry analysis. Arch Pediatr Adolesc Med 2009 ; 163(10) : 887-894.
- Boere I, et al : Cancer in pregnancy : safety and efficacy of systemic therapies. Curr Opin Oncol 2017 ; 29(5) : 328-334.
- Ngu SF, Ngan HY : Chimiothérapie pendant la grossesse. Best Pract Res Clin Obstet Gynaecol 2016 ; 33 : 86-101.
- Shachar SS, et al : Multidisciplinary Management of Breast Cancer During Pregnancy. Oncologist 2017 ; 22(3) : 324-334.
- Green DM, et al : Fertilité des femmes survivantes du cancer de l’enfant : un rapport de l’étude sur les survivantes du cancer de l’enfant. J Clin Oncol 2009 ; 27(16) : 2677-2685.
- Peccatori FA, et al : Cancer, grossesse et fertilité : ESMO Clinical Practice Guidelines for Diagnosis, Treatment and follow-up. Ann Oncol 2013 ; 24(Suppl 6) : vi160-170.
InFo ONKOLOGIE & HÄMATOLOGIE 2017 ; 5(6) : 27-30