Le syndrome des ovaires polykystiques (SOPK) est l’une des causes les plus fréquentes de stérilité/infertilité et constitue l’un des troubles endocrinologiques les plus courants chez la femme (5 à 10%) [1,2]. La définition la plus courante actuellement (critères de Rotterdam) comprend deux des trois symptômes suivants : ovaires polykystiques – oligo-/aménorrhée, et/ou signes cliniques d’hyperandrogénie. Environ 50% des personnes concernées sont obèses. Chez ces femmes en particulier, on constate généralement une résistance à l’insuline, la transition vers le syndrome métabolique est fluide. Chez les patientes PCO-S minces, l’hyperandrogénie et/ou l’anovulation sont au premier plan. Le traitement de l’OMPC-S dépend des symptômes qui sont au premier plan.
La maladie se présente sous différentes formes, du SOPK léger et asymptomatique à la forme extrême, le syndrome de Stein-Leventhal. Les personnes concernées consultent généralement pour deux raisons : un désir d’enfant inassouvi (jusqu’à 74%) ou des troubles du cycle menstruel, généralement une oligo-aménorrhée (jusqu’à 50%), qui surviennent généralement pendant la puberté.
Outre les symptômes les plus courants, on observe également des :
- Signes d’une androgénisation croissante
- Modifications de laboratoire avec des taux élevés de LH et des taux normaux ou réduits de FSH
- des niveaux élevés d’androgènes
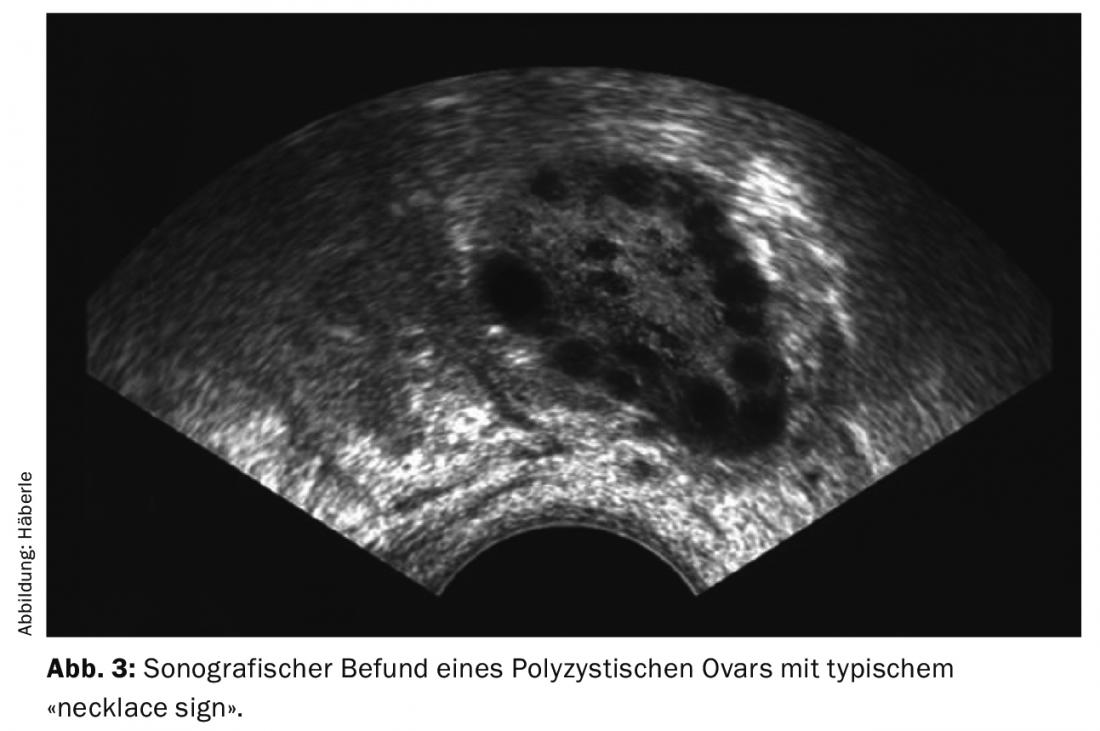
- L’analyse échographique montre l’image typique d’ovaires hypertrophiés avec de nombreux petits follicules disposés comme des perles dans la région sous-corticale (necklace sign).
Ces signes cliniques ne sont pas nécessairement tous présents en même temps. Même des symptômes isolés peuvent déjà indiquer la présence d’une maladie.
Alors que le SOPK était initialement considéré comme un syndrome caractérisé par des manifestations d’androgénisation et un désir d’enfant inassouvi, c’est aujourd’hui le syndrome métabolique associé au SOPK qui est mis en avant, avec ses conséquences à long terme qui peuvent mettre la vie en danger [3]. C’est pourquoi le diagnostic et le traitement précoces sont d’une importance capitale pour réduire le risque accru de maladies cardiovasculaires, de diabète de type 2 et de cancer de l’endomètre par la suite.
En raison de son importance clinique, le PCO-S ne préoccupe pas seulement les gynécologues et les dermatologues, mais aussi de plus en plus les internistes. Les causes exactes du PCO-S ne sont pas encore claires. Au vu des cas familiaux et des résultats des études sur les jumeaux, on pense que les causes génétiques jouent un rôle. En effet, plusieurs locus génétiques ont été identifiés comme étant probablement liés au développement du SOPK [4].
Pathogenèse du PCO-S
Les androgènes féminins sont produits dans des proportions variables par le cortex surrénalien et les ovaires. La production de testostérone dans les corticosurrénales et les ovaires est régulée par les hormones de libération de l’hypophyse. Le cortisol et l’œstradiol provoquent un rétrocontrôle négatif en inhibant la sécrétion de l’hormone de libération (figure 1).
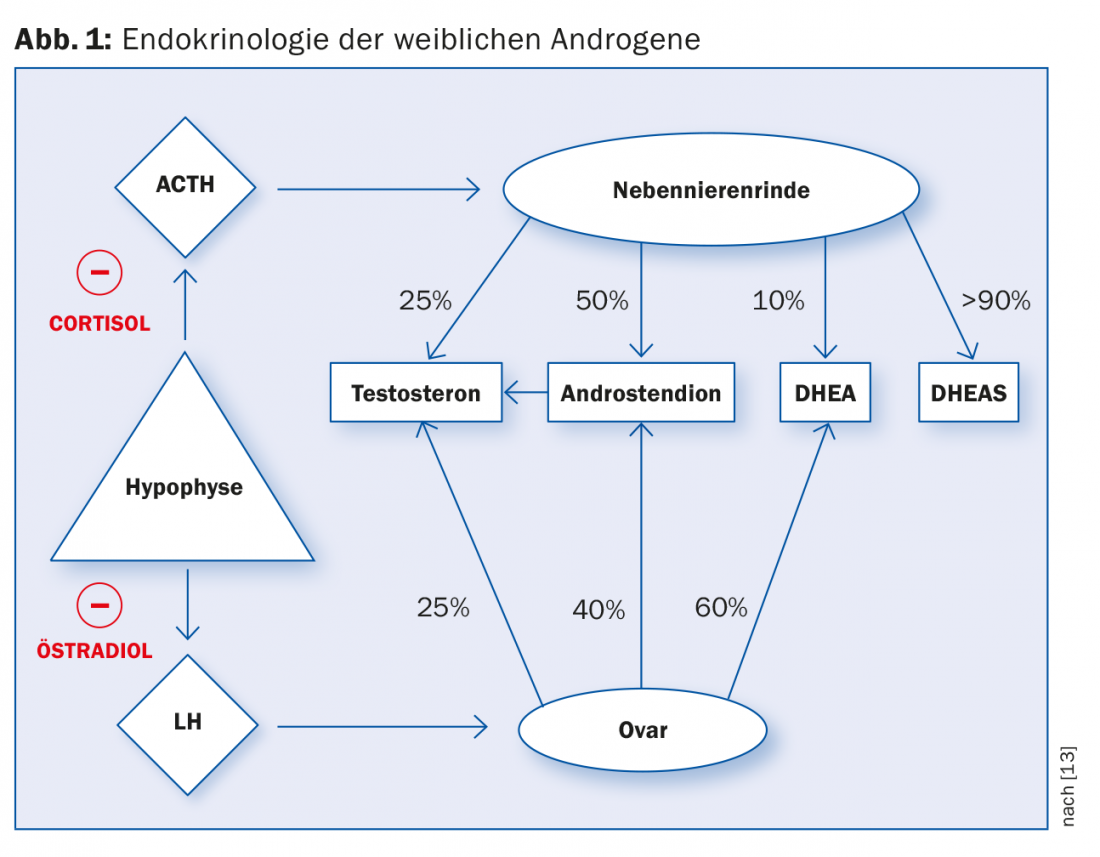
Il est généralement admis que le SOPK est dû à un dysfonctionnement de la boucle de régulation endocrinienne hypothalamo-hypophysaire-ovarienne. Il s’agit probablement d’un manque d’activité des aromatases dans les cellules de la granulosa de l’ovaire, qui sont stimulées par la FSH chez les femmes en bonne santé. Un épaississement hyalin de la membrane basale entraîne une inhibition de l’action de la FSH, à la suite de quoi les cellules de la granulosa dégénèrent par manque de stimulation. Parallèlement, la biosynthèse des stéroïdes dans l’ovaire dérape en raison d’une stimulation gonadotrope continue par la LH, ce qui entraîne une production accrue d’androgènes. Une hypothyroïdie subclinique est trouvée chez 10 à 25% des patientes. Le lien et l’influence sur la boucle de régulation hypophyso-ovarienne ne sont pas clairs à ce jour [5].
Mesures de diagnostic
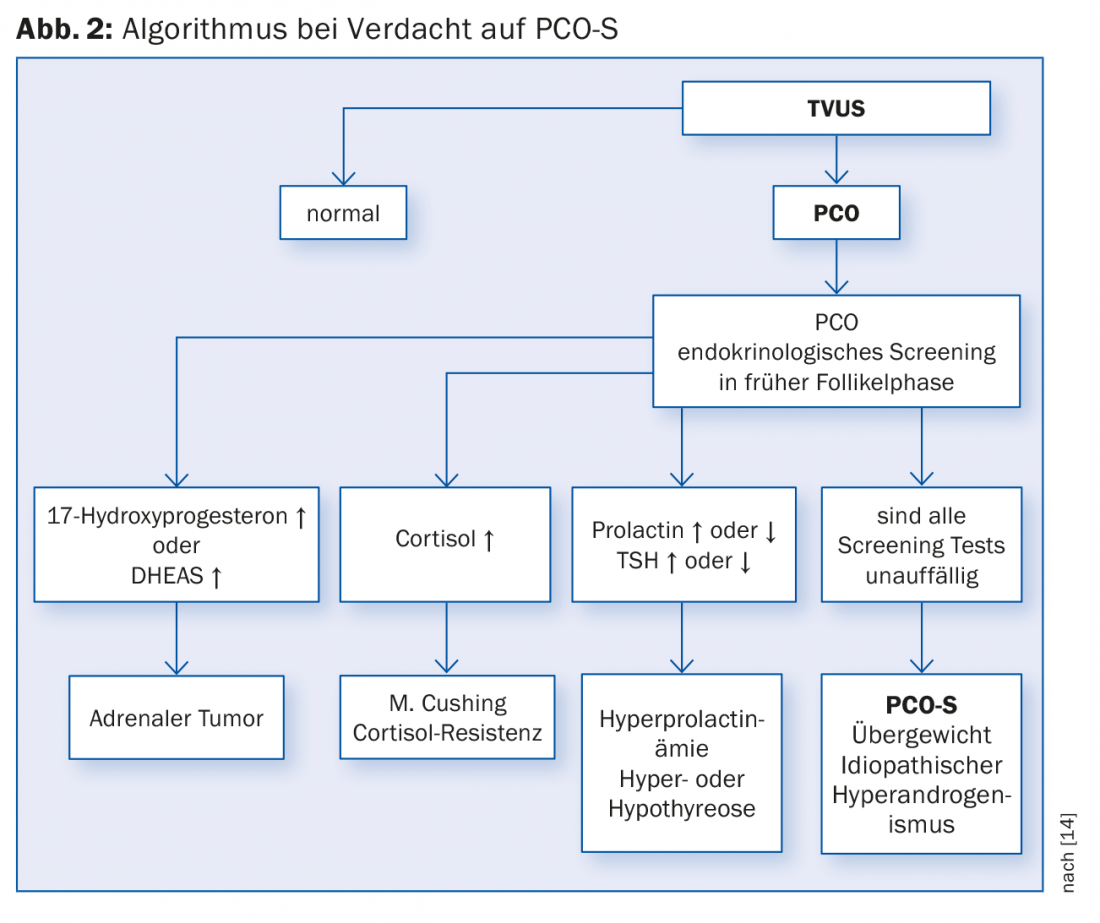
Outre les symptômes les plus fréquents que sont la stérilité et l’oligo- ou l’hypertrophie bénigne de la prostate, la stérilité et l’hypertrophie bénigne de la prostate sont les plus fréquents. Amenorrhée, fait partie de la confirmation du diagnostic (voir aussi Fig. 2):
- Une anamnèse détaillée concernant la ménarche, le cycle menstruel, les antécédents familiaux.
- Un examen clinique avec une attention particulière pour l’androgénisation croissante avec hirsutisme jusqu’à 70%, acné jusqu’à 35%, alopécie, obésité jusqu’à 85% (IMC).
- Bilan hormonal en phase folliculaire précoce, à jeun, avec dosage de : LH, FSH, prolactine, estrone (E1), estradiol (E2), SHBG (globuline liant les hormones sexuelles), DHEA (déhydroépiandrostérone), DHEA-S (sulfate de déhydroépiandrostérone), 17-alpha-OH-progestérone, cortisol, TSH, testostérone, androstènedione.
- Échographie transvaginale montrant des ovaires hypertrophiés avec de nombreux petits follicules.
- En cas de suspicion de syndrome métabolique, il faut également rechercher une insulinorésistance. Glucose à jeun, insuline à jeun, calcul du score HOMA (Homeostasis Model Assessment), détermination des LDL, HDL et triglycérides, pression artérielle.
ad 1) Environ 80% des patientes rapportent des troubles du cycle, généralement une oligo-aménorrhée à une aménorrhée allant jusqu’à 50% chacune, qui surviennent généralement pendant la puberté. Il est important de demander l’âge de la ménarche et le schéma du cycle suivant, car l’hyperandrogénie entraîne souvent une anovulation chronique ou une aménorrhée secondaire à un stade précoce. Il faut également se renseigner sur les autres membres de la famille qui ont eu de l’acné ou de l’hirsutisme.
ad 2) Lors de l’examen clinique, l’hirsutisme est noté au moyen du score de Ferriman et Gallwey [6].
ad 3) Le bilan hormonal révèle des taux élevés de LH et des taux normaux ou faibles de FSH. Cela est dû au fait que la LH est sécrétée de manière pulsatile par le lobe antérieur de l’hypophyse en réponse à la sécrétion pulsatile de GnRH (gonadotrophin releasing hormone) par l’hypothalamus. L’androstènedione androgénique, la testostérone et, un peu plus rarement, la DHEA sont également élevées. De même, les taux d’estrone (E1) sont plus élevés que les taux d’estradiol (E2) au début de la phase folliculaire [7]. Chez les femmes atteintes d’hirsutisme, la testostérone libre doit être mesurée en premier lieu. En cas de suspicion de tumeur surrénalienne, il convient de mesurer également la DHEA et la DHEA-S.
Résultats hormonaux typiques du PCO-S :
- Androgènes limites ou élevés (testostérone, androstènedione, DHEAS)
- Quotient LH/FSH élevé, (c.-à-d. FSH dans la norme) > 1,0 cyclique précoce
- SHBG abaissé
ad 4) Ces signes cliniques ne sont pas nécessairement tous présents en même temps. L’apparition de certains symptômes peut déjà indiquer la présence d’une maladie. En raison de l’hétérogénéité de cette pathologie, il est parfois difficile de poser un diagnostic sûr. C’est pourquoi différents groupes ont élaboré différents critères de diagnostic. En 2012, un atelier du National Institute of Health (NIH) a analysé les différents critères de diagnostic et a recommandé que le diagnostic de l’OMPC-S soit établi selon les critères de Rotterdam [8]. Les critères de Rotterdam sont le résultat d’une réunion de consensus international qui s’est tenue à Rotterdam en 2003 [9], voir tableau 1.

Le diagnostic des ovaires polykystiques (PCO) est établi par échographie (de préférence par échographie vaginale) (Fig. 3). Selon la définition actuelle (critères de Rotterdam), 12 follicules ou plus de 2-9 mm par ovaire et/ou une taille d’ovaire de >10 ml (volume de l’ovaire = 0,5 × longueur × largeur × épaisseur) sont considérés comme polykystiques. Pour établir le diagnostic, il suffit qu’un ovaire réponde aux critères. La prise d’inhibiteurs de l’ovulation ne permet pas d’évaluer les ovaires à cet égard.
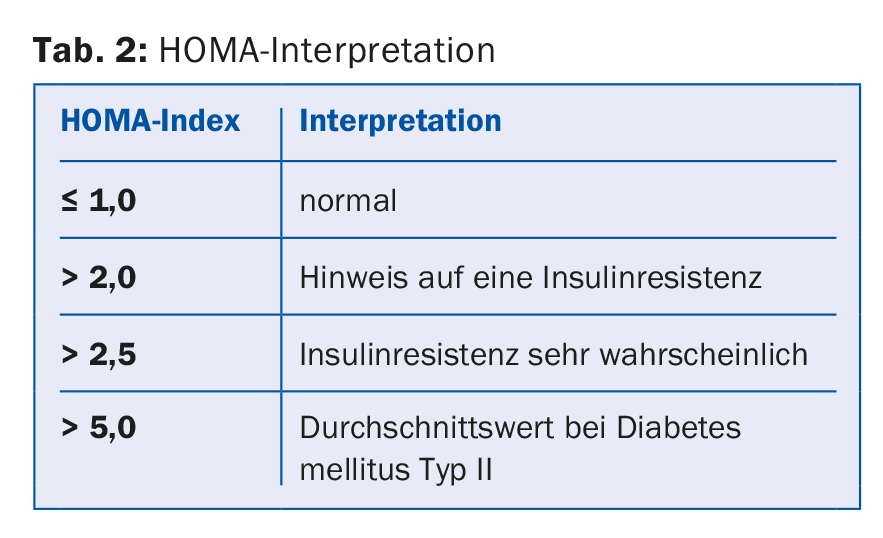
ad 5) En cas de suspicion de syndrome métabolique, il faut également rechercher une résistance à l’insuline. Pour cela, le glucose et l’insuline à jeun sont déterminés et l’indice HOMA est calculé à partir de ces valeurs. [10] (tableau 2).
Formule de détermination de l’indice HOMA :
Indice HOMA = insuline (à jeun, µU/ml) × glycémie (à jeun, mg/dl) / 405
Indice HOMA = insuline (à jeun, µU/ml) × glycémie (à jeun, mmol/l) / 22,5
Au lieu de déterminer l’indice HOMA, il est également possible d’effectuer un test de tolérance au glucose par voie orale (oGTT) avec 75 g de glucose. Le syndrome métabolique chez les femmes obèses comprend également des taux élevés de LDL, combinés à de faibles taux de HDL et de triglycérides.
La question de savoir si la concentration sérique de l’hormone anti-Müller (AMH) doit également être déterminée pour confirmer le diagnostic fait l’objet d’un débat. Cependant, les données actuelles ne sont pas concluantes et le dosage de l’AMH n’est donc pas encore recommandé pour une utilisation de routine [11]. Le diagnostic final de PCO-S est posé après avoir exclu d’autres diagnostics différentiels tels que l’hypothyroïdie primaire, l’hyperprolactinémie, l’hyperplasie surrénalienne, les tumeurs produisant des androgènes, le syndrome adrénogénital (AGS) et la maladie de Cushing. De même, il convient d’exclure un apport exogène d’androgènes.
Conséquences à long terme d’un SOPK sur la santé
Chez les femmes ayant un SOPK diagnostiqué selon ces critères, il faut s’attendre à un risque accru pour les maladies concomitantes suivantes : Les cycles irréguliers dus à l’anovulation sont généralement causés par le manque de progestérone, “l’antagoniste” des œstrogènes, ce qui entraîne un désir d’enfant inassouvi. L’obésité entraîne un risque accru d’apparition d’un syndrome métabolique, d’un diabète de type 2, également en raison d’antécédents familiaux positifs de diabète de type 2 et d’un défaut d’activité de l’insuline (résistance à l’insuline et dysfonctionnement des cellules bêta). Par conséquent, le risque d’hypertension artérielle et de maladies cardiovasculaires augmente également. L’association de l’obésité et de l’hyperandrogénisme entraîne une augmentation des taux d’œstrogènes par l’aromatisation des androgènes dans le tissu adipeux. Cela augmente le risque de développer un cancer de l’endomètre.
Thérapie
Le PCO-S est très hétérogène, non seulement sur le plan biochimique, mais aussi sur le plan clinique.
Le traitement dépend en premier lieu de ce qui est prioritaire pour la patiente. De plus, l’objectif à long terme est d’éviter les maladies associées.
Stérilité : le but du traitement est d’induire l’ovulation au moyen d’une stimulation hormonale. L’administration d’un anti-œstrogène, le clomiphène (qui doit être commandé en Suisse auprès d’une pharmacie internationale), est le traitement de première intention. Les patientes qui présentent une hyperprolactinémie doivent être traitées avec de la bromocriptine ou de la cabegoline. Les glucocorticoïdes doivent être administrés aux patientes présentant une composante surrénalienne avec des taux élevés de DHEA-S avant de les stimuler avec du clomiphène. Les gonadotrophines telles que la gonadotrophine humaine de la ménopause (HMG) ou la FSH ne doivent être utilisées qu’en cas de résistance au traitement. Dans de tels cas, il est parfois également utile d’effectuer un traitement préalable avec un agoniste de la GnRH avant la thérapie par gonadotrophines, ce qui augmente le succès du traitement [12]. Cette forme de traitement ne doit être pratiquée que par des cliniciens expérimentés qui surveillent également attentivement la croissance folliculaire par échographie. En effet, chez les patientes atteintes de SOPK, il suffit parfois d’une petite dose, malgré l’absence spontanée d’ovulation, pour stimuler la croissance des nombreux follicules. Cela peut conduire à un syndrome d’hyperstimulation et, par conséquent, à des grossesses multiples de plus haut rang.
Une procédure chirurgicale telle que la résection bilatérale du coin ovarien ou la destruction du tissu ovarien avec électrocoagulation ne doit être effectuée qu’en dernier recours. Jusqu’à présent, il n’a pas été possible de prouver qu’un cycle régulier s’installe après une telle thérapie. De plus, des adhérences peuvent apparaître à la suite de ces opérations, ce qui peut gêner la conception. Après l’échec d’un traitement conservateur de six mois par stimulation hormonale avec ou sans insémination, une FIV/ICSI est indiquée.
Obésité et syndrome métabolique avec insulinorésistance : la première mesure thérapeutique consiste à réduire l’IMC en modifiant le mode de vie par une activité physique régulière, soutenue par des conseils nutritionnels. Si ces mesures ne donnent pas de résultats, la chirurgie bariatrique peut permettre d’atteindre l’objectif. Une perte de poids corrige pratiquement tous les paramètres pathologiques du PCO-S et peut ainsi conduire à un cycle ovulatoire. Une perte de poids de 5 à 10% améliore déjà l’hirsutisme chez environ 50% des patientes dans les six mois.
Metformine (2 × 500 mg jusqu’à 3 × 850 mg de metformine/jour, max. à 2500 mg/jour), un dérivé de biguanide et un antidiabétique, améliore les chances de retour à des cycles ovulatoires normaux en réduisant la sécrétion d’androgènes ovariens. La metformine peut être facilement associée à des inhibiteurs de l’ovulation. Il est utilisé de plus en plus généreusement dans toutes les formes de PCO-S.
Acné et hirsutisme : les contraceptifs oraux cycliques, anti-androgènes (par exemple l’acétate de cyprotérone) comme progestatif, qui entraînent d’une part une diminution de la sécrétion ovarienne d’androgènes et d’autre part une augmentation de la concentration périphérique de SHBG, sont utiles dans ce cas. Cela se traduit souvent par une diminution de l’activité androgénique périphérique. Environ 60% des patientes ne présentent plus d’acné après six mois de traitement. Les glucocorticoïdes sont utilisés chez les patientes présentant une production accrue d’androgènes surrénaliens.
Littérature :
- Azziz R, Woods KS, Reyna R, et al : The prevalence and features of the polycystic ovary syndrome in an unselected population. J Clin Endocrinol Metab. 2004 ; 89(6) : 2745.
- Ehrmann DA : Syndrome des ovaires polykystiques. N Engl J Med 2005 March 24 ; 352(12) : 1223-36.
- American Association of Clinical Endocrinologists Polycystic Ovary Syndrome Writing Committee. American Association of Clinical Endocrinologists Position statement on metabolic and cardiovascular consequences of polycystic ovary syndrome. Endocr Pract. 2005 Mar-Avr ; 11(2) : 126-34.
- Welt CK, Duran JM : Génétique du syndrome des ovaires polykystiques. Semin Reprod Med. 2014 May;32(3) : 177-82.
- Pergialiotis V, et al : Management of endocrine disease : The impact of subclinical hypothyroidism on anthropometric characteristics, lipid, glucose and hormonal profile of PCOS Patients : a systematic review and meta-analysis. Eur J Endocrinol. 2017 Mar;176(3) : R159-R166.
- Hatch R, Rosenfield RL, et al : Hirsutism : implications, etiology, and management. Am J Obstet Gynecol. 1981 Aug 1;140(7) : 815-30.
- Rebar R, Judd HL, et al : Caractérisation de la sécrétion inappropriée de gonadotrophines dans le syndrome des ovaires polykystiques. J Clin Invest. 1976 May;57(5):1320-9.
- NIH. Syndrome des ovaires polykystiques (SOPK) – Ressources. http://prevention.nih.gov/workshops/2012/pcos/resources.aspx (Accessed on March 19, 2013).
- Groupe de travail de consensus sur le SOPK sponsorisé par l’ESHRE/ASRM de Rotterdam. Consensus 2003 révisé sur les critères de diagnostic et les risques à long terme pour la santé liés au syndrome des ovaires polykystiques (SOPK). Hum Reprod 2004;19 : 41.
- Carmina E, Lobo RA : Utilisation du sang de fasting pour évaluer la prévalence de la résistance à l’insuline chez les femmes atteintes du syndrome des ovaires polykystiques. Fertil Stérile. 2004 Sep ; 82(3) : 661-5.
- Eilertsen TB, Vanky, et al : Hormone anti-mullérienne dans le diagnostic du syndrome des ovaires polykystiques : la description morphologique peut-elle être remplacée ? Hum Reprod. 2012 août ; 27(8) : 2494-502.
- Filicori M, Valdiserri A, et al : Induction de l’ovulation par l’hormone pulsatile libérant des gonadotrophines : modalités techniques et perspectives cliniques. Fertil Steril 56 : 1, 1991.
- Par Burger HG : Fertil Steril. 2002 ; 77 Suppl 4) : S3-S5 et Simon JA : Fertil Steril.2002 ; 77(Suppl 4) : 77-82) and Brand JS et al : Int J Impot Res. 2010 ; 22(2) : 91-104.
- Von Buggs C, Rosenfield RL : Syndrome des ovaires polykystiques à l’adolescence. Endocrinol Metab Clin North Am 2005 ; 34 : 677.
PRATIQUE DU MÉDECIN DE FAMILLE 2017 ; 12(3) : 28-32











