L’incidence du cancer de l’endomètre est en augmentation. Chez les femmes ménopausées, il se manifeste généralement très tôt par des saignements vaginaux. Plus de 70% des patientes sont au stade I de la FIGO au moment du diagnostic. Le traitement chirurgical consiste en une hystérectomie, une annexectomie bilatérale et, selon le profil de risque, une lymphonectomie sentinelle et/ou pelvienne et para-aortique. Le traitement adjuvant est déterminé par la classification du stade et le risque de récidive.
Le cancer de l’endomètre est la tumeur gynécologique maligne la plus fréquente et la sixième maladie maligne la plus fréquente dans le monde. L’incidence annuelle en Europe occidentale est en augmentation et se situe actuellement entre 10 et 25 pour 100 000 femmes [1]. La maladie est généralement diagnostiquée à des stades précoces, limités à l’utérus, et chez la femme postménopausée en raison de saignements vaginaux. En préménopause, la maladie peut se manifester par des changements dans l’intensité et la fréquence des règles.
Nouvelle classification de biologie moléculaire ?
Le cancer de l’endomètre est classiquement divisé en deux catégories : Le type I, plus fréquent (80%), à partir d’hyperplasies endométriales atypiques, correspond histologiquement à des adénocarcinomes endométriaux. Les carcinomes de type II ont une évolution plus agressive et comprennent les carcinomes à cellules claires et séreux ainsi que les carcinosarcomes. Cependant, cette classification, basée uniquement sur l’histologie, est désormais remise en question. Une nouvelle classification de biologie moléculaire est actuellement en discussion, qui serait éventuellement plus pertinente sur le plan pronostique et thérapeutique. L’âge moyen au moment du diagnostic était jusqu’à présent considéré comme plus élevé pour les cancers de type II. Cependant, une étude prospective portant sur plus d’un million de Norvégiennes et incluant 992 cancers de type II n’a pas montré de différence (âge moyen dans les deux groupes : 65 ans) [2].
Le cancer de l’endomètre de type I est œstrogéno-dépendant. En outre, l’utilisation à long terme d’œstrogènes sans protection progestative, le syndrome métabolique avec obésité, la ménarche précoce, la ménopause tardive, les traitements au tamoxifène et les taux élevés d’œstrogènes (par exemple dans le syndrome des ovaires polykystiques) sont considérés comme des facteurs de risque pour les cancers de type 1. L’hypertension artérielle et le diabète sucré en font également partie. En outre, un cancer de l’endomètre apparaît chez 40 à 60 des patientes atteintes du syndrome de Lynch et chez 5 à 10 % des patientes atteintes du syndrome de Cowden.
En revanche, la contraception hormonale réduit le risque de cancer de l’endomètre d’environ 50%. Le tabagisme semble également être un facteur protecteur. Son effet protecteur s’explique par la stimulation du métabolisme hépatique des œstrogènes. D’autres facteurs protecteurs sont un âge élevé à la dernière naissance et la consommation de café et de thé.
Staging et évaluation des risques
Depuis 2009, la version actualisée de la classification des stades selon la FIGO [3] est en vigueur (tab. 1). La survie à 5 ans pour le stade IA est de ~90%, pour le stade IB de 78% et tombe à 57% pour le stade IIIC1 resp. à 49% en cas d’atteinte ganglionnaire para-aortique (IIIC2) [4].
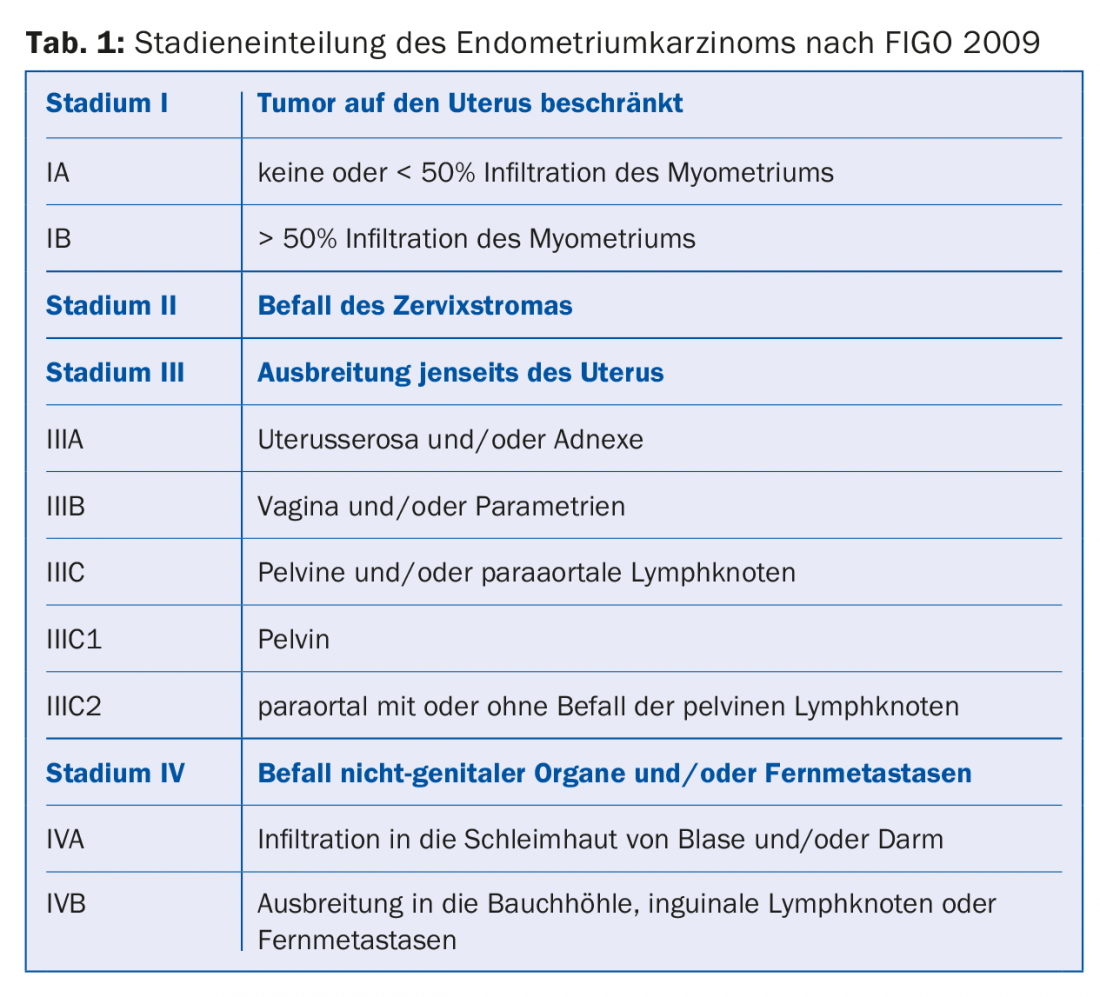
Au stade I, trois groupes de risque sont définis en fonction du degré de maturation histologique (G1-3) et de l’histologie (type endométrioïde vs type non endométrioïde) (tab. 2). Une analyse moléculaire complète de 373 cancers de l’endomètre, publiée en 2013, a identifié quatre sous-types différents en termes de pronostic. Cela pourrait conduire à l’avenir à une nouvelle classification qui modifierait éventuellement le traitement du cancer de l’endomètre [5].

Diagnostic
Il n’existe pas de mesure de dépistage du cancer de l’endomètre fondée sur des preuves. La maladie est généralement diagnostiquée chez la femme ménopausée en raison de saignements vaginaux. En préménopause, elle peut se manifester par des changements dans l’intensité et la fréquence des règles. Le diagnostic peut souvent être suspecté à l’aide d’une échographie vaginale, puis confirmé par une biopsie de l’endomètre (pipelle de Cornier). Il est important de déterminer si la source du saignement est réellement la cavité utérine et non le col de l’utérus, le vagin, le rectum ou même la vessie. Si la pipelle n’est pas possible ou si la biopsie n’est pas représentative, le diagnostic est établi par hystéroscopie et curetage. En cas de suspicion d’un stade avancé, un scanner abdominal peut être réalisé pour le staging préopératoire.
Chirurgie
Désir d’enfant : en cas de désir d’enfant urgent et de carcinome endométrioïde bien différencié de stade T1a, un traitement de préservation de la fertilité peut être envisagé s’il a été vérifié par hystéroscopie qu’il n’y a pas de carcinome résiduel in utero. Une infiltration myométriale ainsi qu’une métastase ovarienne doivent être exclues par une échographie transvaginale, une IRM et une laparoscopie. Les patientes doivent être informées de la probabilité plus élevée de récidive, de la possibilité de progression et de la nécessité d’un suivi étroit. Une application orale continue de progestatif avec de l’acétate de médroxyprogestérone 200 mg/j est le traitement de choix. Un contrôle est effectué tous les trois mois avec une échographie transvaginale, une hystéroscopie et une biopsie de l’endomètre. Une grossesse ne doit être envisagée qu’après un re-staging normal, éventuellement avec une procréation assistée, afin de réduire au maximum le délai avant la grossesse. Une fois le désir d’enfant satisfait, un traitement chirurgical adapté au stade est nécessaire, en raison du risque élevé de récidive .
Staging par laparoscopie : Sauf en cas de désir d’enfant urgent et de situation à haut risque avec opérabilité limitée, un traitement chirurgical est effectué en premier lieu. Le staging chirurgical systématique consiste en une hystérectomie, une annexectomie bilatérale et, selon le profil de risque, une lymphonectomie sentinelle et/ou pelvienne et paraaortique. Dans de rares cas, une omentectomie est également indiquée. Traditionnellement, le staging du cancer de l’endomètre était effectué par laparotomie. Cependant, ces dernières années, plusieurs études ont comparé le staging par laparotomie et le staging par laparoscopie [6]. Les avantages évidents de la laparoscopie par rapport à la chirurgie ouverte classique (moins de complications et une hospitalisation plus courte), avec une fréquence de récidive et un taux de survie à 5 ans identiques, ont été démontrés dans des études randomisées et des méta-analyses. (Fig. 1). En ce qui concerne la chirurgie assistée par robot, aucune étude n’a été publiée à ce jour montrant un avantage par rapport à la laparoscopie dans le traitement chirurgical du cancer de l’endomètre.
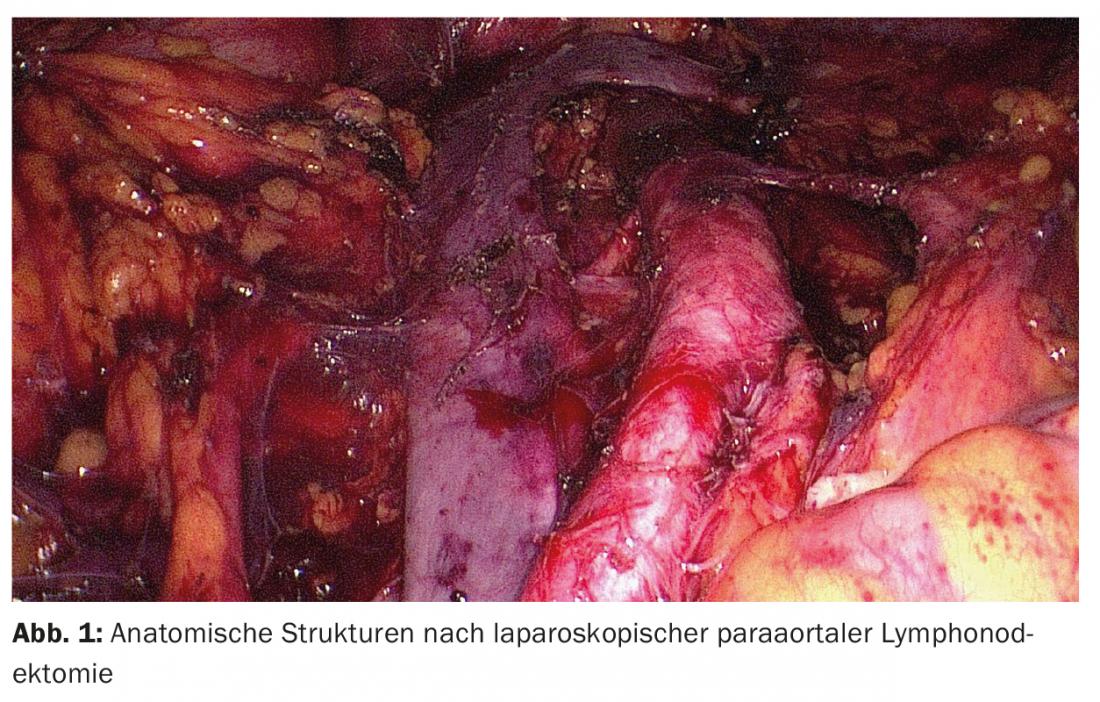
Lymphonodectomie : une question clé controversée est de savoir quand une lymphonodectomie doit être effectuée et dans quelle mesure. Deux études multicentriques randomisées, qui présentent malheureusement de graves défauts de forme, n’ont pas pu démontrer un avantage de survie pour la lymphonectomie pelvienne seule [7,8]. Les données sur l’importance de la lymphonectomie pelvienne et para-aortique systématique sont rares ; il n’existe pas d’études prospectives randomisées. Une étude de cohorte rétrospective a montré que les patientes à risque de récidive moyen ou élevé ayant subi une lymphonectomie pelvienne et paraaortique avaient une espérance de vie plus longue que celles ayant subi une lymphonectomie pelvienne uniquement. Cet avantage n’a pas été constaté en cas de risque faible [9].
Même si l’effet thérapeutique direct de la lymphonectomie reste controversé, il est généralement admis qu’elle sert à évaluer le pronostic et à décider du traitement adjuvant. Si les ganglions lymphatiques sont normaux, il n’est pas nécessaire de recourir à un traitement adjuvant, ce qui permet d’éviter une toxicité inutile. Comme la lymphonectomie augmente la morbidité opératoire et postopératoire, elle ne devrait être pratiquée qu’en cas de forte probabilité de ganglions atteints de cancer. Une étude de cohorte prospective montre que chez les patientes présentant un risque de récidive moyen ou élevé, les ganglions lymphatiques pelviens étaient positifs dans 17% des cas et les ganglions para-aortiques dans 12% des cas. 55% des patientes ayant des ganglions lymphatiques pelviens positifs avaient également des ganglions lymphatiques para-aortiques positifs. En outre, 3% des patientes ayant des ganglions lymphatiques pelviens négatifs avaient des ganglions lymphatiques para-aortiques positifs.
Il est intéressant de noter que la majorité des patientes dont les ganglions lymphatiques paraaortiques étaient positifs présentaient une atteinte entre les vaisseaux rénaux et l’artère mésentérique inférieure (IMA) [10]. En cas de risque de récidive moyen ou élevé, une lymphonectomie pelvienne et para-aortique est donc généralement recommandée. En revanche, lorsque le risque est faible, la probabilité de ganglions carcinomateux reste suffisamment faible (3-5%) pour que l’on renonce à la lymphonectomie.
Cependant, comme nous l’avons déjà mentionné, une lymphonectomie est associée à une morbidité per- et postopératoire. Le risque de lymphœdème est estimé entre 5 et 38% selon les études. Pour le contourner, le concept du ganglion sentinelle est actuellement évalué dans plusieurs études en cours, y compris pour le cancer de l’endomètre. Une méta-analyse de 26 études portant sur 1 100 opérations du ganglion sentinelle a montré une sensibilité de 93 % pour la détection des métastases ganglionnaires [11]. La technique ICG semble donner les meilleurs taux de détection (Fig. 2) et pourrait s’établir à l’avenir [12]. Cela permettrait d’inclure les ganglions rarement atteints par un cancer en cas de risque faible ou moyen de récidive.

Stades supérieurs : en cas d’atteinte du stroma cervical (FIGO II), on peut éventuellement supposer que le risque d’atteinte du paramétri est similaire à celui du cancer du col de l’utérus, mais cela n’est pas confirmé par les données actuelles. Il semble que l’invasion lymphovasculaire soit un meilleur indicateur de la propagation paramétriale que l’atteinte du stroma cervical. C’est pourquoi une hystérectomie radicale n’est pas nécessairement recommandée pour les cancers de l’endomètre FIGO II. En cas d’extension de la tumeur au vagin et/ou aux paramètres (FIGO IIIB), une hystérectomie radicale élargie est réalisée, avec résection des paramètres et, si nécessaire, colpectomie. Dans les stades avancés incurables, une intervention chirurgicale (hystérectomie pour la prévention des hémorragies, débullage de grandes masses tumorales) peut être envisagée dans un cadre palliatif.
Traitements adjuvants
Radiothérapie : la dernière méta-analyse Cochrane a montré que la radiothérapie percutanée postopératoire n’apporte aucun bénéfice supplémentaire dans le cancer de l’endomètre de stade I FIGO à faible risque [13]. Même si la radiothérapie externe, c’est-à-dire percutanée, améliore le contrôle local de la tumeur en cas de risque intermédiaire ou élevé, elle ne permet pas de prolonger la survie. En raison d’une toxicité moindre pour une efficacité équivalente, la curiethérapie vaginale postopératoire est préférable à la radiothérapie externe pour le traitement du cancer de l’endomètre précoce à risque intermédiaire à élevé.
Chimiothérapie adjuvante, associée à la radiothérapie percutanée : ce n’est que dans les stades avancés de la tumeur (FIGO III et patientes bien traitées chirurgicalement avec une maladie FIGO IV) qu’une chimiothérapie adjuvante à base de doxorubicine et de cisplatine est indiquée et améliore la survie de 25% [14]. L’étude PORTEC-3, qui ne s’achèvera que dans quelques années, teste de manière randomisée la radiothérapie percutanée versus la radiochimiothérapie chez les patientes à partir du stade IB à haut risque.
Récidives et thérapies palliatives
Les rechutes surviennent généralement dans les trois ans. Le spectre est large et comprend des récidives vaginales isolées, à nouveau curables par des traitements locaux, jusqu’à des manifestations disséminées. Les tumeurs bien différenciées, les rechutes tardives et les métastases pulmonaires peuvent être mieux traitées, alors que les rechutes après une chimiothérapie adjuvante sont de mauvais pronostic. Il existe peu de données pour cette situation par rapport à d’autres tumeurs, par exemple pour le temsirolimus ou le bevacizumab. Les thérapies hormonales palliatives sont une alternative souvent utilisée et bien tolérée chez les patientes oligosymptomatiques atteintes de tumeurs bien différenciées et positives pour les récepteurs hormonaux. Les taux de réponse atteignent ~30% et sont souvent de longue durée. Les médicaments utilisés sont l’acétate de médroxyprogestérone (=Farlutal), le tamoxifène, qui est un peu moins efficace, mais clairement meilleur que les inhibiteurs de l’aromatase létrozole ou anastrozole.
Résumé et perspectives
Le cancer de l’endomètre est souvent diagnostiqué à un stade précoce. Le diagnostic est souvent facile à poser. Il est plus difficile d’adapter la radicalité du traitement en fonction du profil de risque de la tumeur et également des ressources de la patiente.
A l’avenir, avec la différenciation moléculaire, la chirurgie mini-invasive et la lymphonectomie sentinelle, la chirurgie et les traitements adjuvants pourront être adaptés de la manière la plus idéale possible.
Littérature :
- Weiderpass E, et al : Trends in corpus uteri cancer mortality in member states of the European Union. Eur J Cancer 2014;50 : 1675-1684.
- Bjørge T, et. al : Taille du corps en relation avec le cancer du corps utérin chez 1 million de femmes norvégiennes. Int J Cancer 2007 ; 120 : 378.
- Pecorelli S : Révision de la classification FIGO des carcinomes de la vulve, du col de l’utérus et de l’endomètre. Int J Gynaecol Obstet. 2009;105 : 103-104.
- Lewin SN, et al : Comparative performance of the 2009 international Federation of gynecology and obstetrics’ staging system for uterine corpus cancer. Obstet Gynecol. 2010;116 : 1141-1149.
- Cancer Genome Atlas Research N, Kandoth C, et al : Caractérisation génomique intégrée du carcinome endométrial. Nature 2013;497 : 67-73.
- Santi A, et al. : Laparoscopie ou laparotomie ? A comparison of 240 patients with early-stage endometrial cancer. Surg Endosc. 2010;24(4) : 939-43
- Benedetti Panici P, et al : Lymphadénectomie pelvienne systématique vs. absence de lymphadénectomie dans le carcinome endométrial précoce : essai clinique randomisé. J Natl Cancer Inst. 2008;100 : 1707-1716.
- ASTEC study group, Kitchener H, et al : Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial) : a randomised study. Lancet 2009;373 : 125-136.
- Todo Y, et al. : Effet sur la survie de la lymphadénectomie para-aortique dans le cancer de l’endomètre (étude SEPAL) : une analyse de cohorte rétrospective. Lancet . 2010;375 : 1165-1172.
- Kumar S, et al : Évaluation prospective de la prévalence des métastases des ganglions lymphatiques pelviens, paraaortiques et paraaortiques élevés dans le cancer de l’endomètre. Gynecol Oncol. 2014 ; 132(1) : 38-43.
- Kang S, et.al : Sentinel lymph node biopsy in endometrial cancer : meta-analysis of 26 studies. Gynecol Oncol 2011 ; 123 : 522.
- Papadia A, et. al : Laparoscopic Indocyanine Green Sentinel Lymph Node Mapping in Endometrial Cancer. Ann Surg Oncol. 2016 ; 2206-2211
- Kong A, et al : Radiothérapie adjuvante pour le cancer endométrial de stade I. Cochrane Database Syst Rev. 2012;4.
- Galaal K, et al. : Chimiothérapie adjuvante pour le cancer endométrial avancé. Cochrane Database Syst Rev. 2014;5.
PRATIQUE DU MÉDECIN DE FAMILLE 2017 ; 12(2) : 19-24