Le risque de récidive d’une diverticulite aiguë non compliquée est plus faible qu’on ne le pense et une deuxième poussée de diverticulite aiguë ne constitue pas une indication obligatoire pour une résection. L’échographie est un examen efficace et peu contraignant pour le patient, qui permet dans de nombreux cas d’éviter le recours à la tomodensitométrie. Une diverticulite aiguë non compliquée peut être traitée en ambulatoire chez des patients par ailleurs en bonne santé, même sans antibiotiques. La coloscopie doit être évitée pendant une diverticulite aiguë. Une fois la diverticulite guérie, en général après environ six semaines, la coloscopie doit être effectuée. Les patients atteints de diverticulite compliquée doivent être hospitalisés.
De nouvelles connaissances sur la pathogenèse, le traitement et l’évolution naturelle de la diverticulose ont conduit à des changements pertinents dans la stratégie de traitement de cette maladie fréquente La place du traitement antibiotique est remise en question en cas de diverticulite aiguë non compliquée. De même, une deuxième poussée de diverticulite ne constitue plus une indication de résection. Les thérapies ambulatoires sont possibles si le patient est en bon état général et ne présente pas de comorbidité importante. Ces aspects et d’autres aspects nouveaux et pertinents pour la pratique de la maladie diverticulaire sont mis en lumière et expliqués dans l’article suivant.
Épidémiologie et Pathogenèse
La diverticulose est une maladie très fréquente, dont la prévalence présente de fortes variations géographiques et une augmentation marquée avec l’âge. Dans le monde occidental, où la maladie est particulièrement fréquente, on la trouve rarement chez les moins de 40 ans (moins de 5%). La prévalence augmente régulièrement avec l’âge : chez les personnes âgées de 70 ans, on estime que la prévalence peut atteindre 65%.
Les mécanismes à la base de l’apparition des diverticules ne sont pas élucidés en détail, mais ils correspondent probablement à une interaction complexe entre la génétique, la motilité du côlon (dégénérescence neurale des cellules du plexus myentérique et des cellules de Cajal), les facteurs nutritionnels, le microbiome et les processus inflammatoires. La stase fécale, la prolifération bactérienne locale, la diminution de la perfusion dans la région des vasa recta et, enfin, la microperforation jouent un rôle pathogène dans le développement d’une diverticulite. Le développement d’une diverticulite aiguë non compliquée ou compliquée dépend essentiellement des facteurs de défense locaux et systémiques du patient.
Les diverticules du côlon gauche sont des “pseudo-diverticules”, car seules la muqueuse et la sous-muqueuse s’évaginent à travers des espaces musculaires dans la zone des vasa recta qui les traversent. (Fig.1 et 2). Ces pseudo-diverticules sont généralement accentués dans le sigmoïde, qui est connu pour être la “zone de haute pression” du côlon. (Fig.3). Les diverticules situés sur le côté droit du côlon sont de véritables diverticules, car toute la paroi du côlon est expulsée. Cette entité est surtout observée dans les pays asiatiques et reste rare en Occident. Des études coloscopiques menées au Japon montrent une prévalence de diverticules du côté droit de 21,6% [1].
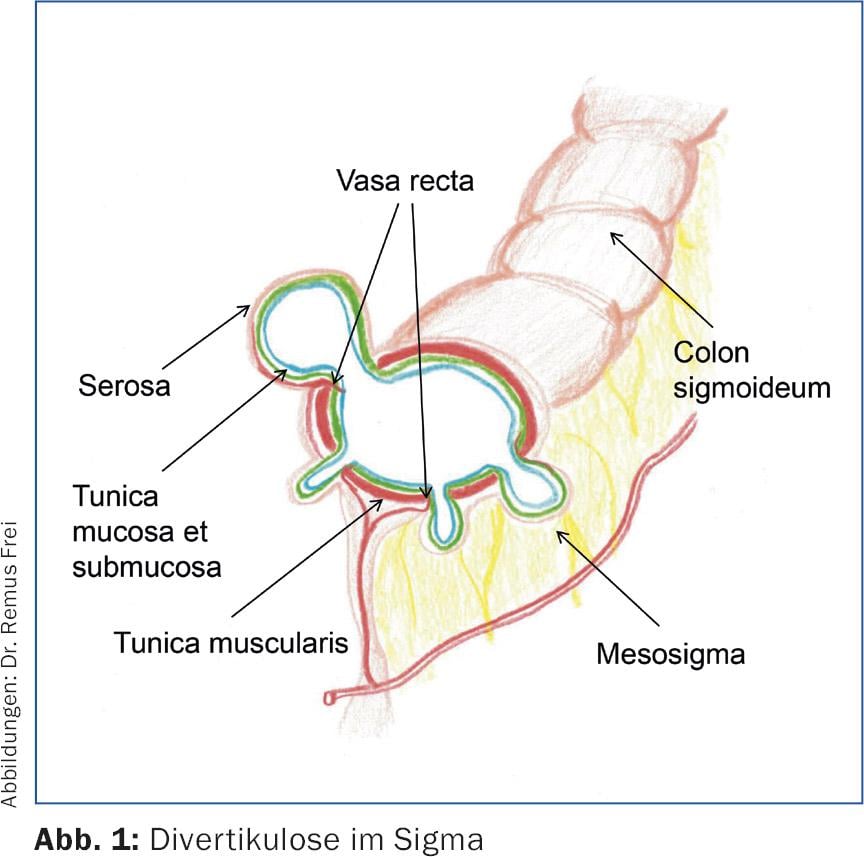
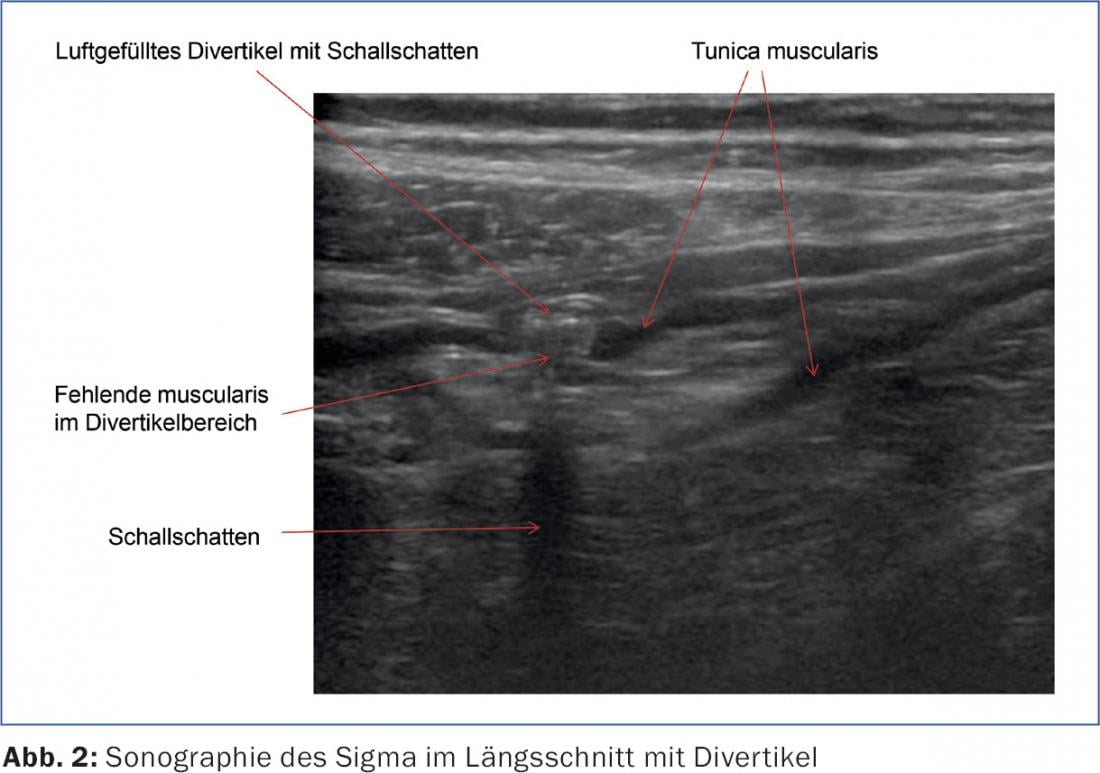
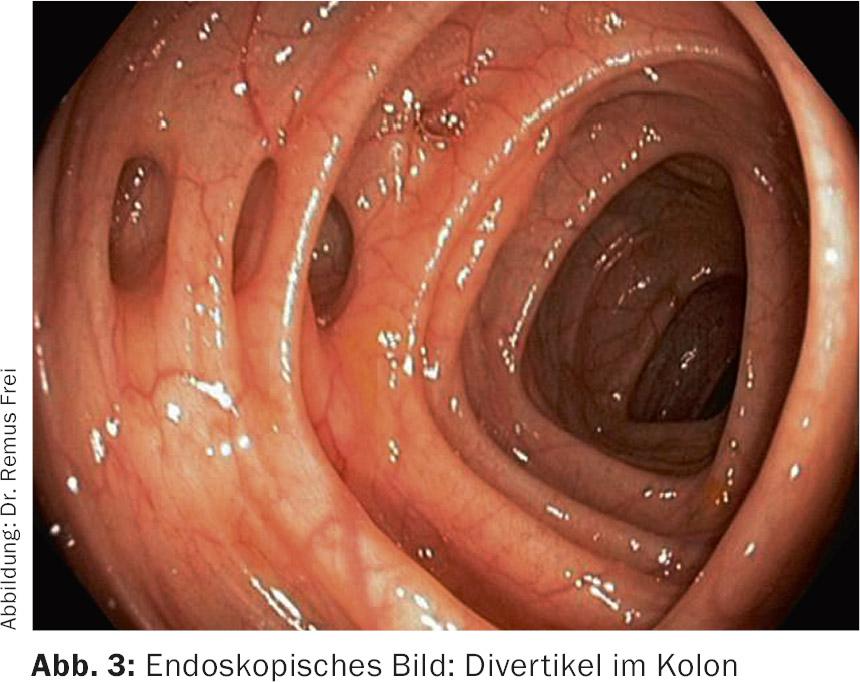
Le spectre de la maladie va de la diverticulose asymptomatique aux hémorragies diverticulaires en passant par la diverticulite aiguë (simple ou compliquée) et la maladie diverticulaire chronique (avec les complications classiques que sont les fistules, les sténoses et la tumeur conglomérée). L’ensemble du spectre de la maladie est bien représenté dans les lignes directrices actuelles de la Société allemande des maladies digestives et métaboliques (DGVS) (tab. 1).
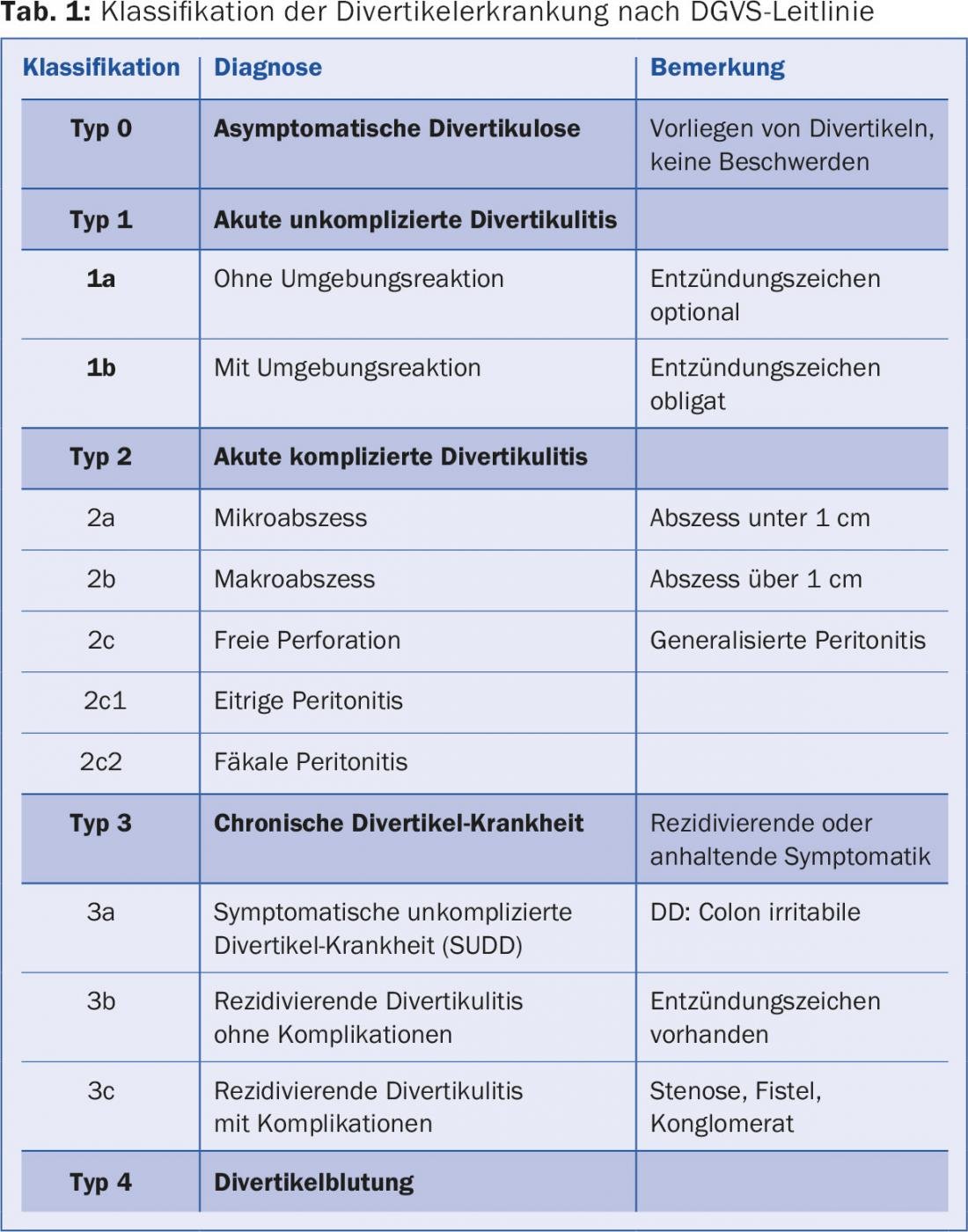
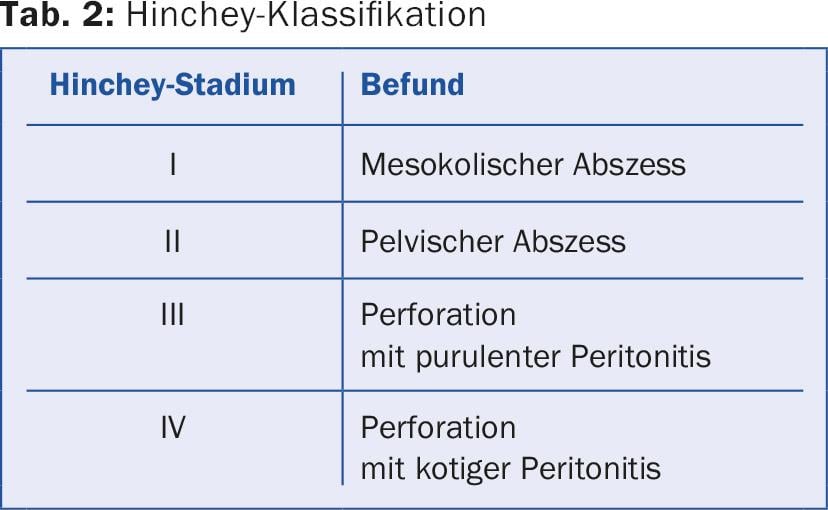
La notion de maladie diverticulaire symptomatique non compliquée (SUDD, type 3a), un tableau clinique qui présente des recoupements avec le côlon irritable et qui est difficile à distinguer de ce dernier, est nouvelle. La maladie s’accompagne également d’une augmentation de la sensibilité viscérale. Une autre entité rare (environ 1%, prédominance masculine) est la colite segmentaire associée à la diverticulose (SCAD), qui se manifeste par des douleurs et une hématochézie et qui ressemble histologiquement à une maladie inflammatoire chronique de l’intestin. D’un point de vue chirurgical, on utilise toujours la classification de Hinchey, qui divise davantage la diverticulite compliquée et définit la procédure chirurgicale (tableau 2).
Évolution naturelle de la maladie
Alors qu’environ 75% des patients atteints de diverticulose ne présentent aucun symptôme, environ 25% développent une maladie symptomatique. Les facteurs de risque pour le développement d’une diverticulite sont l’obésité, le tabagisme, l’utilisation d’AINS, les traitements stéroïdiens et les opiacés. L’apparition d’une diverticulite est un événement moins fréquent qu’on ne le pensait. L’étude menée sur plus de 2000 patients dont la diverticulose a été prouvée par endoscopie a montré, lors du suivi sur onze ans, que seuls un peu plus de 4% des patients souffrent d’une diverticulite, avec un délai moyen de sept ans avant son apparition [2].
Les jeunes patients atteints de diverticulose ont un risque plus élevé de développer une diverticulite, avec un risque de diverticulite réduit de 24% par décennie de vie [3].
Le risque de récidive après une diverticulite traitée de manière conservatrice est également plus faible qu’on ne le pensait auparavant. Nous estimons aujourd’hui que le risque d’une première récidive est d’environ 13% et celui d’une deuxième récidive d’environ 4%.
En résumé, on peut retenir que les récidives après diverticulite ne sont en principe pas fréquentes, qu’une récidive compliquée après une diverticulite non compliquée est rare (<5%), que deux récidives ou plus n’augmentent pas le risque de complications, et que même après une résection, les douleurs chroniques persistent chez environ un cinquième des patients [4]. Ces connaissances récentes ont essentiellement conduit à l’abandon de la stratégie consistant à pratiquer une résection après une deuxième poussée de diverticulite. La situation est différente après une diverticulite compliquée ; dans ce cas, le risque de récidive peut atteindre 50% selon les études et une résection “à froid” est généralement recommandée.
Diagnostic de la diverticulite aiguë : le scanner n’est pas toujours nécessaire
Le diagnostic repose en premier lieu sur l’anamnèse et l’examen clinique (examen de l’abdomen et toucher rectal). En ce qui concerne les analyses de laboratoire, le programme minimal doit comprendre une numération formule sanguine, la CRP et un bilan urinaire. Le diagnostic clinique de la diverticulite basé sur l’anamnèse, le laboratoire et l’examen n’est pas fiable. La sensibilité est faible, environ 60-70% selon les travaux pris en compte [5].
L’échographie abdominale s’est imposée comme un examen simple, largement disponible et non contraignant pour le patient (fig. 3). Dans les méta-analyses, elle atteint une sensibilité et une spécificité de plus de 90% chacune [6]. La tomodensitométrie peut présenter des avantages diagnostiques en cas de localisation particulière (diverticulite sigmoïdienne profonde) et d’abcès à distance, ainsi que dans des situations cliniques peu claires.
La coloscopie n’est pas nécessaire pour le diagnostic et doit être évitée autant que possible pendant une diverticulite aiguë en raison d’un taux de perforation potentiellement plus élevé. Dans les situations peu claires, en particulier lorsqu’un événement malin est suspecté, une clarification endoscopique peut exceptionnellement être effectuée, même au stade aigu, si une perforation couverte a été exclue par tomodensitométrie. Nous recommandons alors une endoscopie très prudente avec un instrument fin jusqu’à la pathologie correspondante, sans passer par celle-ci.
Traitement de la diverticulite non compliquée
Une diverticulite non compliquée, c’est-à-dire sans preuve d’abcès, peut être traitée en ambulatoire chez un patient par ailleurs en bonne santé et capable de s’alimenter par voie orale. De nouvelles études ont montré qu’il est également possible de renoncer à une thérapie antibiotique – jusqu’à présent un standard dans le traitement de la diverticulite aiguë. Dans une étude suédoise portant sur plus de 600 patients, aucune différence n’a été constatée en ce qui concerne les complications (abcès, perforation, résection, récidive), indépendamment du fait qu’un traitement antibiotique ait été administré ou non [7]. Ce travail est souvent cité comme une étape importante pour cette nouvelle stratégie de traitement de la diverticulite. Il convient de noter que seuls des patients sans comorbidité ou immunosuppression significative ont été inclus dans cette étude.
Traitement de la diverticulite compliquée
Si un abcès péri-diverticulaire (diverticulite compliquée) est trouvé, un traitement hospitalier est recommandé. Le traitement antibiotique reste la norme. Si la taille de l’abcès est inférieure à 3-4 cm (Hinchey I), il n’est généralement pas nécessaire de le drainer : Dans de petites séries, il n’y a pas eu de différence de résultat entre un traitement antibiotique seul et un traitement antibiotique avec drainage supplémentaire [8]. En cas d’abcès d’une taille supérieure à environ 4 cm, un drainage doit être effectué en plus d’un traitement antibiotique. Elle peut être insérée par scanner ou par guidage échographique. Il n’existe pas de données prospectives ou randomisées pour ce concept thérapeutique fréquemment utilisé en clinique et qui donne de bons résultats.
Les patients présentant une perforation libre avec péritonite doivent être opérés dès que le diagnostic est posé. Si possible, l’opération (résection sigmoïdienne) est réalisée par laparoscopie avec rétablissement de la continuité primaire et mise en place d’une iléostomie protectrice à deux voies. Pour les patients septiques et instables, une opération de Hartmann est réalisée (résection sigmoïdienne, fermeture du rectum, descendostomie) avec rétablissement secondaire de la continuité.
La place du lavage péritonéal laparoscopique et du drainage sans résection (en cas de diverticulite perforée et de péritonite purulente, Hinchey III) n’est toujours pas totalement établie. Le guide actuel de la DGVS le mentionne comme option thérapeutique et considère que son utilisation individuelle est justifiée [9]. Les données actuelles ne permettent pas de savoir quels patients bénéficient de cette approche et si une résection doit être effectuée par la suite. Les sténoses cliniquement significatives ainsi que les fistules (colo-vésicales, colo-vaginales, colo-cutanées) et les tumeurs conglomérées constituent en général des indications opératoires claires.
Procédure après une diverticulite
Le taux de récidive après une diverticulite aiguë dépend de sa sévérité. Il n’est pas nécessaire de procéder à une résection après une diverticulite aiguë non compliquée, ni même après sa récidive. Après une diverticulite compliquée, le risque de récidive est élevé, c’est pourquoi la résection sigmoïdienne doit être discutée avec le patient. Une coloscopie après la guérison d’une diverticulite est en principe recommandée (en général après 4 à 6 semaines), même si les données à ce sujet sont plutôt minces [10]. En principe, il s’agit de confirmer le diagnostic et d’exclure d’autres pathologies, notamment une tumeur maligne.
Malheureusement, il n’existe pas de stratégie prouvée pour prévenir la récidive de la diverticulite. Malgré l’absence de données claires, il est généralement recommandé de consommer un régime riche en fibres La mésalazine, les probiotiques et la rifaximine (un antibiotique non résorbable) n’ont pas d’effet protecteur et ne devraient généralement pas être prescrits [11].
Littérature :
- Yamada E, et al : Association entre la localisation de la maladie diverticulaire et le syndrome de l’intestin irritable : une étude multicentrique au Japon. Am J Gastroenterol 2014 ; 109(12) : 1900-1905.
- Shahedi K, et al : Risque à long terme de diverticulite aiguë chez les patients présentant une diverticulose incidente découverte lors d’une colonoscopie. Clin Gastroenterol Hepatol 2013 ; 11(12) : 1609-1613.
- Strate LL, et al : Diverticular disease as a chronic illness : evolving epidemiologic and clinical insights. Am J Gastroenterol 2012 ; 107(10) : 1486-1493.
- Regenbogen SE, et al : Surgery for diverticulitis in the 21st century : a systematic review. JAMA Surg 2014 ; 149(3) : 292-303.
- Schwerk WB, et al : Sonography in acute colonic diverticulitis. Une étude prospective. Dis Colon Rectum 1992 ; 35(11) : 1077-1184.
- Lameris W, et al : Echographie et tomographie computérisée à compression graduée dans la diverticulite colique aiguë. Eur Radiol 2008 ; 18(11) : 2498-2511.
- Chabok A, et al : Essai clinique randomisé d’antibiotiques dans la diverticulite aiguë non compliquée. Br J Surgery 2012 ; 99(4) : 532-539.
- Brandt et al : Percutaneous CT scan-guided drainage vs. antibiotherapy alone for Hinchey II diverticulitis : a case control study. Dis Colon Rectum 2006 ; 49(10) : 1533-1538.
- Lignes directrices S2k sur la maladie diverticulaire/diverticulite. Société allemande de gastro-entérologie, de maladies digestives et métaboliques, DGVS, 2014.
- De Vries HS, et al : La colonoscopie de routine n’est pas nécessaire dans la diverticulite non compliquée : une revue systématique. Surg Endosc 2014 ; 28(7) : 2039-2047.
- Tursi A : Prévention de la diverticulite aiguë récidivante à l’aide de traitements pharmacologiques. Ther Adv Chronic Dis 2013 ; 4(6) : 277-286.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(9) : 14-19