L’hypertension pulmonaire est généralement le signe d’un stade plus avancé de la maladie cardiaque gauche (PH-LHD). La caractéristique centrale du PH-LHD est une pression artérielle pulmonaire élevée de >15 mmHg. Dans des cas hautement sélectionnés, un traitement approuvé pour l’hypertension artérielle pulmonaire, c’est-à-dire les inhibiteurs de la phosphodiestérase 5 (PDE5i), pourrait être indiqué comme pont vers la transplantation cardiaque et après un dispositif d’assistance ventriculaire gauche en cas d’altération grave de la fonction ventriculaire droite. En cas de régurgitation mitrale modérée à sévère, les options de traitement (réparation valvulaire chirurgicale ou transcathéter) doivent être évaluées par une équipe cardiaque comprenant des cardiologues, des chirurgiens cardiaques et des spécialistes de l’imagerie.
L’hypertension pulmonaire (HP) peut être le résultat de toutes les causes de la cardiopathie gauche (CMG) et est généralement le signe d’un stade plus avancé de la CMG. (tableau 1). Il a été démontré que les symptômes progressifs de l’insuffisance cardiaque avec intolérance à l’effort dus à la PH-LHD entraînent une aggravation de l’issue selon la précocité et l’efficacité du traitement de la PH-LHD [1].

Définition du PH-LHD
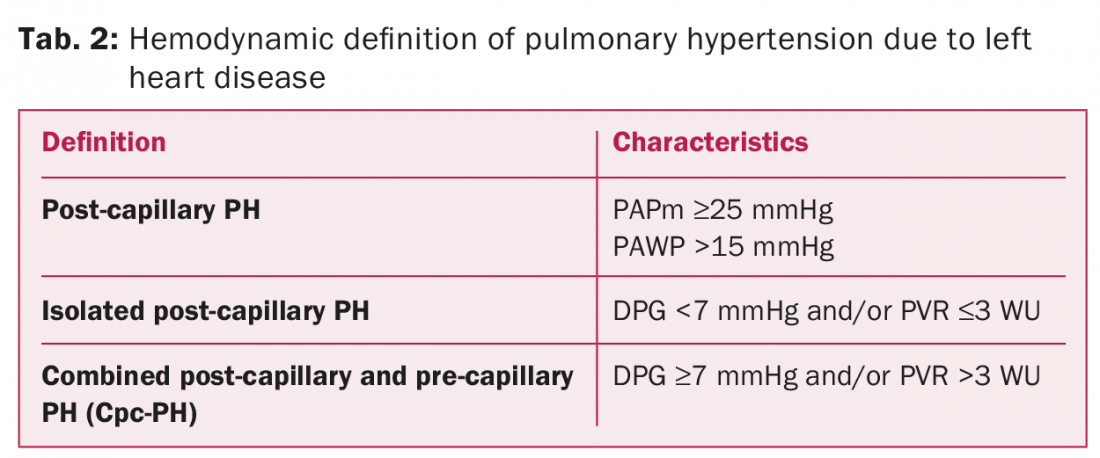
L’HTP est généralement définie pour tous les groupes cliniques comme un état hémodynamique et physiopathologique avec une augmentation de la pression artérielle pulmonaire moyenne (PAPm) au repos de ≥25 mmHg, évaluée par cathétérisme cardiaque droit. La caractéristique centrale du PH-LHD est une pression artérielle pulmonaire de coin (PAWP) élevée de >15 mmHg en raison de l’augmentation des pressions de remplissage de l’oreillette gauche et du PH post-capillaire.
Les lignes directrices 2009 de la Société européenne de cardiologie et de la Société respiratoire européenne (ESC/ERS) pour le diagnostic et le traitement du PH définissent les caractéristiques hémodynamiques du PH-LHD selon le gradient transpulmonaire (TPG), la différence entre la PAPm et la PAWP [1,2]. Le PH-LHD post-capillaire est défini comme passif (TPG ≤12 mmHg) ou réactif (disproportionné, TPG >12 mmHg). Dans 10 à 15 % des cas, l’hémodynamique indique une combinaison de PH pré et post-capillaire [1]. Cependant, le fait de ne prendre en compte que le TPG peut conduire à une classification erronée de la PH-LHD, influençant l’approche thérapeutique de la LHD.
Les lignes directrices 2015 de l’ESC/ESR définissent trois états hémodynamiques différents lors de l’interprétation de la PH-LHD (tableau 2) [3]. Les principales modifications des caractéristiques de l’HTP sont l’évaluation du gradient de pression diastolique (DPG), la différence entre la PAPd et la PAWP au lieu de la TPG, et/ou la résistance vasculaire périphérique afin de différencier une HTP post-capillaire isolée (Ipc-PH) d’une HTP post-capillaire et précapillaire combinée (Cpc-PH) (tableau 2).
Les patients dont la résistance vasculaire pulmonaire (RVP) dépasse cinq unités de bois (5 UW×80 = 400 dyn×sec×m2×cm-5) ou l’indice RVP >6 UW présentent un risque accru d’insuffisance ventriculaire droite postopératoire après une transplantation cardiaque [4]. Par conséquent, des “défis vasodilatateurs” pharmacologiques visant directement la vasculature artérielle pulmonaire comme la prostacycline ou, en cas de réponse inadéquate, c’est-à-dire en cas de PAWP très élevée, une réduction de la postcharge sur le cœur gauche à l’aide de nitroprussiate ou de nitroglycérine sont nécessaires pour démasquer une hypertension artérielle pulmonaire (HTAP) “fixée” de manière irréversible.
Les patients présentant une résistance vasculaire périphérique fixe et élevée peuvent avoir une maladie pulmonaire concomitante, une apnée obstructive du sommeil ou une maladie thromboembolique pulmonaire chronique qui doivent être prises en compte dans le diagnostic différentiel et exclues.
Traitement médical
Il existe des preuves établies et croissantes en ce qui concerne le traitement médical de l’HTAP, alors que les données dans le domaine de l’HTLP manquent. Cependant, les médicaments dont l’efficacité a été prouvée dans l’HTAP sont de plus en plus utilisés pour d’autres formes d’HTP, y compris l’HTL, c’est-à-dire les inhibiteurs de la phosphodiestérase 5 (PDE5i).
On pense que les effets bénéfiques de la PDE5i dans l’HTAP résultent d’effets vasodilatateurs et antiprolifératifs relativement sélectifs sur le système vasculaire pulmonaire, et sur l’hémodynamique dans l’insuffisance cardiaque [5]. Le PH représente le principal mécanisme physiopathologique de l’insuffisance ventriculaire droite [4]. De petits essais menés chez des patients souffrant d’insuffisance cardiaque ont montré que le bénéfice le plus important de la PDE5is se situait chez les patients souffrant de PH-LHD et d’insuffisance ventriculaire droite [5]. On pense que cela résulte de l’effet direct de la PDE5i sur la contractilité myocardique du ventricule droit, où il a été démontré que l’expression de la PDE5 est régulée à la hausse dans les ventricules droits altérés [6]. L’inhibition de la PDE5 peut donc jouer un rôle dans l’amélioration de la fonction ventriculaire droite dans l’insuffisance cardiaque et peut être cliniquement justifiée chez certains patients soigneusement sélectionnés, comme pont vers une transplantation cardiaque ou après un dispositif d’assistance ventriculaire gauche. Ce point sera abordé dans le premier rapport de cas.
Cas 1 : Un jeune patient atteint de cardiomyopathie dilatée
Patient de 46 ans présentant une cardiomyopathie dilatée connue depuis l’an 2000 et une fraction d’éjection ventriculaire gauche (FEVG) de 20 %, une taille et une fonction ventriculaires droites normales, une régurgitation mitrale légère et l’absence de PH lors du cathétérisme cardiaque droit (fig. 1).
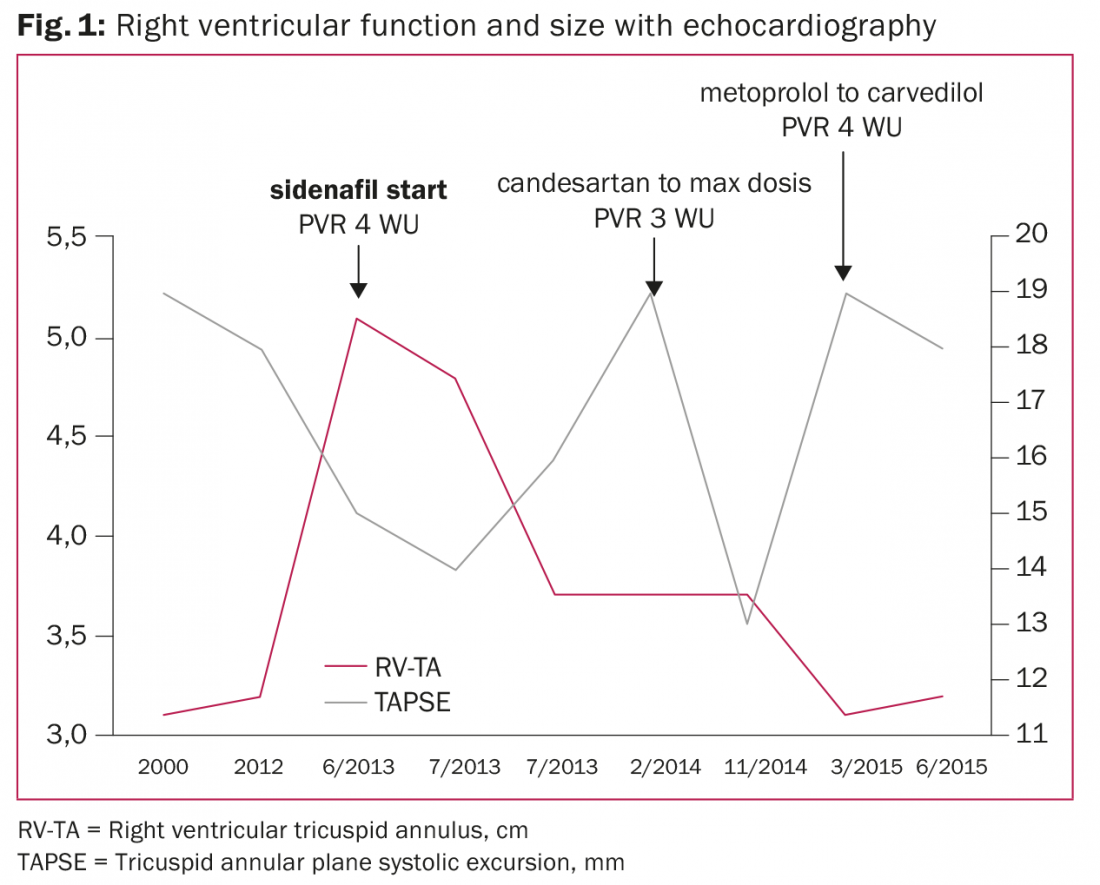
En 2012, une thérapie de resynchronisation cardiaque avec défibrillateur a été implantée en raison d’une syncope et d’un nouveau bloc de branche gauche. En 2013, le patient a été adressé à l’équipe d’insuffisance cardiaque pour évaluation en raison d’une décompensation cardiaque biventriculaire aiguë, d’un ventricule droit dilaté et d’une fonction ventriculaire droite altérée. Le TPG était de 12 mmHg mais le DPG était de -1 mmHg indiquant un PH post-capillaire isolé et un PVR de 4,4 WU (352 dyn×sec×m2×cm-5) après le test de vasodilatation à l’ilomédine. Aucun test pharmacologique de vasodilatation systémique (c’est-à-dire nitroprussiate ou nitroglycérine) n’a été effectué pour exclure l’HTPC ou l’HTAP irréversible. Par conséquent, en raison d’une PH avec insuffisance ventriculaire droite, un traitement au sildénafil a été initié. Un bilan pour une transplantation cardiaque a été initié.
Des cathétérismes sériels du cœur droit ont été effectués conformément aux directives 2006 de l’International Society for Heart & Lung Transplantation pour déterminer l’aptitude à la transplantation cardiaque afin d’éviter le risque élevé d’insuffisance ventriculaire droite et de mortalité après la transplantation cardiaque [7]. Une élévation du RVP a été constatée en 2014 (5,7 WU, puis 2,8 WU après un test de vasodilatation systémique) et en 2015 (4,3 WU). Par la suite, le RVP a diminué à 1,3 WU (104 dyn×sec×m2×cm-5) après une optimisation continue du traitement de l’insuffisance cardiaque.
Peu après l’initiation du sildénafil, la taille du ventricule droit s’est normalisée et la fonction ventriculaire droite s’est améliorée au cours de la période de deux ans, malgré une progression intermittente de l’HTP. Le patient est cliniquement stable en classe NYHA III avec une régurgitation mitrale modérée et se trouve sur la liste d’attente pour une transplantation cardiaque.
Options thérapeutiques : Orientées vers la pathologie sous-jacente
Si le traitement médical et le dispositif ne parviennent pas à réduire la RVP <3-5 WU, et que le patient reste en classe NYHA III-IV, un dispositif d’assistance ventriculaire gauche peut être envisagé si la fonction ventriculaire droite est acceptable [7,8]. Selon les lignes directrices 2013 sur l’assistance circulatoire mécanique (ACM), la PDE5i peut être envisagée pour la gestion de la dysfonction ventriculaire droite dans le cadre d’une PH après ACM (niveau de preuve IIb, C) [8]. Les options thérapeutiques du PH-LHD doivent être orientées vers la pathologie sous-jacente du LHD. De nouvelles preuves se sont accumulées, les techniques de diagnostic et les options thérapeutiques ont changé grâce au perfectionnement de la réparation chirurgicale de la valve et à l’introduction de techniques interventionnelles percutanées, principalement l’implantation transcathéter de la valve aortique (TAVI) et la réparation percutanée de la valve bord à bord. Ces changements sont principalement liés à la sténose aortique et à la régurgitation mitrale.
Cas 2 : Une femme de 44 ans avec une cardiomyopathie dilatée
La patiente de 44 ans présente une cardiomyopathie dilatée (après abus d’alcool) depuis l’année 2010, une FEVG de 30 %, une taille normale du ventricule droit et une fonction ventriculaire droite modérément altérée. PH dans le cathétérisme du cœur droit (PAPm 33 mmHg) avec PH post-capillaire isolé (DPG 4 mmHg). La régurgitation mitrale était grave (surface effective de l’orifice de régurgitation 54 mm2 [reference ≥40], volume de régurgitation 66,1 ml/battement [reference ≥60], inversion du flux veineux pulmonaire) avec élargissement du diamètre diastolique final du ventricule gauche (61 mm) et de l’oreillette gauche (47 mm).
La valve était morphologiquement intacte, remplissant ainsi les critères échocardiographiques d’une régurgitation mitrale fonctionnelle [9]. Un traitement de l’insuffisance cardiaque a été initié et un cardioverteur-défibrillateur implantable (ICD) a été implanté. La régurgitation mitrale s’est améliorée pour atteindre un grade modéré.
Fin 2011, le patient a été adressé à l’équipe d’insuffisance cardiaque pour une évaluation plus approfondie en raison d’un œdème pulmonaire aigu et de chocs répétés du DAI dus à une tachycardie ventriculaire non soutenue. La régurgitation mitrale était sévère. Le traitement pharmacologique réalisé était sous-maximal en raison de l’hypotension, le patient a reçu l’instruction d’arrêter la consommation d’alcool et d’adhérer à une gestion stricte de l’apport en volume/sel. Comme le montre la figure 2, au cours de l’année suivante, en 2012, le patient a été hospitalisé à quatre reprises en raison d’une décompensation de l’HL, avec une stabilisation entre les deux, mais avec une régurgitation mitrale sévère continue. En raison de la faible compliance, la transplantation cardiaque ou le traitement par dispositif d’assistance ventriculaire gauche étaient relativement contre-indiqués.
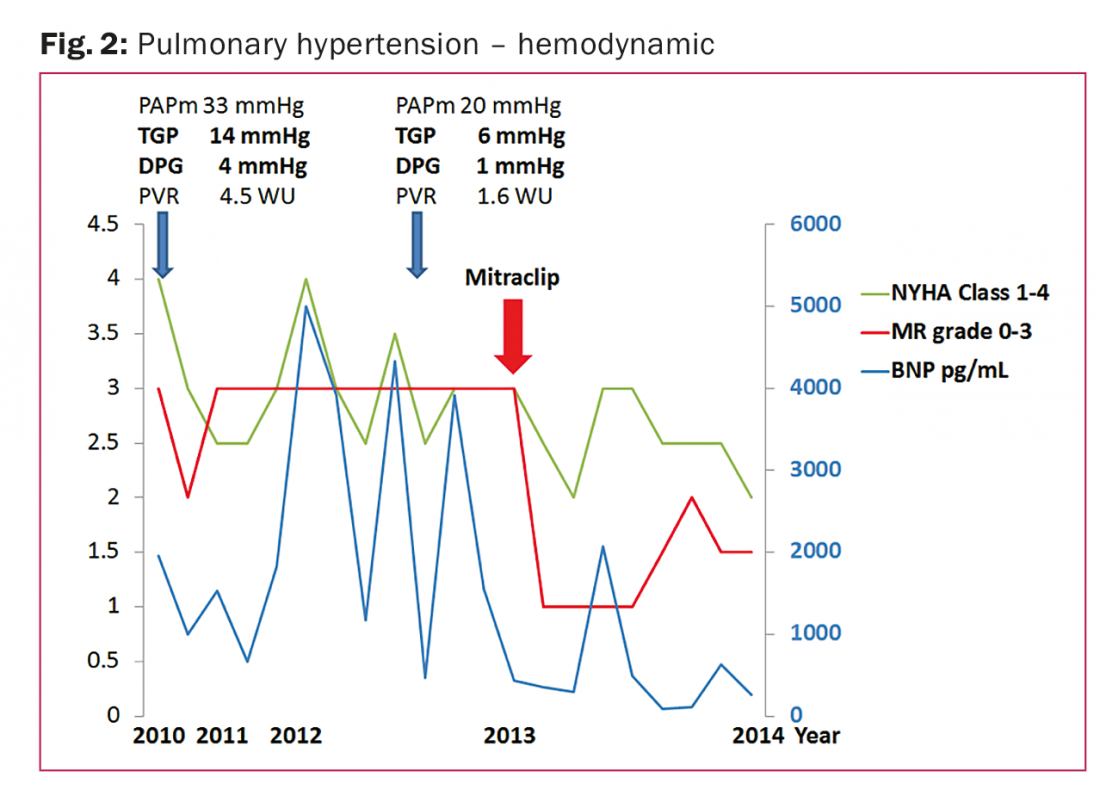
En 2013, une réparation percutanée bord à bord utilisant le Mitraclip a été réalisée avec succès, réduisant immédiatement la régurgitation mitrale à un grade léger. Au cours de l’année suivante, aucune autre hospitalisation due à une décompensation de l’HL n’a eu lieu. Le patient est cliniquement stable, en classe NYHA II, avec des taux de BNP bas et une régurgitation mitrale légère.
Gestion de la régurgitation mitrale
L’échocardiographie est l’examen principal pour l’évaluation de la régurgitation mitrale et doit inclure une évaluation minutieuse de l’anatomie de la valve, de la sévérité de la régurgitation mitrale, de ses mécanismes (c’est-à-dire régurgitation mitrale fonctionnelle vs dégénérative) et aborder la question de la réparabilité de la valve. Les conséquences de la régurgitation mitrale sont évaluées en mesurant le diamètre de l’oreillette gauche, le diamètre du ventricule gauche, la FEVG et la pression artérielle pulmonaire systolique. Les directives actuelles de l’ESC pour le diagnostic et le traitement de l’insuffisance cardiaque chronique soulignent l’importance de réévaluer la régurgitation mitrale d’abord après plusieurs mois de traitement pharmacologique stable et toléré au maximum [10]. La réévaluation doit toujours être effectuée dans un état de compensation cardiaque (statut volumique optimal) du patient.
Si la régurgitation mitrale est encore modérée à sévère, notamment dans la prise en charge des patients à haut risque, les options de traitement (réparation valvulaire chirurgicale ou transcathéter) doivent être évaluées au sein d’une équipe cardiaque comprenant des cardiologues, des chirurgiens cardiaques et des spécialistes de l’imagerie [9]. L’évaluation doit inclure une stratification du risque en fonction des symptômes (liés à la valvulopathie), de la fibrillation auriculaire concomitante, de l’âge, des comorbidités pertinentes, de la fonction ventriculaire gauche, du PH, de la nécessité d’une intervention chirurgicale concomitante (c’est-à-dire une revascularisation) et de l’adéquation de la réparation valvulaire, qui sont les prédicteurs les plus importants du résultat postopératoire [10]. La mortalité opératoire peut être estimée par différents systèmes de notation, par exemple STS ou EuroSCORE II, comprenant notamment des indices visant à évaluer les capacités fonctionnelles et cognitives et la fragilité des personnes âgées. La décision finale concernant l’option de traitement optimale doit être prise avec le patient et sa famille.
Traitement par mitrailleuse
Le traitement par mitraclip a été utilisé avec succès pour traiter la régurgitation mitrale fonctionnelle ou dégénérative. Le Mitraclip a été évalué dans l’essai contrôlé randomisé multicentrique EVEREST, qui n’a recruté que des patients opérables [11]. La majorité des patients inclus dans EVEREST présentaient une régurgitation mitrale dégénérative, mais un patient sur quatre présentait une régurgitation mitrale fonctionnelle. Dans ce contexte, les résultats d’ACCESS-EU, un essai prospectif, multicentrique et non randomisé en Europe, sont importants, incluant principalement des patients à haut risque chirurgical (NYHA III-IV et FEVG ≤40% dans 85% ; EuroSCORE : 23±18,3), principalement en raison d’une étiologie fonctionnelle (n=393/510) [12]. Le taux de mortalité à trente jours était de 3,4 % et le taux d’AVC de 0,7 %, sans aucun cas de décès intra-procédural ou d’embolisation par clip.
Résumé
En résumé, le PH est un signe important de LHD avancé avec un résultat plus mauvais. La principale approche thérapeutique doit être dirigée vers l’origine de la LHD après une évaluation minutieuse. Dans des cas hautement sélectionnés, un traitement approuvé pour l’HTAP, c’est-à-dire la PDE5i, pourrait être indiqué comme pont vers une transplantation cardiaque et après un dispositif d’assistance ventriculaire gauche en cas d’altération grave de la fonction ventriculaire droite. Étant donné qu’il n’existe toujours pas de preuves d’efficacité provenant d’essais à grande échelle et à long terme contrôlés par placebo, l’utilisation de médicaments contre l’HTAP pour d’autres formes d’HTP en dehors des centres experts est déconseillée.
Liste de référence :
- Vachiery JL, et al : L’hypertension pulmonaire due aux maladies du cœur gauche. J Am Coll Cardiol 2013 ; 62(25 Suppl) : D100-108.
- Galie N, et al : Lignes directrices pour le diagnostic et le traitement de l’hypertension pulmonaire. La Task Force pour le diagnostic et le traitement de l’hypertension pulmonaire de la Société européenne de cardiologie (ESC) et de la Société européenne de pneumologie (ERS). Eur Heart J 2009 ; 30(20) : 2493-2537.
- Galie N, et al. : Lignes directrices 2015 de l’ESC/ERS pour le diagnostic et le traitement de l’hypertension pulmonaire. Le groupe de travail conjoint pour le diagnostic et le traitement de l’hypertension pulmonaire de la Société européenne de cardiologie (ESC) et de la Société respiratoire européenne (ERS). Eur Heart J 2016 ; 37(1) : 67-119.
- Ghio S, et al : Valeur pronostique indépendante et additive de la fonction systolique du ventricule droit et de la pression de l’artère pulmonaire chez les patients atteints d’insuffisance cardiaque chronique. J Am Coll Cardiol 2001 ; 37(1) : 183-188.
- Lewis GD, et al : Le sildénafil améliore la capacité d’exercice et la qualité de vie des patients souffrant d’insuffisance cardiaque systolique et d’hypertension pulmonaire secondaire. Circulation 2007 ; 116(14) : 1555-1562.
- Shan X, et al : Expression différentielle de la PDE5 dans le myocarde humain défaillant et non défaillant. Circ Heart Fail 2012 ; 5(1) : 79-86.
- Mehra MR, et al : Critères d’inscription pour la transplantation cardiaque : Directives de la Société internationale pour la transplantation cardiaque et pulmonaire pour le soin des candidats à la transplantation cardiaque–2006. J Heart Lung Transplant 2006 ; 25(9) : 1024-1042.
- Feldman D, et al : Les lignes directrices 2013 de la Société internationale pour la transplantation cardiaque et pulmonaire pour l’assistance circulatoire mécanique. Résumé exécutif. J Heart Lung Transplant 2013 ; 32(2) : 157-187.
- Vahanian A, et al : Lignes directrices sur la prise en charge des cardiopathies valvulaires (version 2012). Le groupe de travail conjoint sur la gestion des cardiopathies valvulaires de la Société européenne de cardiologie (ESC) et de l’Association européenne de chirurgie cardio-thoracique (EACTS). Eur J Cardiothorac Surg 2012 ; 42(4) : S1-44.
- McMurray JJ, et al : Lignes directrices de l’ESC pour le diagnostic et le traitement de l’insuffisance cardiaque aiguë et chronique 2012. La Task Force pour le diagnostic et le traitement de l’insuffisance cardiaque aiguë et chronique 2012 de la Société européenne de cardiologie. Eur J Heart Fail 2012 ; 14(8) : 803-869.
- Feldman T, et al : Réparation mitrale percutanée avec le système MitraClip. Sécurité et durabilité à moyen terme dans la cohorte initiale EVEREST (Endovascular Valve Edge-to-Edge REpair Study). J Am Coll Cardiol 2009 ; 54(8) : 686-694.
- Maisano F, et al : Les interventions percutanées sur la valve mitrale dans le monde réel. Résultats précoces et à un an de l’étude ACCESS-EU, une étude prospective, multicentrique, non randomisée et post-approbation du traitement MitraClip en Europe. J Am Coll Cardiol 2013 ; 62(12) : 1052-1061.
CARDIOVASC 2016 ; 15(2) : 11-15