La maladie artérielle périphérique, qui est l’une des principales causes de morbidité et de mortalité, possède désormais un caractère pandémique. Cette évolution favorise le progrès technique et stimule la recherche pharmaceutique. En ce qui concerne la fréquence des amputations chez les diabétiques, les choses n’ont malheureusement pas beaucoup évolué ces dernières années. Pourtant, 85% des amputations pourraient être évitées. Il est important de penser rapidement au syndrome du pied diabétique, de rétablir la perfusion et de surveiller étroitement le patient afin de détecter la récidive à temps. Les DOAK ont rendu le traitement pharmacologique et la prophylaxie de la thromboembolie veineuse plus simples et plus sûrs, mais aussi plus coûteux. Il existe également une approche par cathétérisme de la thromboembolie veineuse aiguë.
L’angiologie est une discipline très dynamique qui a beaucoup évolué ces dernières années – heureusement, car 202 millions de personnes dans le monde sont touchées par une maladie artérielle périphérique (MAP) [1]. C’est presque cinq fois plus que le nombre de patients séropositifs dans le monde. Ce qui est également nouveau dans cette évolution, c’est qu’il n’y a plus de différence de prévalence de la maladie artérielle périphérique dans le monde. Les frontières nationales, le revenu et le niveau de vie ne jouent plus aucun rôle dans la fréquence des maladies.
L’anamnèse, la mesure de l’ABI et l’oscillogramme sont les données de base dont on a au moins besoin pour diagnostiquer une maladie artérielle périphérique. Il faut toutefois garder à l’esprit que deux tiers des patients souffrant d’une AOPV manifeste ne présentent aucun symptôme. Nous demandons depuis des années une mesure de routine de l’ABI dans le cabinet du médecin généraliste, aussi évidente que l’ECG. Il ne s’agit pas de recruter le plus grand nombre possible de patients pour une thérapie. Les personnes qui ne présentent aucun symptôme n’ont généralement pas besoin d’un traitement vasculaire spécifique. L’AOPV est une indication claire d’athérosclérose manifeste et a une signification similaire aux troubles de la repolarisation à l’ECG, qui indiquent une ischémie myocardique silencieuse. 50% des patients atteints d’AOP ont une atteinte coronarienne significative et 43% une atteinte cérébrale significative [2]. Ne pas diagnostiquer l’AOPV, c’est passer à côté d’une approche préventive chez ces patients.
Dysfonction érectile : j’aimerais encore vous faire part d’un facteur de risque important qui n’est souvent pas pris en compte. La dysfonction érectile touche jusqu’à 50% des hommes, selon l’âge. Il est frappant de constater une association significative entre le diabète, l’hypertension, le tabagisme, l’obésité et la dyslipidémie, c’est-à-dire précisément les facteurs de risque classiques de l’athérosclérose. 50% des hommes souffrant d’un syndrome coronarien aigu présentent un dysfonctionnement érectile ; chez 70% d’entre eux, le dysfonctionnement érectile est le signe avant-coureur d’un syndrome coronarien aigu et précède l’événement coronarien de trois ans en moyenne [3]. La dysfonction érectile est donc un biomarqueur important de l’athérosclérose, qu’il convient de prendre davantage en considération. Mais soyons honnêtes, qui le demande en pratique dans le cadre d’une consultation ?
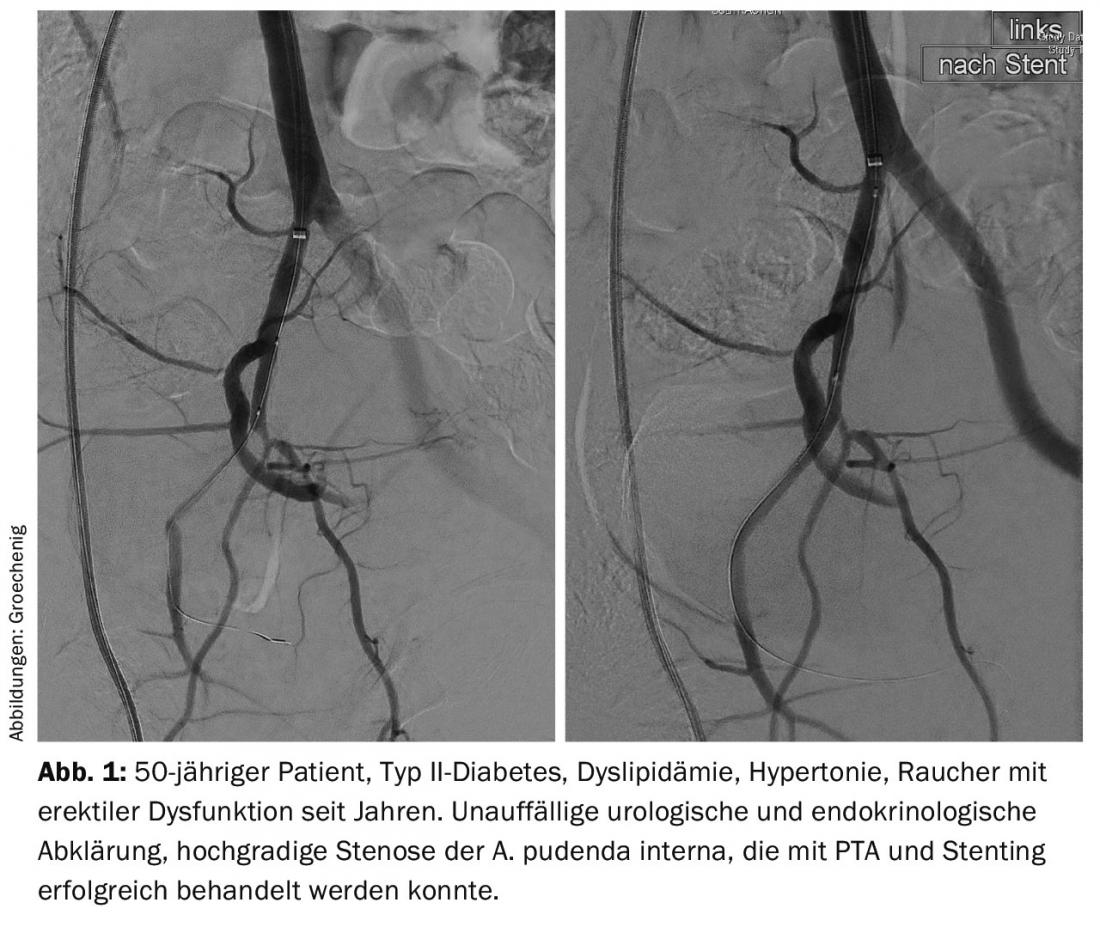
Outre l’approche préventive visant à empêcher un événement cardiovasculaire, il existe également de véritables options thérapeutiques. À Aarau, nous avons mis en place depuis janvier 2015 une consultation pour la dysfonction érectile, en collaboration avec le service d’urologie et d’endocrinologie. Lorsque des troubles urologiques, hormonaux ou autres sont exclus, il n’est pas rare de trouver une circulation sanguine perturbée, qui peut aujourd’hui être traitée par cathétérisme (Fig. 1).
Détection précoce, prophylaxie et diagnostic
L’idéal serait bien sûr de mettre en place des programmes de dépistage précoce permettant d’identifier les personnes présentant des lésions vasculaires précoces et encore réversibles et de créer une approche préventive en modifiant principalement le mode de vie. Malheureusement, les études sur la mesure de l’épaisseur de l’intima-média, l'”arterial stiffness”, la vitesse de l’onde de pouls ou la FMD de l’artère brachiale, qui étaient si louées il y a quelques années, ne sont plus considérées avec autant d’euphorie qu’au moment de leur publication.
Il faut savoir que la plupart des patients atteints d’APVP meurent d’autres manifestations de l’athérosclérose, notamment d’infarctus du myocarde et d’accidents vasculaires cérébraux. Et cela pourrait être évité aujourd’hui grâce à un traitement médicamenteux moderne. L’efficacité d’une prophylaxie secondaire intensifiée, par exemple, est démontrée par des études sur le traitement de la sténose carotidienne asymptomatique, où le taux d’AVC a pu être réduit de 1% avec des antiplaquettaires, des IEC et des statines <et est donc nettement inférieur à celui obtenu avec des interventions thérapeutiques, que l’on procède par cathétérisme ou par chirurgie [4].
Le médecin généraliste a un rôle crucial à jouer dans la détection d’une maladie souvent asymptomatique, dans l’information du patient, dans la promotion d’un changement de mode de vie et de l’observance, et surtout dans l’évaluation du moment opportun pour confier le patient à un spécialiste.
L’échographie duplex s’est tellement développée ces dernières années, avec des appareils beaucoup plus performants, de nouvelles sondes et une échographie à contraste amélioré, que l’angiographie n’est pratiquement plus pratiquée aujourd’hui pour diagnostiquer l’AOP. Dans la grande majorité des cas, il est possible de planifier le traitement à l’aide de l’échographie duplex, l’angiographie intra-artérielle en tant que diagnostic de base étant alors réalisée dans le cadre d’une intervention, ce qui permet d’économiser considérablement du temps, des coûts et des ressources.
Thérapie : questions ouvertes et nouveaux développements
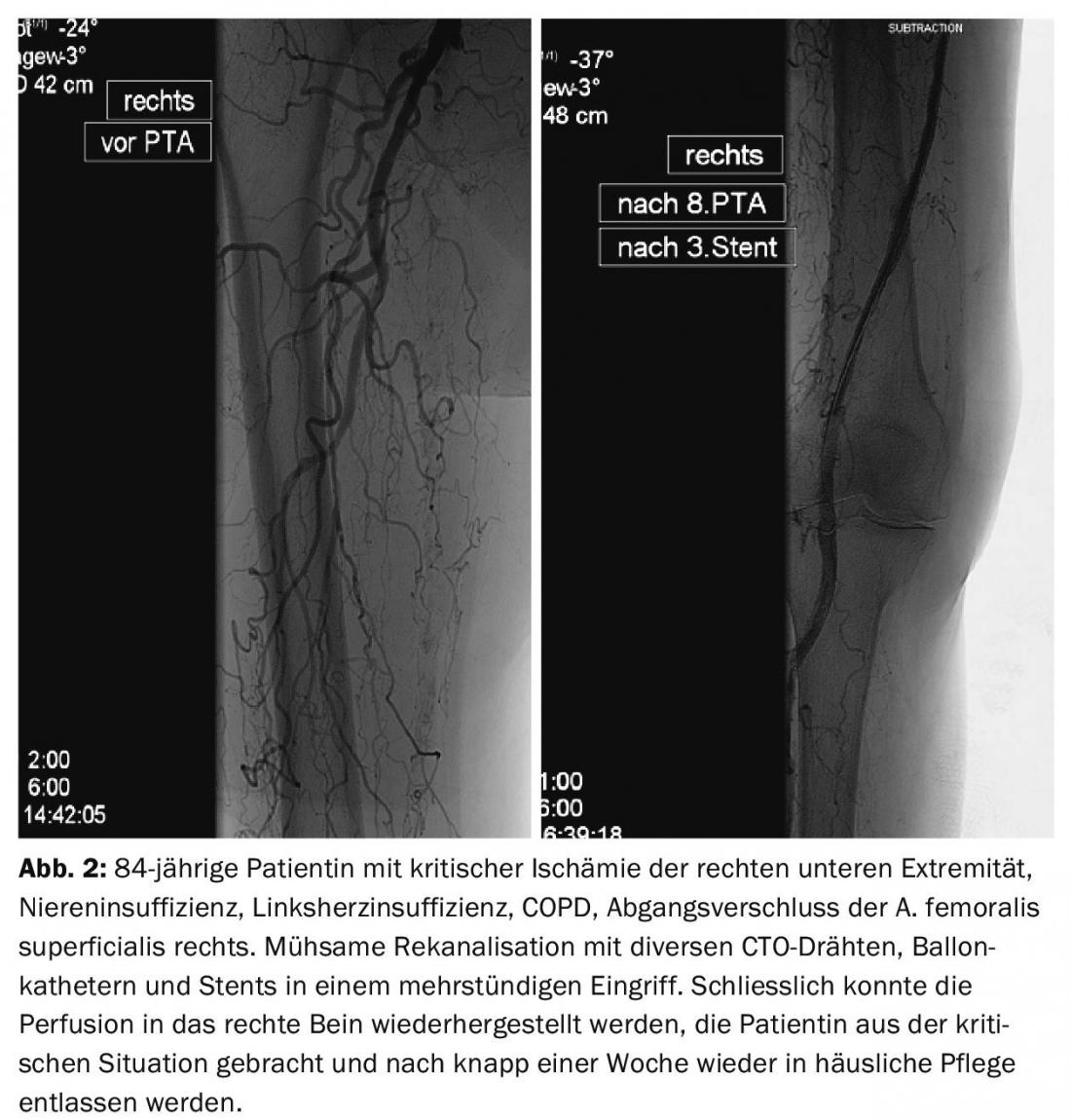
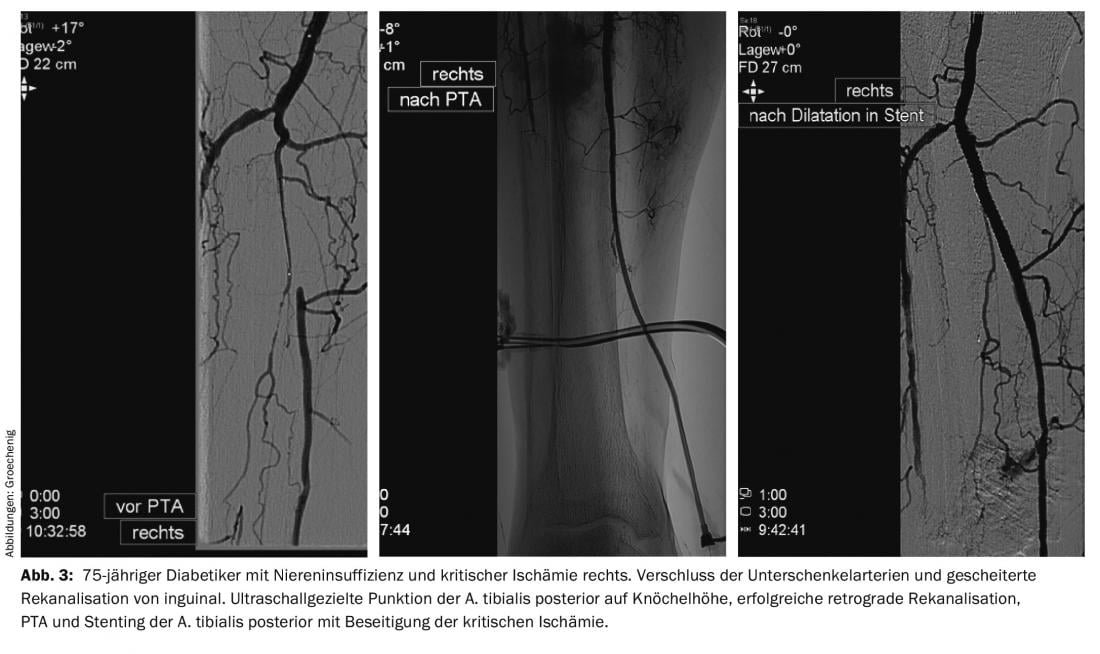
Sur le plan thérapeutique, les techniques de cathétérisme occupent aujourd’hui la première place dans le traitement de l’AOP. Le développement de fils affinés, de dispositifs de réentrée [5], de cathéters à ballonnet ultrafins et glissants, de dispositifs d’athérectomie, de cathéters de lyse et d’aspiration permet des interventions qui étaient considérées comme impossibles il y a quelques années (figures 2 et 3).
Mais les interventions sont également devenues beaucoup plus exigeantes et demandent beaucoup plus de temps et de ressources, ce qui n’est pas ou pas suffisamment pris en compte dans la structure de rémunération actuelle. Cela entraîne une pression considérable sur les coûts des hôpitaux ayant une fonction de centre.
Aujourd’hui, le problème n’est pas tant de recanaliser les occlusions de longue durée que de les maintenir ouvertes pendant une période prolongée. De nombreuses questions restent sans réponse : “Inhibition des plaquettes en monothérapie ou en bithérapie ?”, “Anticoagulation ?”, “Si oui, avec quoi ?”, etc. Il n’existe pratiquement pas de grandes études randomisées similaires à celles menées en cardiologie, de sorte que nous devons nous en tenir au modèle de la cardiologie, qui n’est malheureusement pas entièrement transposable. Après tout, un avis d’experts [6] a été publié il y a quelques années et il est possible de s’en inspirer. Une prophylaxie efficace des récidives s’achète toujours au prix d’une tendance accrue aux saignements, mais là aussi, heureusement, les choses évoluent : le développement de nouveaux antiplaquettaires est en bonne voie. La première molécule approuvée par la FDA est le vorapaxar. Ces substances agissent spécifiquement là où leur action est nécessaire [7] – c’est-à-dire là où les plaquettes sont activées en raison d’une lésion intimale, elles sont bloquées de manière sélective. La fibrine, qui joue un rôle important dans l’hémostase, n’est pas affectée. Cela donne une efficacité encore meilleure avec une plus grande sécurité thérapeutique.
Syndrome du pied diabétique
J’adorerais vous parler de quelque chose de nouveau, d’autant plus que l’OMS a lancé il y a dix ans un programme visant à réduire de 50% l’incidence des amputations chez les diabétiques [8]. Dans le monde, une amputation est pratiquée toutes les 30 secondes sur une personne diabétique. 12 à 25% des diabétiques développent un syndrome du pied diabétique. Un ulcère du pied chez un diabétique signifie un risque d’amputation 24 fois plus élevé. Lorsque l’OMS a procédé à une révision des objectifs dix ans après le lancement du programme susmentionné, elle a dû constater que rien n’avait changé. Et c’est triste, car 85% des amputations pourraient être évitées !
Chez le diabétique, on trouve une situation spécifique résultant de l’interaction de nombreux facteurs qui se potentialisent et sont souvent sous-estimés. Les personnes touchées présentent souvent non seulement une ischémie critique isolée, mais également une neuropathie, des lésions de pression et une infection. De plus, le diagnostic est plus difficile : d’une part, les valeurs ABI sont faussement élevées en raison de la médiaclérose. D’autre part, le pouls peut être apparemment palpable, mais il s’agit en réalité d’un simple battement lorsque l’artère est obstruée au niveau proximal, ou le patient ne présente aucun symptôme.
Les patients souffrant du syndrome du pied diabétique doivent être immédiatement pris en charge dans un centre disposant de tous les services spécialisés 24 heures sur 24. Chez plus de 50% des patients atteints, on trouve une artériopathie oblitérante des membres inférieurs. L’objectif minimal est l’ouverture d’au moins un vaisseau – si l’on parvient à ouvrir plusieurs vaisseaux, c’est encore mieux, mais le nombre d’artères rouvertes n’a pas d’influence sur le taux de conservation de la jambe [9]. Le taux d’ouverture à 36 mois n’a pas non plus d’influence, des deuxièmes interventions sont souvent nécessaires pour améliorer le taux de perméabilité. [10]. Il est important d’y penser tôt, de rétablir la perfusion de manière agressive et par tous les moyens possibles, puis de surveiller étroitement le patient afin de détecter la récidive à temps et, le cas échéant, d’améliorer le taux d’ouverture par une nouvelle intervention.
Thromboembolie veineuse
En ce qui concerne le traitement pharmacologique, les nouveaux anticoagulants directs (DOAK) ont rendu le traitement plus simple et plus sûr, mais aussi plus coûteux. Les quatre DOAK autorisés en Suisse (tableau 1) se distinguent par leurs indications, leurs dosages et leurs restrictions d’utilisation. Ils ont tous en commun l’absence (encore) d’antidote et le fait qu’ils ne sont pas autorisés en cas de fonction rénale réduite. Ce dernier uniquement parce qu’il n’a pas été étudié. Les patients présentant une fonction rénale réduite n’ont tout simplement pas été inclus dans les études.

L’approche de la thromboembolie veineuse aiguë par cathétérisme n’est pas tout à fait nouvelle, mais elle se développe de plus en plus. Une lyse locale doit permettre de réduire la charge thrombogène et le risque d’embolie pulmonaire, de démasquer d’éventuels obstacles anatomiques comme dans le cas du syndrome de May Turner et, surtout, de réduire la fréquence du syndrome post-thrombotique. Toutefois, de grandes études multicentriques sont encore en cours, de sorte qu’il n’est pas possible de formuler une recommandation définitive à l’heure actuelle.
J’espère que ce petit aperçu vous a donné un aperçu des développements actuels d’une discipline très intéressante et très dynamique. Je me tiens à votre disposition pour toute question, suggestion ou critique.
Littérature :
- Fowkes GR, et al : Comparaison des estimations globales de la prévalence et des facteurs de risque de l’artériopathie périphérique en 2000 et 2010 : une revue systématique et une analyse. The Lancet 2013 ; 382 : 1329-1340.
- Marsico F, et al : Prévalence et sévérité de l’athérosclérose coronarienne et carotidienne asymptomatique chez les patients atteints de maladie artérielle des membres inférieurs. Atherosclerosis 2013 ; 228 : 386-389.
- Montorsi F, et al : Erectyle dysfunction, prevalence, time of onset and association with risk factors in 300 consecutive patients with acute chest pain and angiographically documented coronary artery disease. Eur Urol 2003, 44 ; 360-365.
- Spence JD, Hackam DG : Traiter les artères plutôt que les facteurs de risque. Un changement de paradigme dans la gestion de l’athérosclérose. Accident vasculaire cérébral 2010 ; 41 : 1193-1199.
- Langhoff R, et al : Successful revascularziation of chronic total occlusion of lower extremity arteries : a wire only and bail out use of re-entry device approach. J Cardiovasc Surg (Torino) 2013 Oct ; 54(5) : 553-559.
- Jäger KA, et al : Consensus suisse sur le traitement par inhibiteurs de la fonction plaquettaire en angiologie. Forum Médical Suisse 2009 ; 9(39) : 690-693.
- Morrow DA, et al : Vorapaxar in the secondary prevention of atherothrombotic events. N Engl J Med 2012 ; 366 : 1404-1413.
- Boulton AJ, et al : The global burden of diabetic foot disease. Lancet 2005 ; 366 : 1719- 1724.
- Iida O, et al. : Importance du concept d’angiosome pour le traitement endovasculaire chez les patients atteints d’ischémie critique des membres. Catheter Cardiovasc Interv 2010 ; 75(6) : 830-836.
- Romiti M, et al : Meta-analysis of infrapopliteal angioplasty for chronic critical limb ischaemia. J Vasc Surg 2008 May ; 47(5) : 975-981.
PRATIQUE DU MÉDECIN DE FAMILLE 2015 ; 10(11) : 8-12