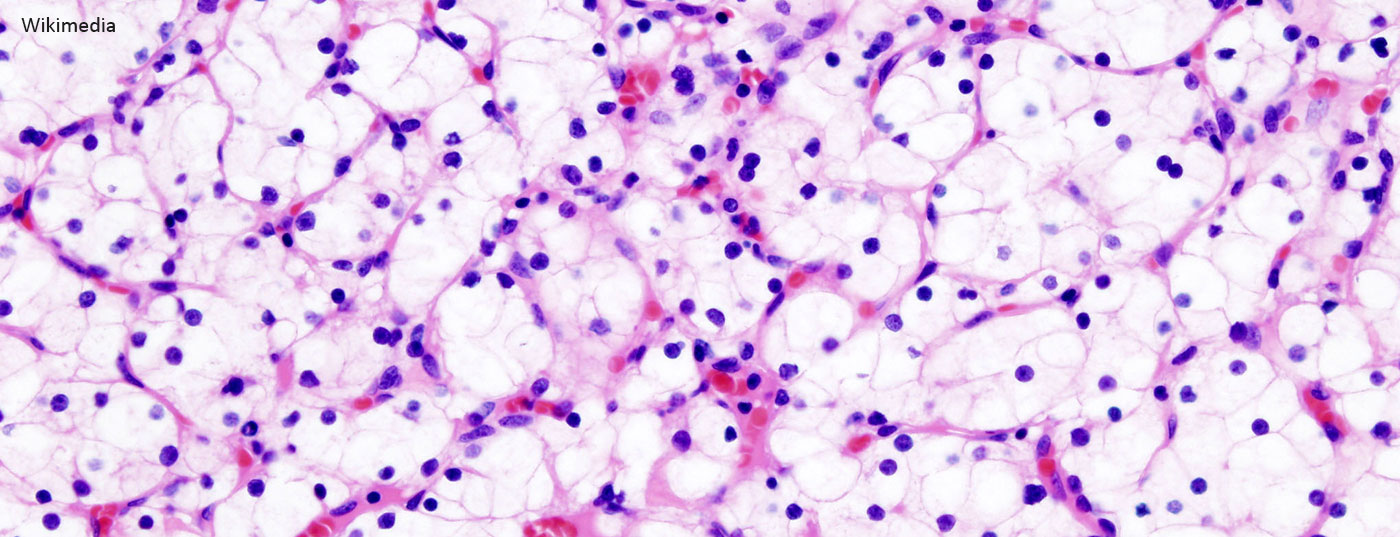
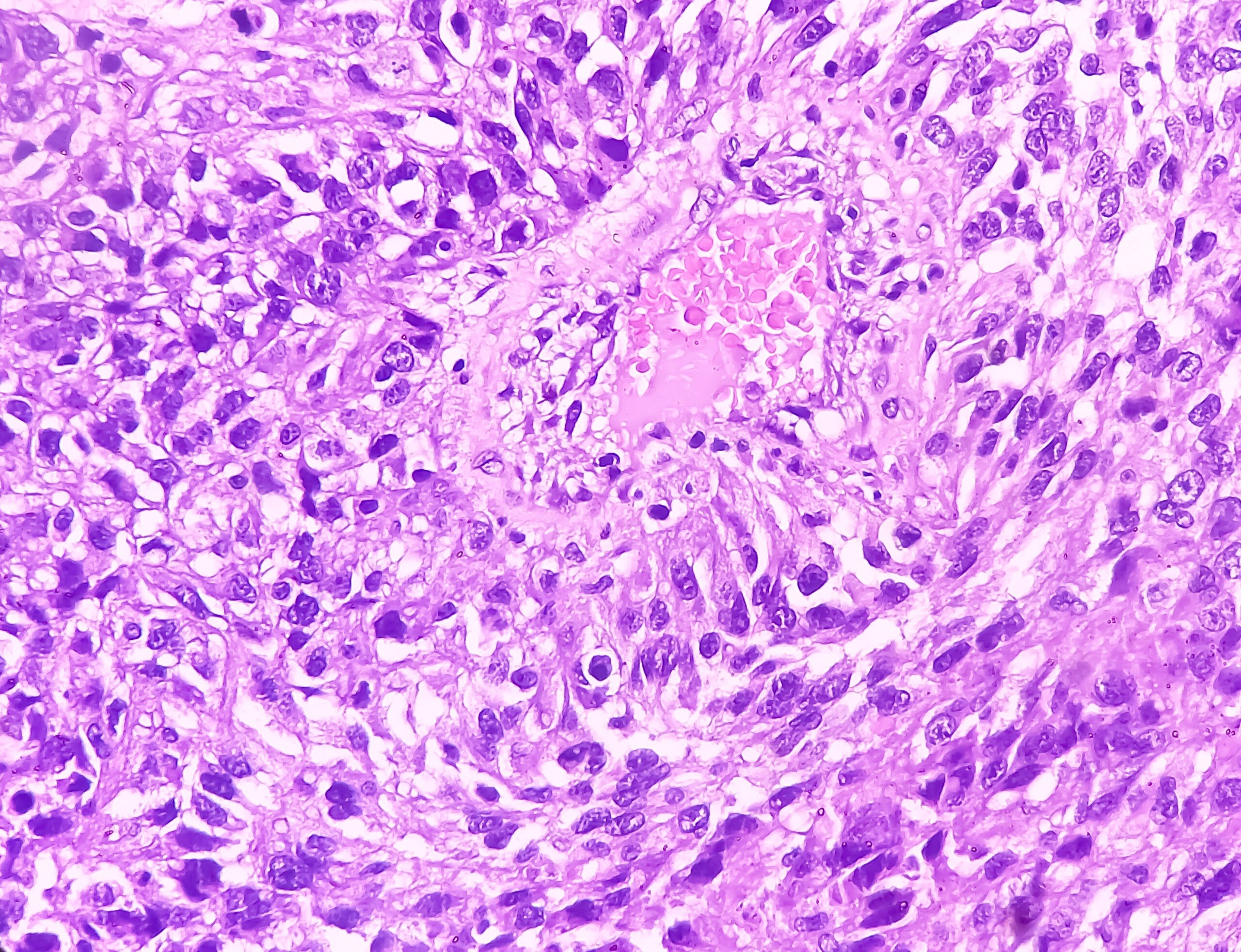
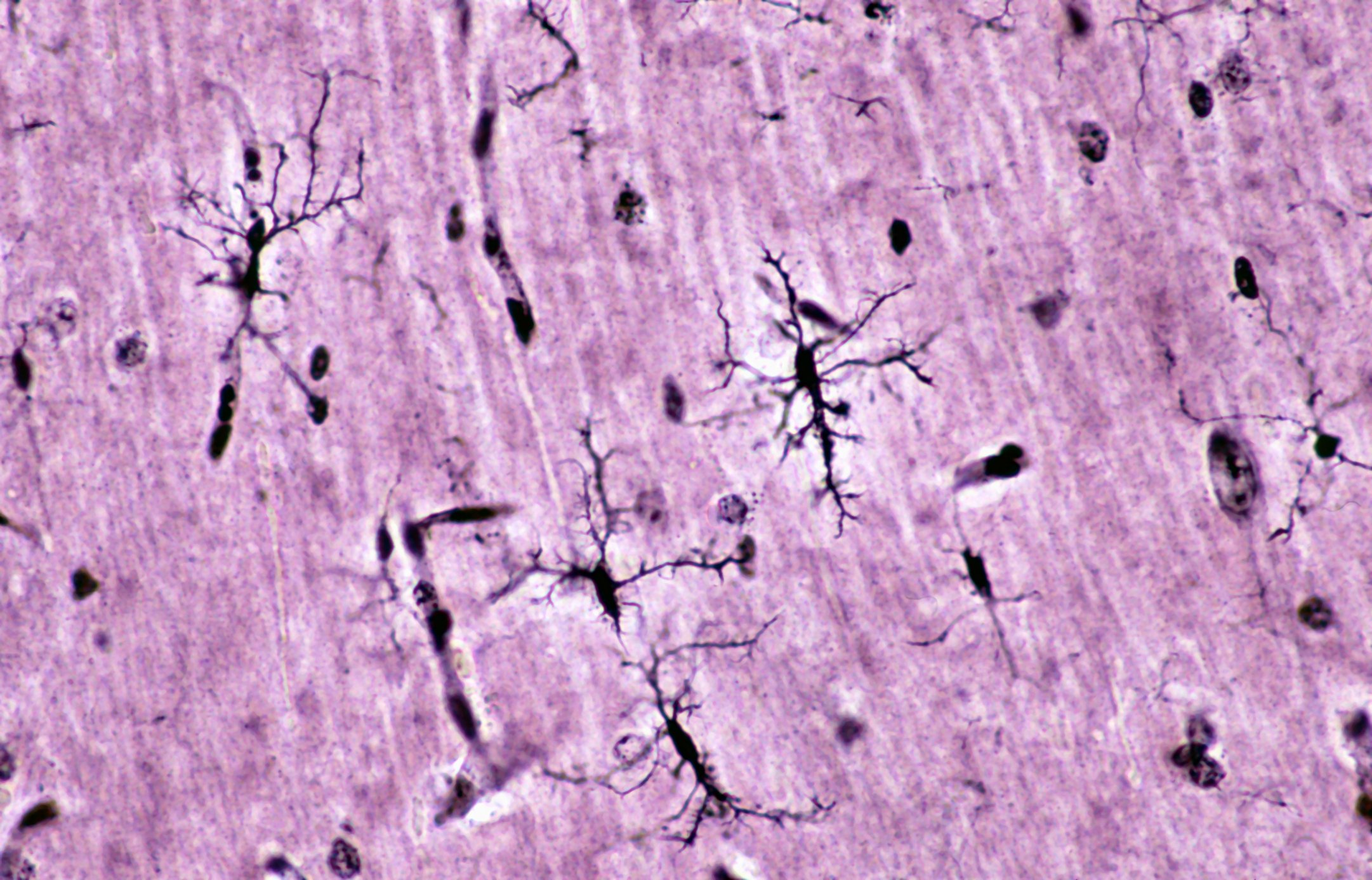
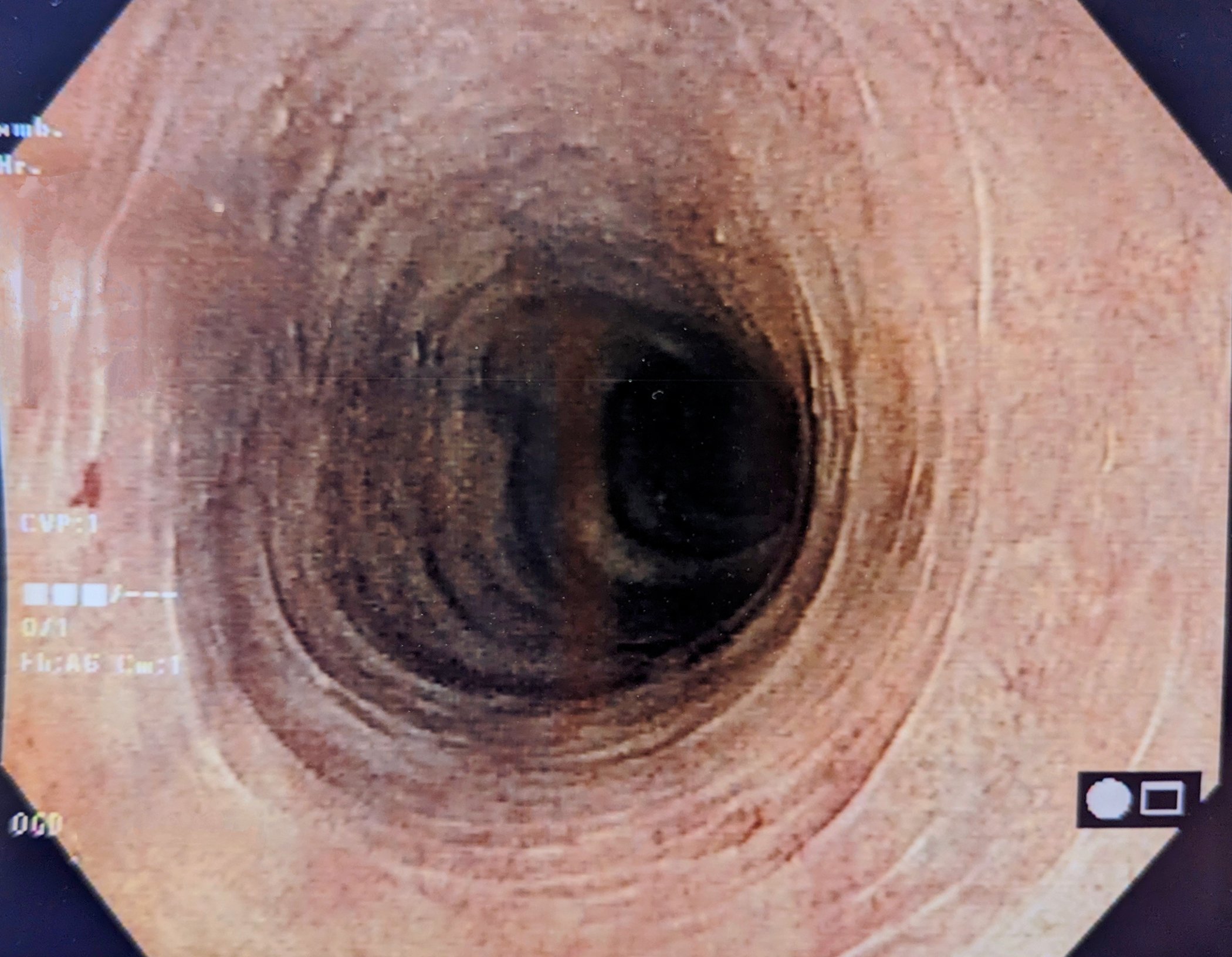
Les patients atteints d’un carcinome rénal opérable doivent continuer à être suivis après la néphrectomie. Selon une étude menée dans l’environnement de la célèbre clinique Mayo de Rochester, la durée nécessaire du suivi après néphrectomie peut être déterminée de manière adéquate et individuelle à l’aide d’un modèle de risque [1]. La question est la suivante : à partir de quand le risque de décès par ailleurs (non lié au carcinome rénal) dépasse-t-il le risque de récidive ? Les chercheurs ont étudié ce point en se basant sur des paramètres tels que l’âge, le stade de la tumeur, le lieu de la récidive et la comorbidité. Des différences étonnantes ont été observées au sein des groupes de patients. Une autre étude, présentée au 67e congrès de la DGU, a été consacrée à la distinction pronostique des patients atteints d’un carcinome rénal de stade pT3 [2].
Le traitement standard du carcinome rénal est la néphrectomie avec ablation chirurgicale complète du tissu tumoral. Toutefois, après l’opération, la récidive menace, d’où l’importance cruciale du suivi.
Les deux ou trois premières années après l’opération sont généralement considérées comme critiques, car la plupart des récidives surviennent durant cette période. Cependant, la durée appropriée du suivi après une néphrectomie radicale ou partielle reste incertaine et il n’existe pas de données probantes pour étayer les recommandations et les lignes directrices actuelles.
Risque de récidive et de décès
Une étude publiée en septembre dans le Journal of Clinical Oncology adopte à cet égard une nouvelle approche adaptée au risque : elle compare le risque de récidive au risque de décès par ailleurs.
L’interaction entre les différents facteurs de risque indique à partir de quel moment le risque d’un autre décès dépasse celui d’une récidive. Jusqu’à ce moment, les bénéfices du suivi justifient les ressources que le système médical y consacre, et c’est donc là que l’on pourrait fixer la durée optimale du suivi.
Par la suite, d’autres facteurs de santé du patient auront un impact plus important sur la survie que le carcinome rénal et, par conséquent, un suivi limité “uniquement” à cette tumeur sera toujours trop court et ne vaudra plus la peine d’être payé. Bien entendu, ces considérations ne tiennent pas compte des aspects éthiques, car elles se basent uniquement sur des valeurs statistiques.
De grandes différences concernant la durée optimale
Les patients ont été stratifiés selon l’âge, le stade de la tumeur, le lieu de la récidive et l’indice de comorbidité de Charlson, c’est-à-dire la probabilité de mourir d’une comorbidité dans les années à venir.
Au total, les données de 2511 personnes atteintes d’un carcinome rénal M0 et opérées entre 1990 et 2008 ont été utilisées. Après un suivi médian de neuf ans, 676 des patients ont développé une récidive. Des différences importantes sont apparues dans le modèle de risque. Comme c’est souvent le cas, l’âge a été un facteur important :
- Les patients de moins de 50 ans atteints d’un cancer de stade pT1Nx-0 et dont la valeur sur l’ICC était ≤1 présentaient en moyenne un risque de récidive (abdominal) plus élevé que les autres risques de décès pendant plus de 20 ans après l’opération. Ce n’est qu’alors que le risque de décès non associé à un carcinome rénal dépassait celui de la récidive. Il est donc possible que le suivi doive être étendu à une période plus longue qu’aujourd’hui.
- En revanche, les patients âgés de 80 ans ou plus présentant un carcinome de stade pT1Nx-0 et une valeur sur l’ICC de ≤1 avaient en moyenne un risque de récidive plus élevé que les autres risques de décès jusqu’à six mois seulement après la chirurgie. Par la suite, le risque de décès non associé à un carcinome rénal dépassait déjà celui de récidive. A partir de ce moment, le bénéfice d’un suivi de routine ne justifierait plus statistiquement les efforts et les coûts du système médical. D’autres facteurs de santé requièrent désormais davantage d’attention.
- Il est presque évident qu’une valeur croissante de l’ICC raccourcissait également rapidement le délai : chez les patients présentant une tumeur pT1Nx-0, mais un ICC ≥2, l’autre risque de décès dépassait déjà le risque de récidive dans l’abdomen 30 jours après l’opération – et ce, de manière remarquable, indépendamment de l’âge du patient. Peut-être n’est-il donc pas nécessaire d’effectuer un suivi de routine dans ce groupe ?
Et maintenant ?
Il n’est pas possible de tirer des conclusions définitives de cette étude, mais elle donne matière à réflexion. Les données montrent que certains patients ont besoin d’un suivi plus long que celui prévu par les lignes directrices. Pour d’autres, en revanche, une période plus courte est justifiée, du moins statistiquement. Néanmoins, le jugement clinique et l’expérience de chaque patient doivent rester les principaux piliers de la prise de décision, comme le soulignent à plusieurs reprises les auteurs. Mais par rapport à la pratique actuelle, leur approche peut tout de même fournir une base plus stable sur laquelle fonder la décision clinique. Le débat sur la durée optimale du suivi ne va donc pas s’éteindre de sitôt.
Distinction pronostique avec la classification TNM
Une étude rétrospective présentée au 67e congrès de la DGU [2] a porté un regard critique sur deux points de la septième édition de la classification TNM :
Au stade pT3a, les deux facteurs d’infiltration graisseuse périrénale (PFI) et d’invasion des veines rénales (RVI) sont combinés, bien qu’il ne soit pas certain que leur influence pronostique soit réellement comparable.
En outre, la distinction pronostique entre les stades pT3a et pT1-pT2 fait l’objet de controverses.
Sur la base de 7384 patients atteints d’un cancer du rein de stade pT1-pT3a ayant subi une néphrectomie (radicale ou partielle) entre 1992 et 2010, les chercheurs se sont penchés sur la question suivante : les patients ayant subi une PFI seule présentent-ils réellement une mortalité spécifique au cancer comparable à celle des patients ayant subi une RVI±PFI ?
L’analyse multivariée, qui a pris en compte l’âge, le sexe, la méthode chirurgicale, le sous-type, la taille de la tumeur, le grade de Fuhrman et le statut ganglionnaire, a révélé que les patients avec une PFI seule (HR 1,94) et ceux avec une RVI±PFI (2,12) présentaient un risque de mortalité significativement plus élevé que les patients au stade pT1-2. Les deux facteurs (PFI et RVI) sont donc des facteurs pronostiques indépendants de la mortalité spécifique au cancer.
Si l’on compare à nouveau les patients PFI avec les patients RVI±PFI, aucune différence significative n’apparaît dans le risque de mortalité (HR 1,17 ; IC à 95% 0,86-1,61 ; p=0,316). Le regroupement de PFI et RVI dans une catégorie de staging semble donc justifié. Les deux facteurs ont une influence pronostique comparable et contribuent tous deux indépendamment à une augmentation du risque.
Sous-totalisation des tumeurs pT2 et pT3a ≤7 cm
En ce qui concerne la deuxième critique, les chercheurs concluent que les patients atteints de tumeurs pT2 et ceux atteints de tumeurs pT3a ≤7 cm (avec PFI et/ou RVI) présentent une grande proximité pronostique, ce qui justifierait leur regroupement dans une même catégorie de staging. Les auteurs proposent donc, sur la base de cette étude, un système de staging alternatif : Sous-sommation des tumeurs pT2 de toutes tailles et des tumeurs pT3a ≤7 cm. Ainsi, contrairement à la classification TNM actuelle, tous les stades ont pu être distingués sur le plan pronostique sans aucun chevauchement des intervalles de confiance à 95%.
Littérature :
- Stewart-Merrill SB, et al : Oncologic Surveillance After Surgical Resection for Renal Cell Carcinoma : A Novel Risk-Based Approach. JCO septembre 8, 2015. doi : 10.1200/JCO.2015.61.8009 [Epub ahead of print].
- Brookman-May S : Carcinome à cellules rénales – Analyse de la base de données CORONA : les 5 principales conclusions. Journal du congrès du 67e congrès de la DGU 2015.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(9-10) : 2-3