Outre les chlamydias et les gonocoques, il existe de nombreux agents pathogènes qui peuvent provoquer une urétrite. Parfois, des particularités cliniques peuvent indiquer le germe responsable, comme une douleur et une méatite prononcées pour les adénovirus et les herpèsvirus, ou une balanoposthite concomitante pour Mycoplasma genitalium. Le diagnostic microscopique du fluor permet de différencier une gonorrhée d’une NGU, permet un traitement immédiat et peut en outre donner des indications pour une urétrite virale. En particulier dans les formes chroniques ou récidivantes, il convient de procéder à une large recherche d’agents pathogènes en tenant compte de Mycoplasma genitalium et de Trichomonas vaginalis. En cas d’échec du traitement standard (en particulier M. genitalium et U. urealyticum), l’azithromycine doit être utilisée de manière prolongée.
Après avoir exclu une infection des voies urinaires, il convient de distinguer les symptômes d’une urétrite non infectieuse de ceux d’une urétrite infectieuse (tableau 1). Les causes typiques d’urétrites non infectieuses sont des déclencheurs mécaniques et traumatiques, de même que des causes chimiques (par ex. désinfectants, savons) ou locales telles que des anomalies congénitales, des phimosis, des néoplasies peuvent être accompagnées d’une urétrite non infectieuse. Traditionnellement, l’urétrite infectieuse est divisée en deux groupes : L’urétrite gonococcique (UG) et l’urétrite non gonococcique (UNG). Cette classification a été établie historiquement pour distinguer la NGU – un groupe d’infections de symptomatologie similaire mais dont l’étiologie était à l’époque peu claire, hétérogène et difficile à déterminer – de l’urétrite gonorrhéique, beaucoup mieux étudiée et plus grave. La NGU, autrefois appelée urétrite non spécifique, était relativement rare avec la gonorrhée, mais son incidence dépasse aujourd’hui de loin celle de la gonorrhée et il n’est pas rare qu’elle soit asymptomatique. Toutefois, les paragraphes suivants traitent exclusivement de l’urétrite infectieuse non gonococcique ainsi que de son spectre d’agents pathogènes, des étapes de clarification nécessaires et des mesures thérapeutiques.

La prévalence de la gamme d’agents pathogènes en cause varie selon les régions (tableau 1). La proportion de patients chez lesquels aucun agent pathogène n’a pu être isolé dépend du diagnostic réalisé et du fait que les urétrites virales, par exemple, sont plus fréquentes qu’on ne le pensait, mais rarement recherchées. Le NGU est présent lorsque le frottis urétral coloré contient plus de cinq leucocytes polymorphonucléaires.
par champ visuel (grossissement total de 400 fois) en l’absence de diplocoques intracellulaires.
Chlamydia
Chlamydia trachomatis comprend au total 15 sérotypes définis par différents antigènes protéiques, désignés par les lettres A-C, D-K et L1-L3, qui provoquent différentes maladies. Les sérovars D-K sont à l’origine de l’urétrite, de la cervicite, de l’endométrite et de la salpingite. Les agents pathogènes n’infectent pas l’épithélium pavimenteux mais uniquement l’épithélium cylindrique et présentent une prévalence de 4 à 5 % chez les femmes en Europe.
C. trachomatis est retrouvé dans 15 à 41% des cas d’urétrite chez l’homme. Cependant, la littérature de ces dix dernières années n’indique pas de manière uniforme la fréquence de la chlamydia en tant qu’agent pathogène. La transmission se fait lors de contacts sexuels non protégés, l’âge inférieur à 20 ans, la promiscuité et l’absence ou la mauvaise utilisation du préservatif étant considérés comme des facteurs de risque. Un dépistage annuel est recommandé pour les patientes sexuellement actives de moins de 25 ans, ainsi que pour les femmes de plus de 25 ans présentant des facteurs de risque (partenaires multiples, nouveaux partenaires). Les infections génitales à chlamydia touchent cependant tous les groupes sociaux de manière égale.
L’infection à chlamydia chez l’homme se manifeste par des pertes séreuses après une période d’incubation de sept jours à trois semaines. En outre, des brûlures et une algurie sont indiquées. L’examen ne révèle généralement rien d’autre qu’une discrète rougeur de l’orifice urétral et une adhérence de l’ouverture de l’urètre (Fig. 1). Chez 30 à 50% des hommes infectés, l’infection est asymptomatique. La localisation la plus fréquente de l’infection à chlamydia chez la femme est le col de l’utérus, l’infection étant asymptomatique dans près de 70% des cas. Non traitée, une infection génitale à chlamydia persiste en moyenne deux ans chez la femme. Cette infection chronique asymptomatique semble être la cause principale de l’obstruction bilatérale des trompes, qui est la cause la plus fréquente d’infertilité chez les femmes et qui, selon les estimations, touche plus de 100 000 femmes en Allemagne. Les manifestations cliniques se traduisent par des pertes génitales blanchâtres et jaunâtres, qui entraînent des démangeaisons et des brûlures au niveau de l’introitus vaginae. Il n’est pas rare que des infections pharyngées soient présentes en plus de manière asymptomatique, mais elles ne nécessitent pas de traitement différent.
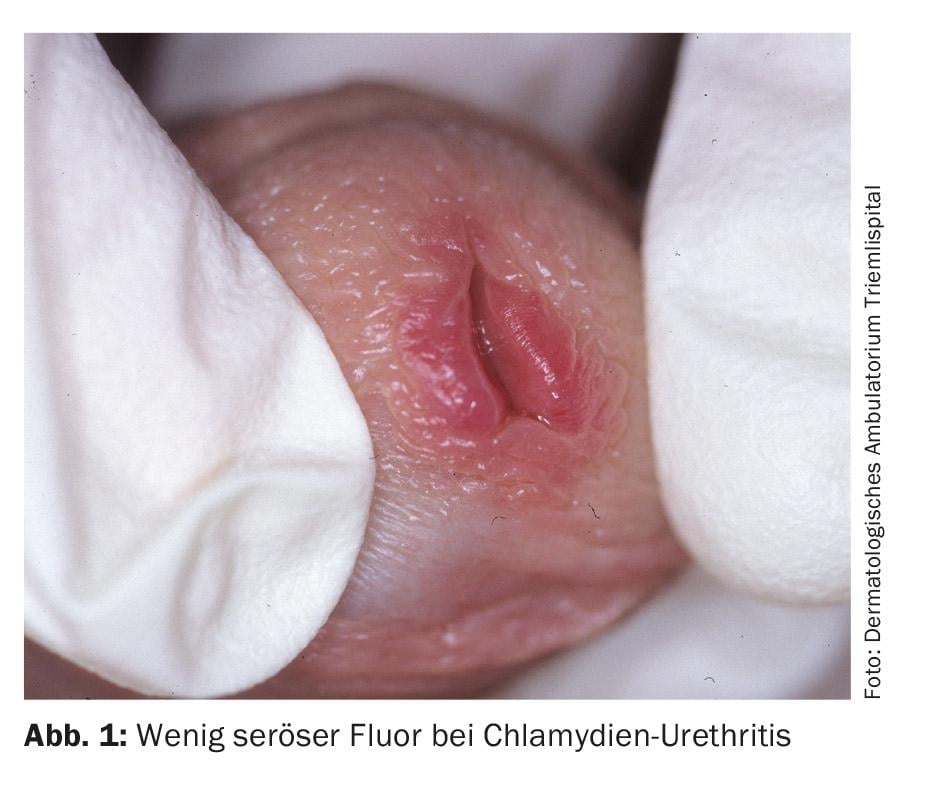
Diagnostic : chez les femmes, les agents pathogènes sont détectés par des frottis cervicaux ou vaginaux ou des analyses d’urine (un peu moins sensibles) par PCR. Chez l’homme, une analyse d’urine ou un prélèvement de l’urètre peuvent également être effectués.
En raison de leur petite taille et de leur faible affinité pour les colorants, les chlamydiae ne sont pas visibles nativement ou par coloration. En tant que bactéries intracellulaires obligatoires, il est également difficile de les cultiver, raison pour laquelle la culture n’est plus guère pratiquée.
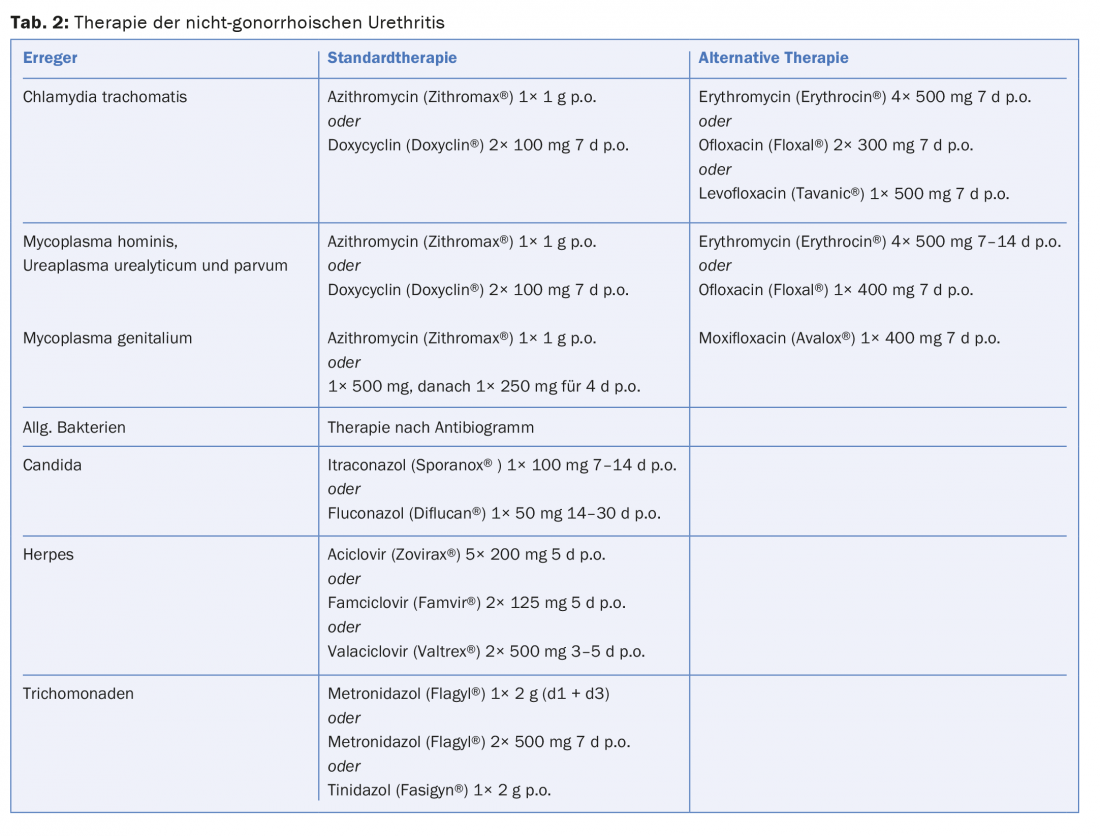
Traitement : les infections urogénitales non compliquées peuvent être traitées par doxycycline 2× 100 mg pendant sept jours ou azithromycine 1 g en une seule fois. L’efficacité des deux antibiotiques est presque équivalente, avec une réponse légèrement meilleure sous doxycycline, mais une meilleure observance sous azithromycine. Comme cela a été récemment documenté, les taux de guérison des NGU semblent légèrement diminuer sous ces traitements standard, mais le passage à d’autres médicaments n’est pas recommandé. Sur la base des données actuelles, l’azithromycine, tout comme l’érythromycine, peut être considérée comme sûre pendant la grossesse. Alternativement, pendant la grossesse, l’amoxycilline peut être administrée 3× 500 mg/j pendant sept jours.
Mycoplasmes
Les mycoplasmes sont des bactéries gram-négatives immobiles. Elles se distinguent des autres bactéries par la petite taille de leurs cellules, leur génome réduit et l’absence de paroi cellulaire. Sur des milieux de culture spéciaux, on peut distinguer les uréaplasmes qui coupent l’urée (Ureaplasma urealyticum) et les mycoplasmes qui ne coupent pas l’urée (Mycoplasma hominis). Par la suite, U. urealyticum a été divisé en Biovar 1 et Biovar 2. En 1999, Biovar 1 a été classé comme nouvelle espèce bactérienne indépendante sous le nom de U. parvum, tandis que Biovar 2 a été désigné comme U. urealyticum. En 1981, un autre variant – Mycoplasma genitalium – a été découvert. Par la suite, plusieurs études l’ont décrit comme l’agent pathogène de l’urétrite aiguë et, de plus en plus, comme la cause de l’urétrite chronique, mais aussi de la cervicite, de l’endométrite et de l’infertilité féminine.
L’importance des mycoplasmes génitaux dans le développement des maladies sexuellement transmissibles est controversée. M. hominis, bien que détecté dans le tractus urogénital, ne semble pas être responsable d’une NGU chez l’homme. U. urealyticum (Biovar 2) peut également être fréquemment isolé du tractus génital de femmes et d’hommes en bonne santé, des manifestations cliniques possibles ont été postulées chez des patients plus jeunes, en présence d’une concentration bactérienne élevée, avec le sérotype spécifique Biovar 2 et en cas de primo-infection. La signification d’U. parvum reste inexpliquée.
Les infections à mycoplasmes peuvent provoquer des symptômes cliniques d’urétrite chez l’homme, en plus d’une évolution silencieuse. Les infections à U. uréalyticum et M. genitalium, en particulier, se manifestent sous la forme d’une urétrite aiguë, mais aussi chronique, avec dysurie et fluor. La particularité clinique de l’urétrite à M. genitalium est l’association significativement plus fréquente avec une balanite et/ou une posthite, ce qui n’est pas observé avec les chlamydiae et les uréaplasmes.
Diagnostic : en raison de leur taille et de leur faible affinité pour les colorants, il n’est pas possible de détecter les mycoplasmes dans les préparations de Gram. U. urealyticum, U. parvum et M. hominis sont détectés par PCR ou par culture, M. genitalium uniquement par PCR. Les examens sérologiques n’ont pas d’importance pour le diagnostic des infections à mycoplasmes dans la pratique clinique quotidienne.
Traitement : les médicaments de choix sont les tétracyclines, les antibiotiques macrolides et les quinolones. Doxycycline 2× 100 mg/d pendant sept jours ou azithromycine 1× 1 g sont considérés comme le traitement standard de M. hominis, U. parvum et U. urealyticum (Tab.2). Dans les formes chroniques d’urétrite, une durée de traitement plus longue peut être nécessaire. L’azithromycine est recommandée pour le traitement de l’urétrite génitale, car son efficacité est nettement supérieure à celle des tétracyclines. De plus en plus d’échecs thérapeutiques ont été observés ces derniers temps, raison pour laquelle, en cas de non-réponse de 1 g d’azithromycine, un traitement de plusieurs jours est favorisé (Tab.2). La moxifloxacine est considérée comme le médicament de réserve absolu, mais les premiers échecs thérapeutiques ont également été décrits récemment en cas de résistance aux macrolides et aux quinolones. En cas d’augmentation des résistances, la place d’autres médicaments tels que la sitafloxacine ou la gatifloxacine doit être étudiée plus avant afin d’écarter la menace d’une absence de traitement de la M. genitalis.
Bactéries de la flore orale et anale
Les urétrites peuvent être causées par de nombreuses autres bactéries. Le staphylocoque doré peut entraîner une urétrite, une cystite ou une prostatite, en particulier chez les patients porteurs d’une sonde urétrale. Les streptocoques et surtout les entérocoques peuvent également être à l’origine d’une urétrite. E. coli peut rarement provoquer une urétrite, une cystite, une prostatite ou une épididymite ainsi qu’une pyélonéphrite chez les hommes après un rapport anal. Dans de rares cas, une infection à Pseudomonas peut également évoluer sous la forme d’une urétrite.
Les agents pathogènes de la flore buccale tels que l’haemophilus influenzae et le parainfluenzae, mais aussi les méningocoques, peuvent souvent être en cause, d’autant plus que les rapports sexuels oraux sont aujourd’hui considérés par beaucoup comme peu problématiques en termes de transmission d’infections et que, par conséquent, peu de préservatifs sont utilisés lors des rapports sexuels oraux. La prévalence réelle des urétrites à Haemophilus est inconnue car, d’une part, il n’y a pas d’obligation de déclaration et, d’autre part, l’agent pathogène n’est généralement pas pris en compte dans le bilan.
Diagnostic : Pour établir le diagnostic, il faut toujours rechercher l’identification bactériologique de l’agent pathogène par culture.
Traitement : Le traitement dépend de l’agent pathogène et de l’antibiogramme.
Candida
Le Candida albicans peut entraîner une urétrite secondaire à une balanite ou à une vulvovaginite, en particulier en présence d’un diabète sucré ou d’une immunodéficience.
Diagnostic : la détection se fait par préparation directe et par culture mycologique.
Traitement : Le traitement fait appel à des dérivés de l’imidazole tels que l’itraconazole 100 mg/j pendant 7 à 14 jours ou le fluconazole 50 mg/j pendant 14 à 30 jours (tableau 2).
Virus
Une urétrite virale doit être suspectée lorsque les investigations bactériologiques se sont révélées infructueuses. L’urétrite à herpès simplex virus (HSV) se caractérise par un écoulement séreux douloureux, souvent accompagné d’éruptions herpétiformes sur les organes génitaux externes. Il est plus rare que l’infection à HSV soit exclusivement intra-urétrale (figure 2).
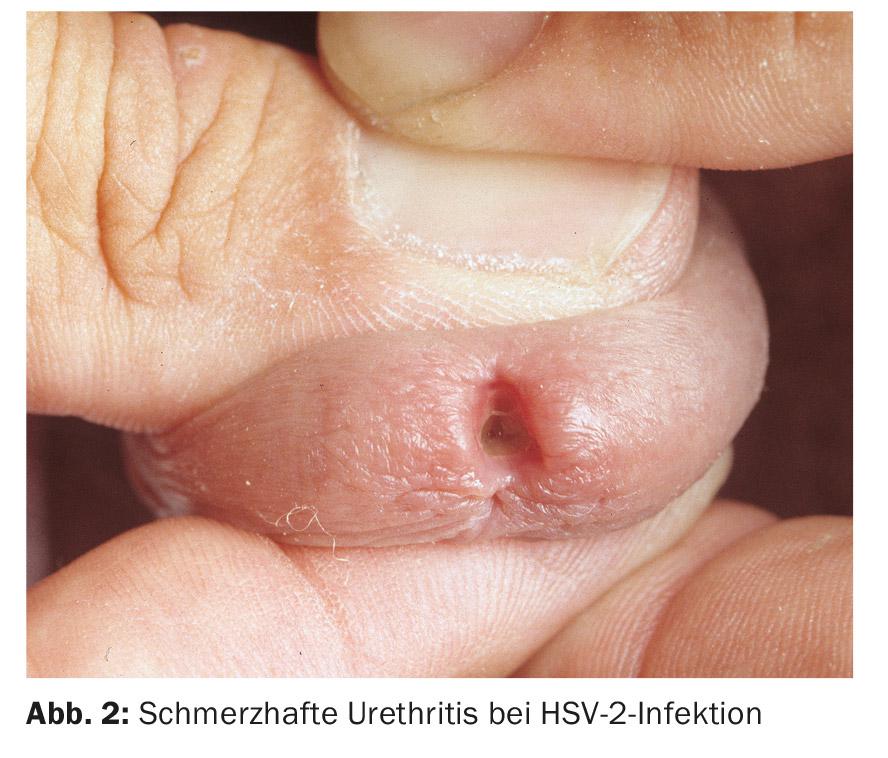
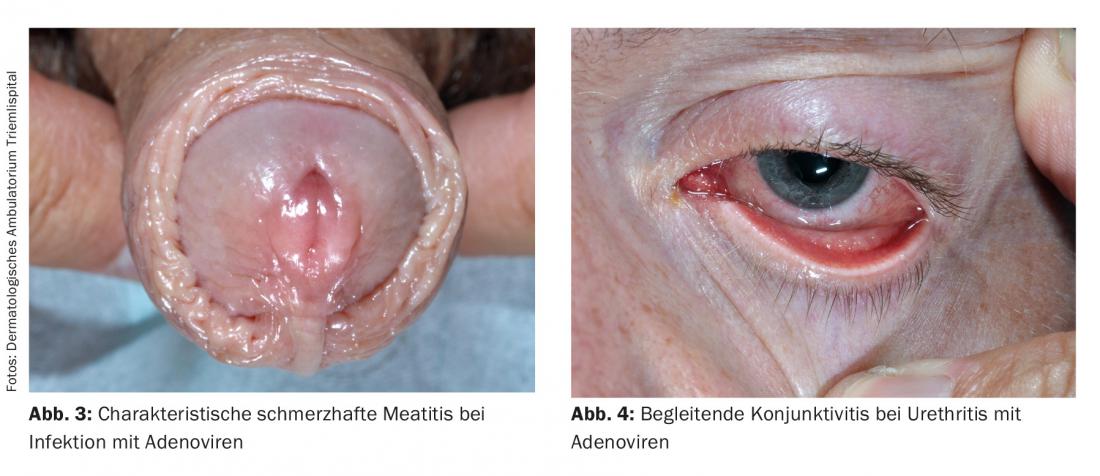
Des études récentes ont montré que l’HSV de type 1 provoque plus souvent une NGU que l’HSV de type 2. La proportion d’HSV dans les NGU varie, mais dans une étude, elle atteignait 12%. Les adénovirus peuvent également provoquer une urétrite. Celle-ci se caractérise généralement par une méatite et des douleurs prononcées (fig. 3) ; elle est également accompagnée dans la majorité des cas d’une conjonctivite très contagieuse (fig. 4) . La présence d’un grand nombre de cellules mononucléaires dans une préparation directe peut être un élément de diagnostic. En particulier après un contact oral non protégé, les virus adéno et herpès simplex doivent être envisagés comme cause en l’absence d’identification de l’agent pathogène, de douleur marquée et de méatite. Les virus Epstein-Barr semblent également avoir une importance.
Diagnostic : en cas d’infection par l’herpès, l’examen par frottis est une bonne solution. La détection du HSV par culture nécessite environ 48 heures. Les virus ne peuvent être prélevés que sur des lésions fraîches pour être cultivés. Une PCR permet d’analyser le matériel de prélèvement en quelques heures. La culture et la PCR peuvent également être réalisées à partir de l’urine. La détection des antigènes par immunofluorescence est également utile pour établir le diagnostic. La détection des adénovirus par PCR peut se faire par frottis ou à partir de l’urine.
Traitement : Le traitement de l’urétrite herpétique fait appel, si nécessaire, à des analogues de nucléosides.
Trichomonas
Trichomonas vaginalis est un flagellé de forme ovale avec quatre flagelles (flagelles) et une membrane non ulcérente. La trichomonase est une infection sexuellement transmissible qui se produit dans le monde entier et dont la prévalence dépend des comportements sexuels à risque. Les statistiques révèlent des différences considérables dans les taux d’infection entre les différents groupes de population et entre les pays développés et les pays en développement. En Suisse, par exemple, cette infection joue un rôle mineur, contrairement à Seattle, où jusqu’à 20% des cas de NGU chez les hommes sont dus à cet agent pathogène.
Diagnostic : l’examen microscopique en préparation native avec du NaCl 0,9% de la voûte vaginale, du col de l’utérus et de l’urètre donne des taux de réussite allant jusqu’à 75%. La microscopie à polarisation ou à fond noir augmente le taux de réussite.
Un certain nombre de milieux de culture appropriés sont disponibles, avec une sensibilité d’environ 95%. Très peu de laboratoires proposent cette culture. De même, la PCR, qui présente la plus grande sensibilité, est encore peu répandue.
Traitement : la trichomonase peut être traitée avec du métronidazole 1× 2 g avec une éventuelle répétition après deux jours ou avec 2× 500 mg/j pendant sept jours, mais il faut souligner l’effet antabuse. Dans de rares cas, des résistances au métronidazole peuvent être observées. Par ailleurs, le tinidazole 1× 2 g est une option thérapeutique. Le tinidazole présente une demi-vie plus longue, moins d’effets secondaires et un taux de guérison légèrement supérieur.
Un exemple d’approche possible de l’urétrite est listé dans le tableau 3.

Littérature chez l’auteur
DERMATOLOGIE PRATIQUE 2015 ; 25(4) : 5-10











