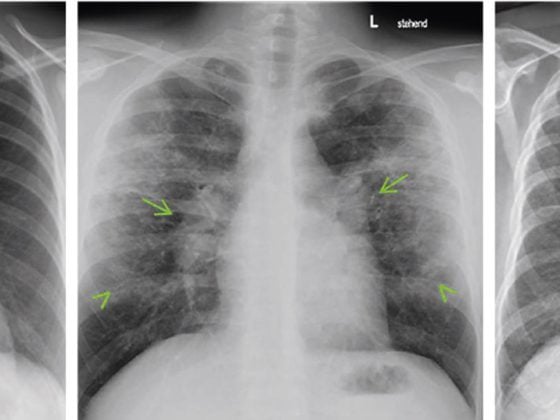
Souvent, même les patients emphysémateux “en fin de traitement” peuvent se voir proposer une amélioration de leur dyspnée et de leurs performances grâce à une procédure de réduction du volume pulmonaire. Les effets positifs post-interventionnels après une réduction chirurgicale ou bronchoscopique du volume pulmonaire l’emportent nettement sur la morbidité et la mortalité péri-interventionnelles relativement faibles. La réduction du volume pulmonaire par bronchoscopie permet souvent de proposer une bonne alternative aux patients “inopérables”. Le choix de la procédure appropriée doit être fait dans le cadre d’un consortium interdisciplinaire composé de pneumologues, de chirurgiens thoraciques et de radiologues, en tenant compte des facteurs fonctionnels, radiologiques, cliniques et subjectifs des poumons.
La broncho-pneumopathie chronique obstructive (BPCO) entraîne un rétrécissement irréversible des voies respiratoires (obstruction) et/ou une destruction du parenchyme pulmonaire (emphysème). Ces deux mécanismes entraînent une hyperinflation pulmonaire, qui se traduit par une dépression et un aplatissement du diaphragme. Cependant, un diaphragme aplati n’est plus en mesure de jouer son rôle de principal muscle respiratoire. Ceci, la perte de la surface d’échange de gaz ainsi que la diminution des forces de rappel élastique (“elastic recoil”) contribuent finalement à l’augmentation du travail respiratoire, ce que les patients concernés ressentent comme un manque d’air permanent. Au début, la dyspnée n’est signalée qu’à l’effort, puis au fur et à mesure de l’évolution de la maladie, elle devient une dyspnée de parole et de repos.
Les piliers du traitement conservateur comprennent en premier lieu l’arrêt systématique du tabac. En outre, les patients bénéficient d’une activité physique régulière (éventuellement d’une réadaptation pulmonaire ambulatoire/stationnaire) et de la prévention des complications infectieuses par la vaccination contre la grippe et le pneumocoque. Le traitement médicamenteux consiste principalement en une thérapie inhalée avec un ou deux bronchodilatateurs à longue durée d’action (bêtamimétiques, anticholinergiques). Les stéroïdes inhalés, les antibiotiques macrolides et/ou le roflumilast peuvent également être indiqués pour prévenir les exacerbations de la BPCO. Enfin, en cas d’hypoxémie de repos significative, une oxygénothérapie continue est mise en place. Si ces options thérapeutiques conservatrices sont largement épuisées, un traitement interventionnel peut être indiqué.
Principe du traitement interventionnel de l’emphysème
L’objectif d’un traitement interventionnel de l’emphysème est essentiellement de réduire l’hyperinflation pulmonaire, de sorte que le diaphragme aplati puisse retrouver sa forme caractéristique (bosse). En effet, c’est la bosse du diaphragme qui permet à la pompe des muscles respiratoires d’être fonctionnelle, ce qui entraîne une diminution de la dyspnée et une amélioration de la fonction pulmonaire. Cet objectif peut être atteint aussi bien par une réduction chirurgicale (LVRS) que par une réduction du volume pulmonaire par bronchoscopie (valves, coils, application de vapeur), pour autant que certaines conditions soient remplies (tab. 1). En particulier, les patients fortement gênés par la dyspnée bénéficient d’un traitement interventionnel de l’emphysème. Il est toutefois indispensable d’avoir arrêté de fumer au préalable et d’avoir terminé la rééducation pulmonaire.

Réduction chirurgicale du volume pulmonaire (LVRS)
Dans le cas de la LVRS, le parenchyme pulmonaire fonctionnel est conservé et seules les parties du poumon emphysémateuses fortement endommagées sont généralement réséquées par thoracoscopie sous anesthésie générale. Pour définir les zones cibles de la résection, une scintigraphie pulmonaire de perfusion et une tomodensitométrie à haute résolution sont indiquées pour la planification de l’opération. La LVRS permet, en cas de sélection adéquate des patients, d’obtenir non seulement une amélioration de la qualité de vie, de la capacité physique et de la fonction pulmonaire, mais aussi une réduction de la mortalité (tab. 2).
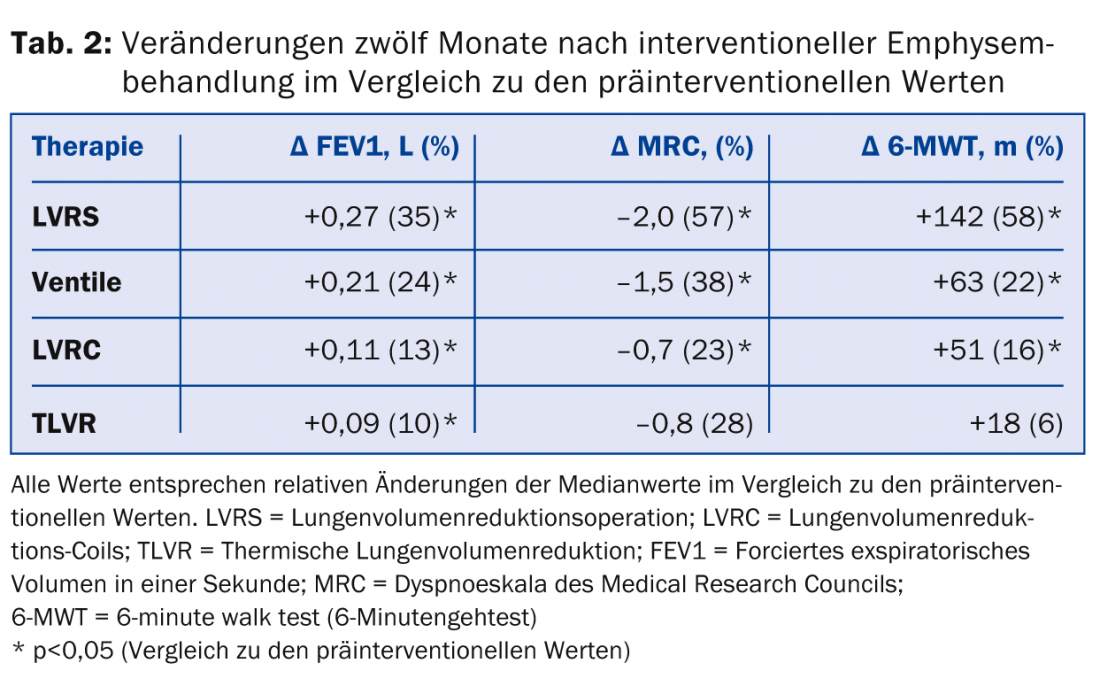
De plus, le risque de futures exacerbations de BPCO semble plutôt diminuer en postopératoire. Dans la plupart des cas, ces effets positifs persistent pendant au moins cinq ans après l’opération. Cependant, une fois que les valeurs de la fonction pulmonaire et les symptômes sont revenus au niveau préopératoire, une nouvelle LVRS peut être évaluée, car elle permet d’obtenir à nouveau une amélioration qui dure au moins un an. Un foyer rond suspect de carcinome dans une zone cible emphysémateuse peut également être retiré dans le cadre de la LVRS dans une intention curative, sans devoir accepter une détérioration de la fonction pulmonaire.
Une maladie coronarienne et une augmentation de la pression artérielle pulmonaire doivent être exclues en préopératoire, car elles sont considérées comme des contre-indications à la LVRS. Les complications pulmonaires après LVRS surviennent avec une fréquence d’environ 30% dans les 30 jours. Les complications les plus fréquentes sont la fistule aérienne prolongée, l’insuffisance respiratoire et les pneumonies. La mortalité à 90 jours publiée après LVRS est de 5%, mais ce chiffre est nettement inférieur selon notre propre expérience et se situe autour de 1%. La durée d’hospitalisation est d’environ douze jours.
Réduction du volume pulmonaire par bronchoscopie
Il existe trois méthodes de réduction du volume pulmonaire par bronchoscopie : la méthode endo ou la méthode endoscopique. valves intrabronchiques (EBV/IBV), coil de réduction de volume pulmonaire (LVRC) ou sclérose thermique du tissu pulmonaire (emphysémateux). Toutes les méthodes peuvent être appliquées à l’aide d’un bronchoscope flexible, ce qui nécessite généralement une anesthésie générale. Une sédation superficielle en respiration spontanée est également possible.
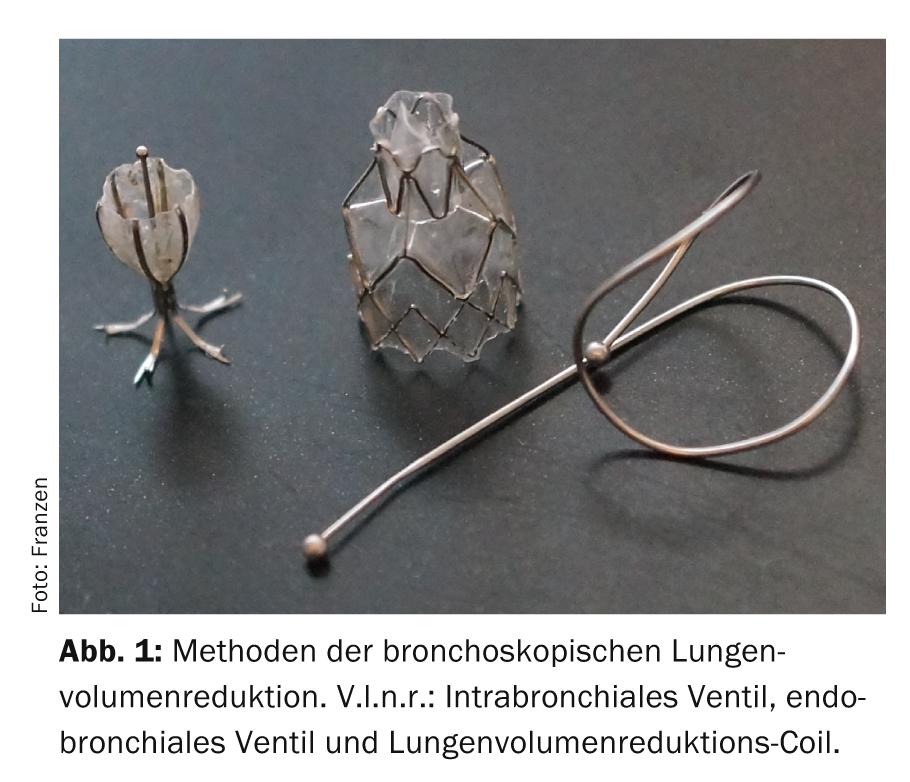
Soupapes endo- ou intrabronchiques : les soupapes sont des valves à sens unique qui permettent à l’air de sortir des zones pulmonaires emphysémateuses lors de l’expiration, mais qui l’empêchent lors de l’inspiration (Fig. 1) .
De cette manière, il y a une atélectasie de la partie du poumon traitée, ce qui entraîne une diminution de l’hyperinflation pulmonaire. Cependant, une atélectasie, et donc un effet thérapeutique perceptible, ne peut se développer que s’il n’y a pas de ventilation à partir d’une zone pulmonaire voisine via des canaux collatéraux, par exemple des pores de Kohn. Une éventuelle ventilation collatérale peut être mesurée à l’aide d’un cathéter inséré via un bronchoscope ou estimée par tomodensitométrie.
L’amélioration des symptômes et de la fonction pulmonaire après un traitement par valve peut également durer plusieurs années. (Tab.2). Il convient de noter que la mise en place de valves endobronchiques est la seule procédure entièrement réversible pour le traitement interventionnel de l’emphysème, car toutes les valves ou certaines d’entre elles peuvent être retirées au moyen d’une bronchoscopie flexible sous sédation superficielle.
En règle générale, aucun examen cardiologique n’est nécessaire avant l’intervention en cas de pose de valves. En revanche, par analogie avec la LVRS, une scintigraphie de perfusion pulmonaire et un scanner haute résolution sont indispensables.
Les complications les plus fréquentes dans les 90 jours suivant la pose de la valve sont les exacerbations de BPCO (10%) et les pneumothorax (environ 20%). Une prise en charge interdisciplinaire dans un centre est fortement conseillée, car il est parfois nécessaire de retirer une ou plusieurs valves. Les pneumothorax après la pose d’une valve sont dus aux forces de traction exercées sur le tissu pulmonaire périphérique par la formation rapide d’une atélectasie et, de fait, l’effet thérapeutique est particulièrement prononcé chez ces patients. Le taux de mortalité à 90 jours est de 1%. La durée d’hospitalisation pour la pose de la valve est en moyenne de cinq jours.
Bobines de réduction du volume pulmonaire (LVRC) : Une approche très différente est adoptée avec l’insertion de fils LVRC en alliage à mémoire de forme nitinol, qui sont insérés étirés dans une bronche sous-segmentaire et prennent leur forme incurvée caractéristique une fois la gaine d’introduction retirée. (Fig. 1). Les forces de rappel élastiques des fils spiralés sont alors transmises au tissu pulmonaire. Cela entraîne d’une part un effet de réduction du volume ainsi qu’une amélioration des forces de rappel élastique du poumon (“elastic recoil”). Pour obtenir un effet thérapeutique notable, il faut placer environ dix LVRC par lobe pulmonaire. Actuellement, il n’existe pas encore de données d’efficacité à long terme après plus d’un an (tableau 2). L’avantage des LVRC est qu’elles peuvent être utilisées chez les patients présentant une ventilation collatérale ou une absence de zones cibles, ainsi qu’en cas d’emphysème complètement homogène. La procédure est irréversible. La complication la plus fréquente dans les 30 jours suivant le traitement par LVRC est l’hémoptysie dans 30% des cas, raison pour laquelle une anticoagulation orale ou une double antiagrégation plaquettaire ainsi qu’une augmentation significative de la pression artérielle pulmonaire sont considérées comme des contre-indications absolues à cette intervention. Aucun décès n’a été rapporté à ce jour dans les quelques études disponibles sur le LVRC.
Réduction thermique du volume pulmonaire (TLVR) : L’application bronchoscopique d’énergie thermique sous forme de vapeur d’eau entraîne une fibrose et une atélectasie via une réaction inflammatoire. La complication la plus fréquente après l’application de vapeur est une exacerbation de la BPCO (20%) ou un syndrome inflammatoire généralisé (SIRS). Le succès du traitement ne dépend pas du degré d’hétérogénéité de l’emphysème ou de l’intégrité de la fissure (tab. 2). Toutefois, cette procédure est également irréversible.
Sélection de la méthode thérapeutique appropriée
La LVRS est la plus efficace en termes d’amélioration de la fonction pulmonaire et de la symptomatologie. En outre, les meilleurs résultats à long terme et les données sur l’amélioration de la survie sont actuellement disponibles pour la LVRS. Néanmoins, les procédures de réduction du volume pulmonaire par bronchoscopie ont un rôle important à jouer dans le traitement moderne de l’emphysème. D’une part, la morbidité et la mortalité péri-interventionnelles semblent être inférieures à celles de la LVRS, de sorte que les patients multimorbides et marginaux en termes de fonction pulmonaire bénéficient de ces procédures. Les patients dont la capacité de diffusion ou d’une seconde est fortement réduite ne peuvent plus être opérés, mais une procédure bronchoscopique est souvent encore envisageable. Le séjour à l’hôpital est généralement plus court pour les patients traités par endoscopie. L’effet des différentes procédures bronchoscopiques a été confirmé récemment dans une méta-analyse.
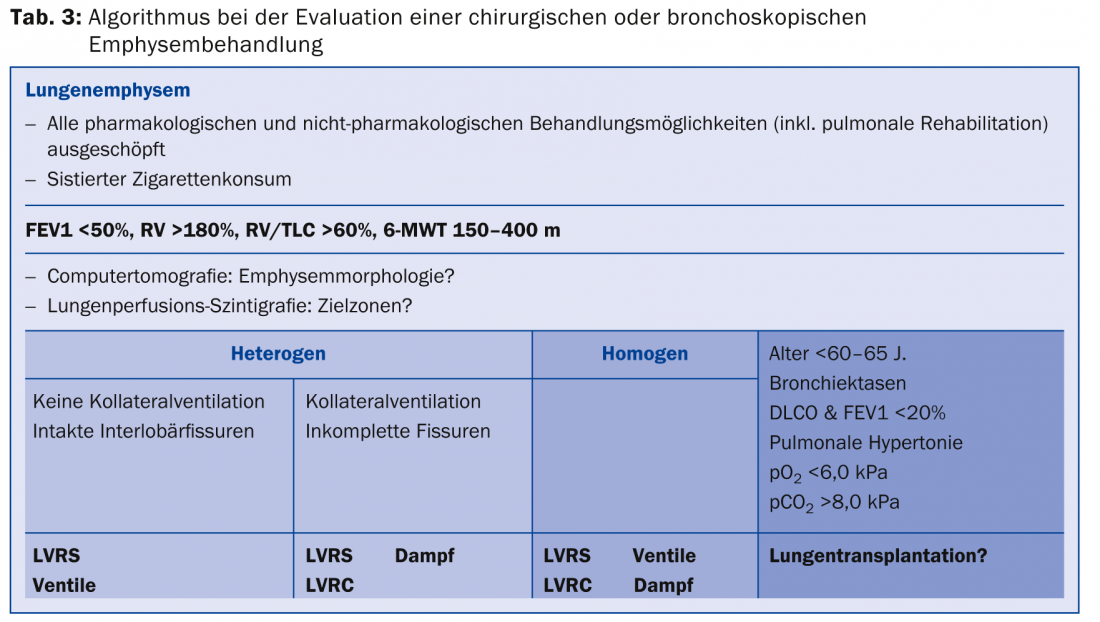
Lors du choix de la méthode thérapeutique appropriée pour le traitement interventionnel de l’emphysème, il est essentiel de prendre en compte non seulement les aspects fonctionnels et cliniques de l’emphysème, la morphologie de l’emphysème, une éventuelle ventilation collatérale, mais aussi le souhait du patient. Les possibilités sont plus grandes en raison de la multiplicité des procédures, mais les décisions deviennent ainsi plus difficiles. C’est pourquoi chaque patient évalué pour un traitement interventionnel de l’emphysème doit être discuté au sein d’un comité interdisciplinaire composé de pneumologues, de chirurgiens thoraciques et de radiologues afin de déterminer la procédure la plus adaptée à chaque cas. En ce sens, les procédures de réduction du volume pulmonaire par chirurgie et par bronchoscopie ne sont pas des méthodes concurrentes, mais plutôt complémentaires, et peuvent même être partiellement combinées. A cet égard, le diagramme présenté dans le tableau 3 peut fournir une aide à la prise de décision concernant la procédure appropriée pour le traitement de l’emphysème.
Littérature complémentaire :
- Fishman A, et al : A randomized trial comparing lung-volume-reduction surgery with medical therapy for severe emphysema. N Engl J Med 2003 ; 348 : 2059-2073.
- Weder W, et al : Bénéfice persistant de la chirurgie de réduction de volume pulmonaire chez les patients atteints d’emphysème homogène. Ann Thorac Surg 2009 ; 87 : 229-236.
- Shah PL, Herth FJ : Statut actuel de la réduction de volume pulmonaire par bronchoscopie avec des valves endobronchiques. Thorax 2014 ; 69 : 280-286.
- Tutic M, et al : La chirurgie de réduction du volume pulmonaire comme procédure alternative ou de pontage à la transplantation pulmonaire. Ann Thorac Surg 2006 ; 82 : 208-213.
- Hamacher J, et al : Improved quality of life after lung volume reduction surgery. Eur Respir J 2002 ; 19 : 54-60.
- Choong CK, et al : Résection concomitante du cancer du poumon et chirurgie de réduction du volume pulmonaire. Thorac Surg Clin 2009 ; 19 : 209-216.
- Venuta F, et al : Suivi à long terme après réduction du volume pulmonaire par bronchoscopie chez les patients atteints d’emphysème.
- Eur Respir J 2012 ; 39 : 1084-1089.
- Deslee G, et al : Lung volume reduction coil treatment for patients with severe emphysema : a European multicentre trial. Thorax 2014 Nov ; 69(11) : 980-986.
- Herth FJ, et al : Characterization of outcomes 1 year after endoscopic thermal vapor ablation for patients with heterogeneous emphysema. Int J Chron Obstruct Pulmon Dis 2012 ; 7 : 397-405.
- Iftikhar IH, McGuire FR, Musani AI : Efficacité de la réduction de volume pulmonaire par bronchoscopie : une méta-analyse. Int J Chron Obstruct Pulmon Dis 2014 ; 9 : 481-491.
- Rathinam S, et al : Le rôle de l’équipe multidisciplinaire de l’emphysème dans un programme réussi de réduction de volume pulmonaire. Eur J Cardiothorac Surg 2014 Dec ; 46(6) : 1021-1026 ; discussion 1026.
PRATIQUE DU MÉDECIN DE FAMILLE 2015 ; 10(3) : 20-24