Le carcinome basocellulaire (CBC) est le cancer le plus répandu dans le monde. Différents facteurs et caractéristiques de la tumeur influencent le risque de récidive, raison pour laquelle les CCB sont classés en CCB à haut risque et CCB à faible risque. Lors d’un traitement, l’objectif est d’éliminer complètement la tumeur avec un résultat cosmétiquement satisfaisant. L’étalon-or thérapeutique reste l’excision chirurgicale. Cependant, les traitements topiques (par ex. l’imiquimod), la thérapie photodynamique et la radiothérapie ont également été introduits pour les CCB à faible risque. Pour les CBC invasifs et métastatiques de très grande taille, il existe désormais un traitement systémique, le vismodégib, qui est autorisé en Suisse depuis 2013.
Aux États-Unis, le risque pour un homme caucasien de développer un carcinome basocellulaire (CBC) au cours de sa vie est d’environ 30% [1]. En Suisse, dans les cantons de Neuchatel et de Vaud, l’incidence en 2003 dans le groupe d’âge 70-79 ans était de 200/100 000 habitants [2]. En réalité, le chiffre est probablement plus élevé, car le BCC n’est pas soumis à déclaration et le recensement est donc incomplet. De plus, dans la pratique, les CBC sont souvent retirés par des procédures qui ne permettent pas une confirmation histologique.
Définition du carcinome basocellulaire
Le BCC est une tumeur de la peau qui évolue généralement très lentement. La croissance est souvent tridimensionnelle et ne provoque dans presque tous les cas qu’une destruction tissulaire locale. En raison du taux extrêmement faible de métastases (<0,003-0,1%), on parle également de tumeur semi-maligne [3]. Il provient probablement de cellules précurseurs situées à différents niveaux du follicule pileux, dont le plus fréquent est la gaine de la racine du cheveu. On pense qu’il s’agit d’une origine monoclonale, comme en témoigne le fait que différents types de BCC peuvent se développer malgré la même localisation. On trouve presque toujours BCC dans les zones du corps exposées au soleil. Environ 80% des patients ont des BCC entre la commissure des lèvres et la base de l’oreille (la “zone du masque”), dont 30% sur le nez, ce qui est le plus fréquent (fig. 1 et 2). L’ordre des localisations les plus fréquentes est le nez > le tronc > le tiers inférieur du visage > les capillaires et le reste de la peau.
Risque et causes
Le patient typique atteint de BCC est caucasien, âgé de plus de 60 ans et de sexe masculin. Les types de peau clairs sont principalement concernés (I et II selon Fitzpatrick) [4]. L’incidence du BCC est en augmentation, plus rapidement chez les femmes que chez les hommes ; on pense que cela est dû à des facteurs liés au mode de vie.
Les UV, en particulier l’exposition au soleil pendant des années, sont considérés comme la principale cause de BCC. Pour le BCC, les expositions intenses et courtes aux UVB dans la gamme 290-320 nm semblent avoir la plus grande influence. Par conséquent, les sources artificielles d’irradiation (solariums, photothérapie, etc.) peuvent également être contraignantes. On estime que l’immunosuppression augmente d’un facteur 10 le risque de développer un BCC [5]. Les radiations ionisantes, par exemple la radiothérapie et surtout les irradiations fréquentes, favorisent également l’apparition de BCC. Une exposition à l’arsenic peut également entraîner un BCC à long terme.
Il existe également des maladies héréditaires très rares qui s’accompagnent d’un nombre accru de BCC. L’un d’entre eux est le syndrome de Gorlin-Goltz (“Naevoid Basal Cell Carcinoma Syndrome”, NBCCS). Il s’agit d’une maladie héréditaire autosomique dominante dans laquelle le récepteur patché est muté. Patched fait partie de la voie Hedgehog(Hh) et supprime Smoothened (SMO). Si l’inhibition de SMO disparaît, une surexpression de la voie Hh se produit. Une telle surexpression est également observée dans les CBC de patients qui ne souffrent pas d’un NBCCS et est donc presque toujours considérée comme une condition préalable au développement du CBC [6].
Sous-types de carcinomes basocellulaires
Plus de 26 types différents de BCC ont été décrits. Les plus fréquents sont les suivants :
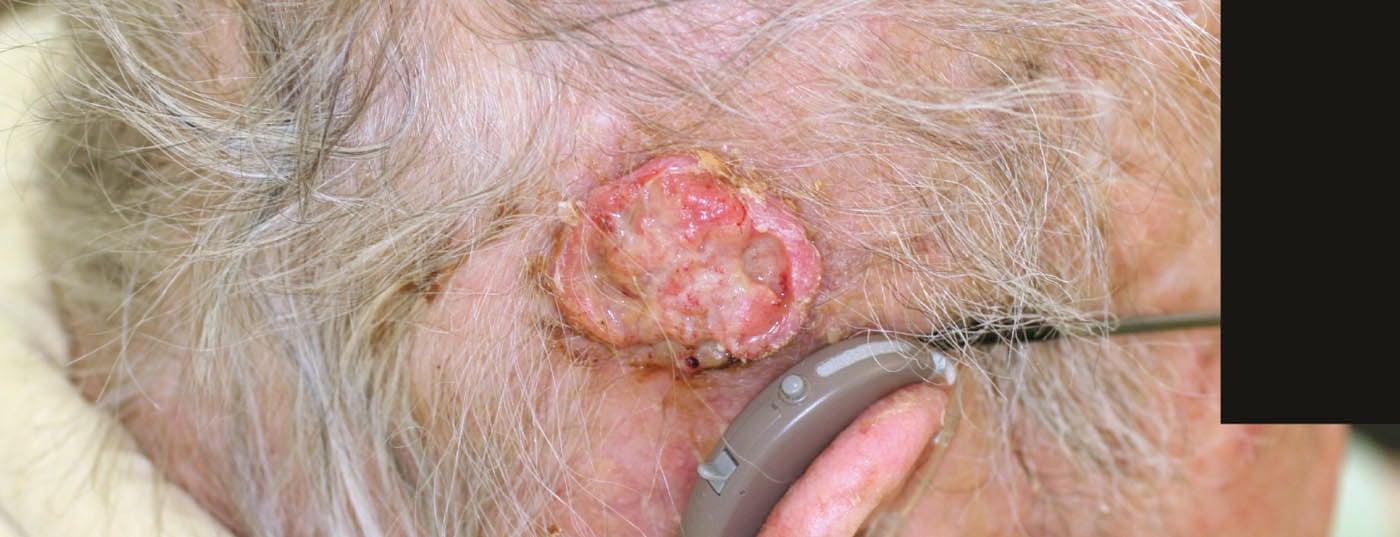
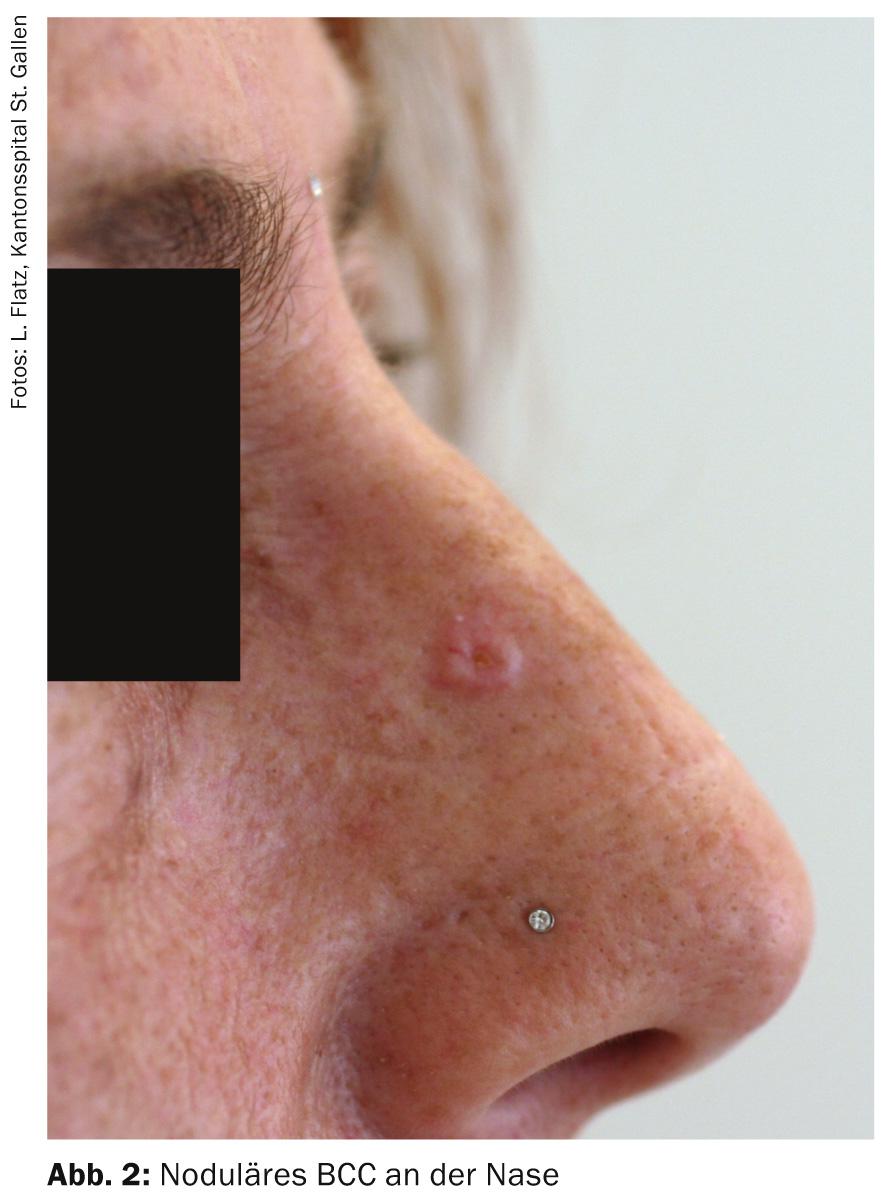
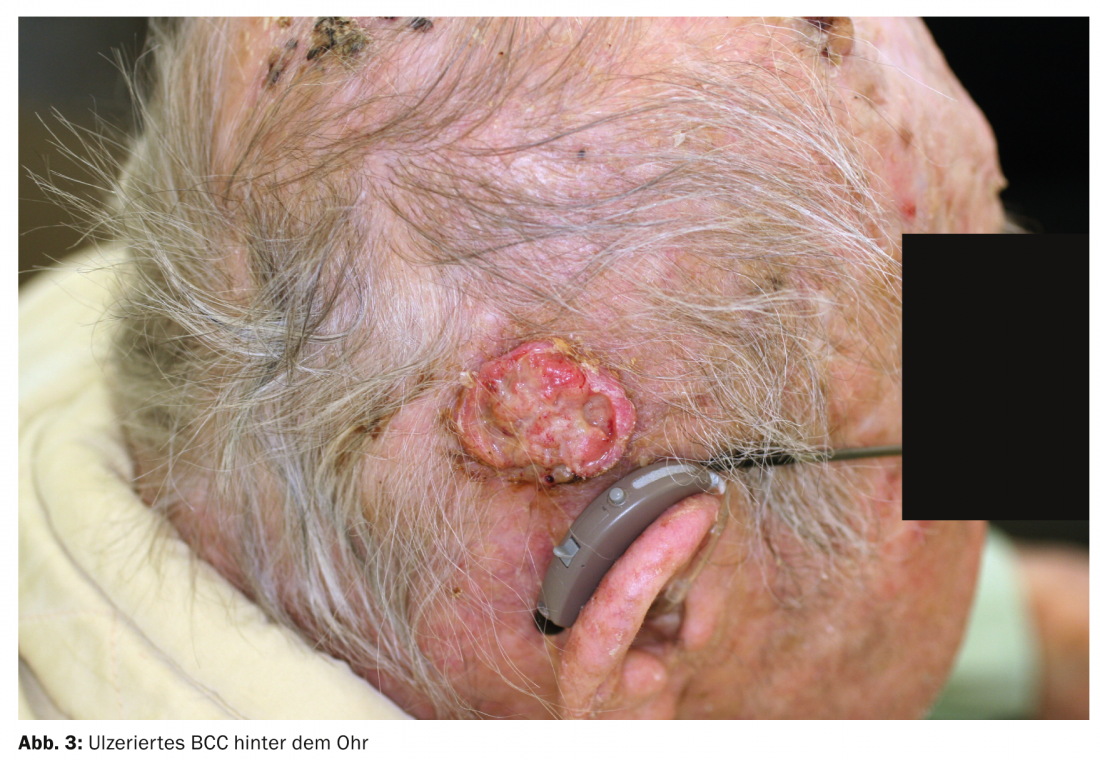
- BCC nodulaire (BCC solide, nBCC) : Cette sous-forme, la plus fréquente, représente environ 50% de tous les BCC. La tumeur en forme de dôme, bien délimitée cliniquement, se caractérise par une bordure perlée et soulevée, parsemée de télangiectasies. Une dépression centrale est souvent visible ; si elle est ulcérée, on parle de basalioma exulcerans (fig. 3). Les diagnostics différentiels sont, entre autres, une hyperplasie des glandes sébacées, des tumeurs annexes, des nevus dermiques ou des kératoacanthomes. Les foyers profonds peuvent s’étendre jusqu’au cartilage ou à l’os et entraînent une morbidité accrue en raison de dommages parfois importants (par exemple, destruction de l’œil).
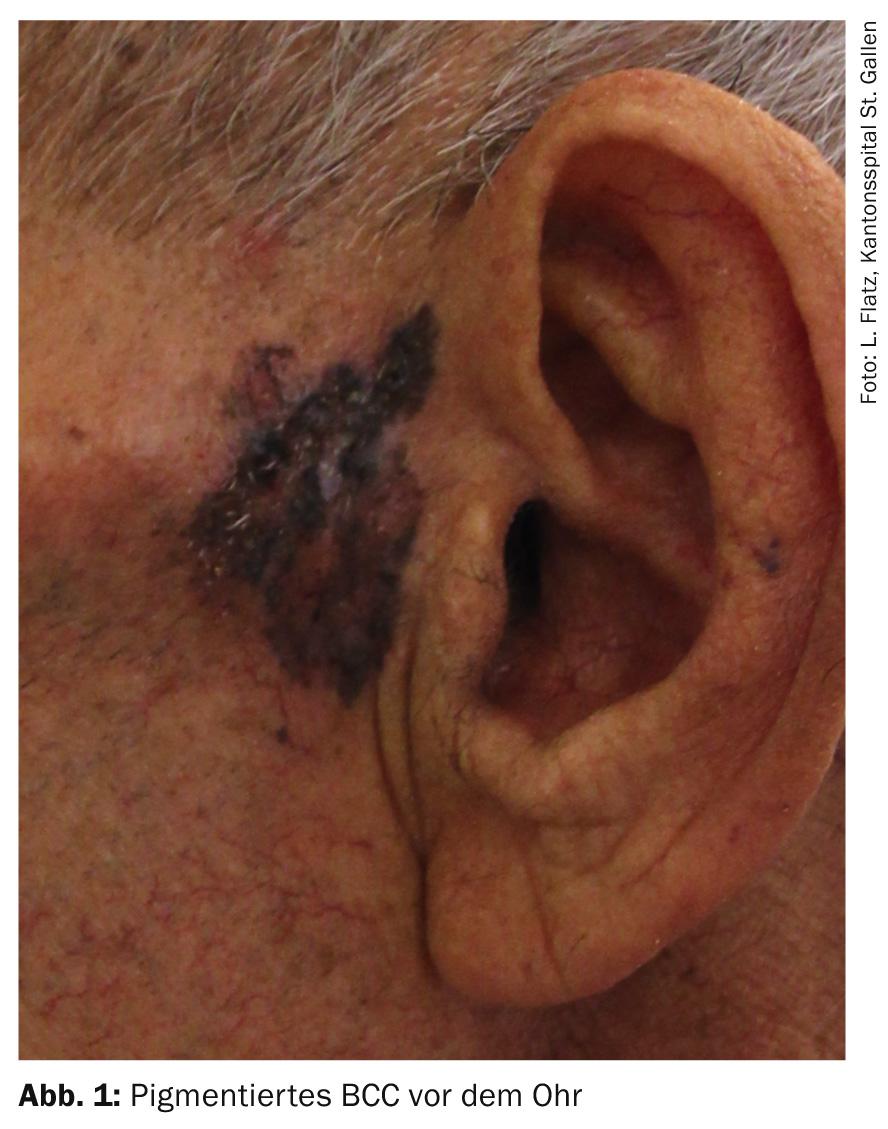
- BCC pigmenté : cette sous-forme de BCC nodulaire peut être confondue avec un mélanome ulcérant d’une part, et avec des hémangiomes, des naevus mélanocytaires ou des kératoses séborrhéiques d’autre part (si elles sont de petite taille) en raison de leur aspect sombre. Les télangiectasies sont souvent masquées par le pigment, ce qui rend le diagnostic clinique difficile.
- BCC sclérodermiforme (sBCC) : en surface, le sBCC se présente comme une plaque atrophique, légèrement rétractée, de sorte qu’il peut être confondu avec une morphée. En sous-cutané, le sBCC s’étend en nappe dans des formations tumorales ramifiées, dont les limites ne sont pas cliniquement identifiables. Sur le plan chirurgical, il faut choisir une distance de résection plus élevée et, idéalement, il faut soit une “Mohs Micrographic Surgery”, soit une opération en deux temps (“Slow-Mohs”).
- BCC superficial (suBCC) : Le suBCC se caractérise par une diffusion très superficielle et multicentrique. Il est fréquent que des zones de peau saine se trouvent entre les nids de tumeurs. Typiquement, il n’y a pas d’ulcération. La clinique peut évoquer un eczéma nummulaire. En raison de la faible profondeur de pénétration, les suBCC sont souvent faciles à traiter avec un traitement topique (par ex. imiquimod).
- BCC métatypique : le BCC métatypique est une forme mixte de BCC et de carcinome épidermoïde, mais il ne peut être identifié qu’histologiquement. Cliniquement, le BCC métatypique ressemble au nBCC. Il est toutefois significatif que la croissance soit plus agressive.
- BCC métastatique : les métastases sont extrêmement rares dans le cas du BCC. Elle est particulièrement fréquente dans les CBC de grande taille et profondément ulcérés et se produit à la fois par voie lymphogène et hématogène, de préférence dans les poumons et les os.
Diagnostic, niveaux de risque et options thérapeutiques
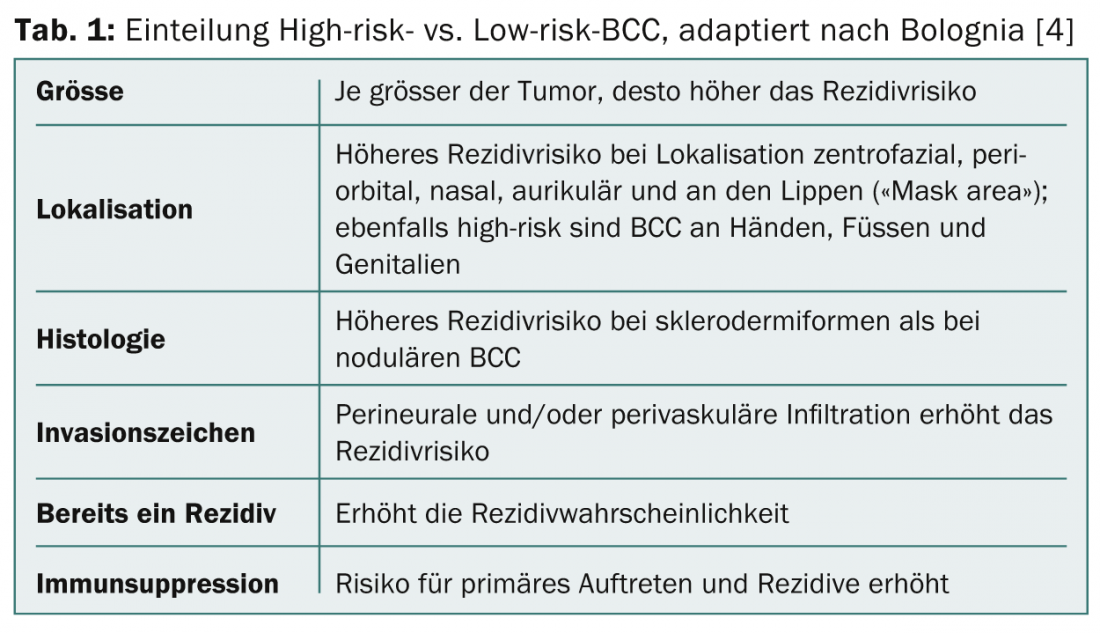
En cas de suspicion de BCC (antécédents, localisation, progression), une biopsie d’échantillon doit être prélevée, car c’est le seul moyen de confirmer les diagnostics, d’identifier le type de BCC et d’évaluer la profondeur de la tumeur. Différents facteurs et caractéristiques de la tumeur influencent le risque de récidive (tab. 1). En évaluant ces facteurs, les tumeurs sont classées en CCB à haut risque et CCB à faible risque.
Il existe actuellement différentes options de traitement chirurgical et non chirurgical (Fig. 4). En cas de traitement, il existe deux objectifs principaux : l’ablation complète de la tumeur et un résultat cosmétiquement acceptable. Pour les CCB à faible et à haut risque, l’excision chirurgicale avec contrôle histologique de l’incision est le traitement de choix. Il existe de bonnes alternatives pour les CCB à faible risque, mais le meilleur résultat à long terme est également obtenu avec l’excision chirurgicale.
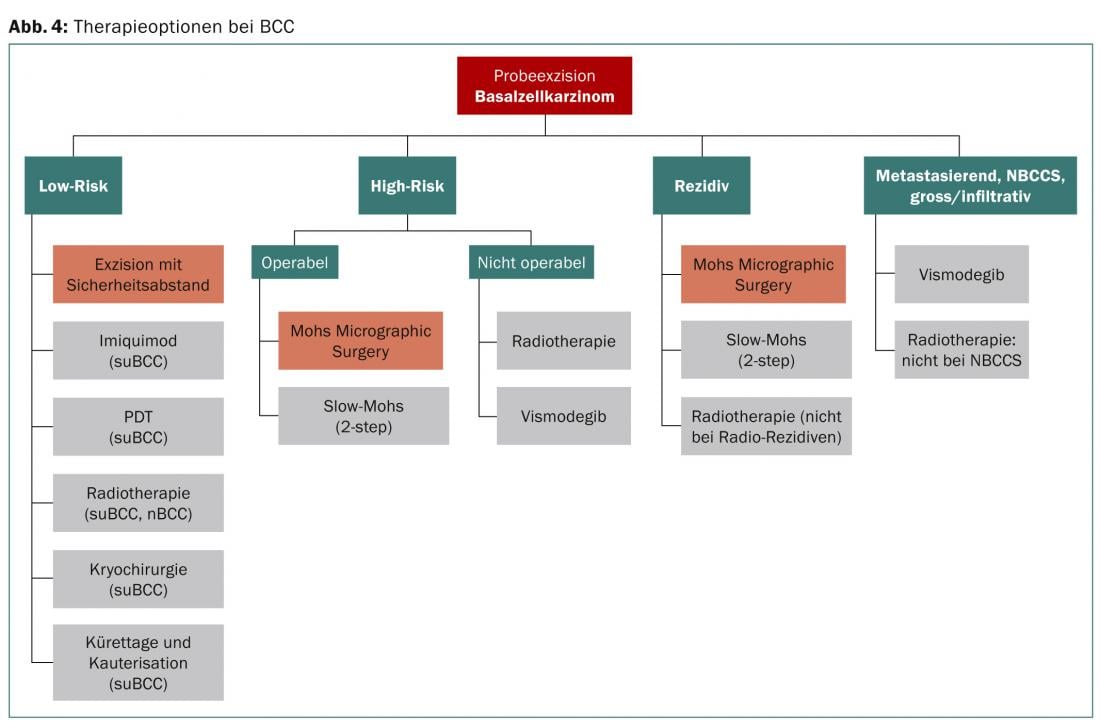
Méthodes thérapeutiques chirurgicales
Excision chirurgicale avec marge de sécurité : le gold standard pour le traitement des CCB à faible risque est l’excision avec marge de sécurité. La taille de cette dernière dépend du type de tumeur et de sa localisation (tableau 2). Pour un CBC bien circonscrit <20 mm, on estime que la probabilité de tumeur résiduelle est de 15% à une distance de 3 mm et de 5% à une distance de 4-5 mm [7,8].

Mohs Micrographic Surgery (MMS) : cette technique, développée par le Dr. La technique mise au point par Mohs permet de réaliser et d’évaluer des coupes congelées en peropératoire. Les cellules tumorales résiduelles peuvent ainsi être détectées sur les bords de la coupe et immédiatement éliminées. Le chirurgien peut procéder à une ablation dans n’importe quelle dimension jusqu’à ce que plus aucune cellule tumorale ne soit détectée. Les taux de rémission à 5 ans de 99% pour les CBC primaires et de 95% pour les récidives après excision font de cette méthode le gold standard pour les CBC à haut risque [8]. La méthode requiert une formation spécialisée du chirurgien ainsi qu’un haut niveau d’expérience. Alternativement, la coupe congelée peut être évaluée par un pathologiste.
Opération en deux temps (mohs lents) : Dans le cas de la chirurgie en deux temps, une excision primaire est d’abord réalisée avec une marge de sécurité sans fermeture, après quoi la préparation est évaluée par des pathologistes. Si la tumeur a été entièrement retirée, l’opération suivante consiste à traiter définitivement la plaie, par exemple par fermeture directe ou plastie par lambeau. Si l’excision n’était pas in toto, une nouvelle résection est effectuée avec contrôle histologique. La MMS est généralement préférable, car les bords de l’incision restent proches de l’extrémité de la tumeur et les plus grandes distances de sécurité sont supprimées, ce qui signifie un plus beau résultat cosmétique. En cas d’opération en deux temps, les intervalles doivent être plus généreux. Pour les BCC à haut risque, il est recommandé d’utiliser jusqu’à 1 cm, ce qui n’est toutefois souvent pas pratique, en particulier dans la zone du masque sur le visage (p. ex. sur la paupière inférieure). Dans ce cas, le chirurgien doit évaluer individuellement les avantages et les risques.
BCC non excisés in toto : dans deux études portant sur des BCC histologiquement confirmés et non excisés in toto, le post-rectum a montré que des cellules tumorales BCC résiduelles n’étaient détectables que dans environ la moitié des cas. Les raisons ne sont pas encore claires, il est possible qu’un milieu destructeur de cellules se crée en postopératoire et détruise les cellules tumorales restantes. Le meilleur traitement en cas de récidive est la MMS, l’alternative étant une excision en deux temps avec une marge de sécurité généreuse (5-10 mm sont proposés). Dans certains cas, les tumeurs in situ ou les cellules résiduelles superficiales peuvent faire l’objet d’un traitement adjuvant par imiquimod ou par thérapie photodynamique, mais il n’existe pas encore de données à long terme à ce sujet.
Méthodes thérapeutiques ablatives et destructives sans histologie
Curetage et cautérisation : ces procédures ont une place dans le traitement des lésions périphériques à faible risque. Cependant, les méthodes combinant l’imiquimod et la thérapie photodynamique (PDT) ont donné de meilleurs résultats. Le curetage et la cautérisation ne semblent pas appropriés pour le traitement des récidives, l’absence de tumeur à 5 ans n’étant que de 60% dans une étude [9].
Cryothérapie/cryochirurgie : une option thérapeutique rapide et facile à mettre en œuvre pour les CCB à faible risque. Des taux de rémission de 85-95% ont été observés dans des essais contrôlés randomisés [10]. Les effets secondaires comprennent la douleur, l’érythème et la formation de cloques et de croûtes, des cicatrices et des atrophies sont également possibles. Pour les lésions à haut risque, la cryothérapie pourrait avoir un certain intérêt. Dans une étude, 158 CBC périorbitaires ont été traités par cryochirurgie, le taux de récidive à 5 ans de suivi était de 7,6% [11].
Traitement topique par imiquimod (Aldara®) et ingenolmebutate (Picato®) : Le traitement par imiquimod est actuellement autorisé pour le BCC de type superficial. Une réaction cutanée plus importante (érosions, ulcérations) donne de meilleurs résultats, mais a un impact négatif sur l’observance, raison pour laquelle un régime de 5×/semaine pendant six semaines est recommandé par la British Association of Dermatologists (BAD) pour le suBCC [8]. L’occlusion de la zone thérapeutique ne semble pas apporter d’avantage. Il n’existe pas d’autorisation de mise sur le marché en Suisse pour le traitement du nBCC.
L’ingenolmebutate est autorisé en Suisse depuis 2013 pour le traitement des kératoses actiniques. Le traitement réussi du suBCC a été décrit [12], mais il n’existe pas d’autorisation de mise sur le marché pour cette indication en Suisse.
Thérapie photodynamique (PDT) avec l’acide 5-aminolévulinique (ALA) ou le méthyl-aminolévulinate (MAL) : la PDT est une option pour les patients souffrant de suBCC ou de nBCC étendus et difficiles à opérer. Pour le suBCC, le taux de rémission à 3 ans est estimé à 69-85% ; pour le nBCC, le taux de rémission à 5 ans de suivi est de 70-82%. Pour les nBCC, si la tumeur a une épaisseur de >2 mm, il faut d’abord procéder à un débullage. Pour le suBCC, l’ALA et le MAL peuvent tous deux être utilisés. Pour le nBCC, le MAL est préférable car il pénètre plus profondément dans la peau [13].
Radiothérapie : la radiothérapie a toujours sa place chez les patients âgés qui ne peuvent pas être opérés ou qui sont difficiles à opérer. Dans ce cas, la radiothérapie peut être bien utilisée pour les CCB à faible risque et, sous certaines conditions, pour les CCB à haut risque et les récidives. La radiothérapie est également appropriée en tant que traitement néoadjuvant et adjuvant. Le taux de rémission à 4 ans est de 80% dans de nombreuses études >.
Comme effet secondaire, il faut surtout mentionner la radionécrose, à laquelle certaines zones comme l’arête du nez sont prédestinées. Les autres effets secondaires sont des troubles de la pigmentation, des télangiectasies et des radiodermites. Les excisions chirurgicales ont un meilleur résultat cosmétique. Dans le cas du NBCCS et du xeroderma pigmentosum, la radiothérapie est contre-indiquée car les dommages causés par les radiations peuvent entraîner la formation de nouveaux BCC [10,14]. Il ne faut pas non plus irradier à nouveau la récidive d’un CBC radiothérapé [8].
Vismodegib (Erivedge®) : Dans le NBCCS, une mutation entraîne une régulation élevée et permanente de la voie Hh. Le vismodégib est un inhibiteur de SMO-1 et inhibe ainsi la voie Hh. Depuis 2013, le vismodégib est autorisé en Suisse pour le traitement des CBC avancés, localement invasifs et métastatiques, pour lesquels d’autres options thérapeutiques (exérèse, radiothérapie, etc.) présenteraient des inconvénients majeurs pour le patient. Les effets secondaires comprennent des spasmes musculaires, une dysgueusie, une perte de cheveux, de la fatigue, des nausées et une hyponatrémie. Malheureusement, des résistances apparaissent déjà [15]; chez les patients concernés, le SMO était modifié différemment selon l’endroit de la biopsie. Les options thérapeutiques futures ciblant la voie Hh pourraient inclure l’itraconazole et la vitamine D3, qui ont un effet inhibiteur sur SMO.
Suivi des patients
Le risque de développer un second BCC est plus élevé après un BCC primaire. Le risque de développer d’autres BCC augmente avec le nombre de BCC et l’âge. Dans le canton de Vaud, le risque cumulé d’un deuxième CCB est estimé à 20% après 10 ans et à 40% après 20 ans [2]. Les recommandations suivantes sont utiles pour le suivi :
- Autocontrôles étroits du patient. Cela nécessite une information et des instructions détaillées de la part du médecin.
- Protection solaire systématique avec un facteur SPF 30 minimum.
- C’est au cours des trois premières années suivant le diagnostic que le risque d’un second CCB est le plus élevé [16]. Les directives actuelles en Allemagne (03/2012) recommandent des contrôles annuels pour les trois premières années [8].
Conclusion pour la pratique
- Le BCC est le cancer le plus fréquent. Avant le traitement, une classification en CCB à haut risque et CCB à faible risque est effectuée.
- En cas de suspicion, une excision d’échantillon est réalisée pour confirmer le diagnostic.
- L’excision chirurgicale est la meilleure méthode de traitement pour les CCB à haut et à bas risque. Les thérapies non invasives peuvent être envisagées pour les CCB à faible risque lorsque les circonstances sont défavorables à la chirurgie.
- Si un BCC survient chez un très jeune patient, il convient d’exclure un NBCCS.
- En raison du risque accru de second CCB, les patients doivent être suivis annuellement pendant au moins trois ans.
Dr. Omar Hasan Ali
Dr. med. Josef Aschwanden
Dr. med. Lukas Flatz
Littérature :
- Wong CS, et al : Carcinome basocellulaire. BMJ 2003 ; 327(7418) : 794-798.
- Levi F, et al : Forte incidence des cancers de la peau de la deuxième cellule basale. International journal of cancer 2006 ; 119(6) : 1505-1507.
- Reifenberger J : Carcinome basocellulaire. In : Plewig G, editor. La dermatologie, la vénérologie et l’allergologie de Braun-Falco. Berlin : Springer ; 2012.
- Soyer HP, et al : Kératose actinique, carcinome basocellulaire et carcinome spinocellulaire. In : Bolognia J, Jorizzo JL, Schaffer JV, editors. Dermatology. [Philadelphia]: Elsevier Saunders ; 2012.
- Hartevelt MM, et al : Incidence du cancer de la peau après une transplantation rénale aux Pays-Bas. Transplantation 1990 ; 49(3) : 506-509.
- Kasper M, et al : Carcinome basocellulaire – biologie moléculaire et nouvelles thérapies potentielles. The Journal of clinical investigation 2012 ; 122(2) : 455-463.
- Hauschild A, et al : Brief S2k guidelines–Carcinome basocellulaire de la peau. Journal of the German Society of Dermatology 2013 ; 11 Suppl 3 : 10-15, 1-6.
- Telfer NR, et al : Guidelines for the management of basal cell carcinoma. The British journal of dermatology 2008 ; 159(1) : 35-48.
- Rowe DE, et al : La chirurgie de Mohs est le traitement de choix pour les carcinomes basocellulaires récurrents (précédemment traités). The Journal of dermatologic surgery and oncology 1989 ; 15(4) : 424-431.
- Berking C, et al : Carcinome basocellulaire-traitements pour le cancer de la peau le plus courant. Deutsches Ärzteblatt international 2014 ; 111(22) : 389-395.
- Tuppurainen K : Cryothérapie pour les carcinomes basaux des paupières et périoculaires : résultats dans 166 cas sur une période de 8 ans. Graefe’s archive for clinical and experimental ophthalmology 1995 ; 233(4) : 205-208.
- Siller G, et al : PEP005 (ingenol mebutate) gel for the topical treatment of superficial basal cell carcinoma : results of a randomized phase IIa trial. The Australasian journal of dermatology 2010 ; 51(2) : 99-105.
- Braathen LR, et al : Guidelines on the use of photodynamic therapy for nonmelanoma skin cancer : an international consensus. J of the American Academy of Dermatology 2007 ; 56(1) : 125-143.
- Kimonis VE, et al : Manifestations cliniques chez 105 personnes atteintes du syndrome du carcinome basocellulaire névrotique. American journal of medical genetics 1997 ; 69(3) : 299-308.
- Brinkhuizen T, et al : Acquired resistance to the Hedgehog pathway inhibitor vismodegib due to smoothened mutations in treatment of locally advanced basal cell carcinoma. J Am Acad Dermatol 2014. pii : S0190-9622(14) : 1792-1797.
- Marcil I, et al : Risk of developing a subsequent nonmelanoma skin cancer in patients with an history of nonmelanoma skin cancer : a critical review of the literature and meta-analysis. Archives of dermatology 2000 ; 136(12) : 1524-1530.
InFo ONKOLOGIE & HÉMATOLOGIE 2014 ; 2(9) : 8-13