La classification d’une maladie rénale chronique (MRC) se fait en fonction du type de maladie sous-jacente, du taux de filtration et de l’importance de la protéinurie. Les patients atteints de MRC sont des patients à risque cardiovasculaire. La morbidité cardiovasculaire augmente avec l’augmentation de la protéinurie et la baisse du taux de filtration. La base thérapeutique pour ralentir la progression de l’insuffisance rénale reste le traitement antiprotéinurique par inhibition du SRA. Concernant l’hypertension artérielle et réno-vasculaire : il est tendanciellement déconseillé de contrôler la pression artérielle de manière trop intensive. L’hypertension rénovasculaire est la cause la plus fréquente d’hypertension secondaire chez les patients de plus de 50 ans souffrant d’hypertension résistante et est associée à une mortalité cardiovasculaire plus élevée et à une perte plus rapide de la fonction rénale. La dénervation rénale ne doit pas être utilisée comme méthode standard de traitement des patients souffrant d’hypertension “résistante au traitement”.
La première partie de cet article est centrée sur l’insuffisance rénale chronique. Comment se déroule le diagnostic et que peut-on dire du risque de progression ?
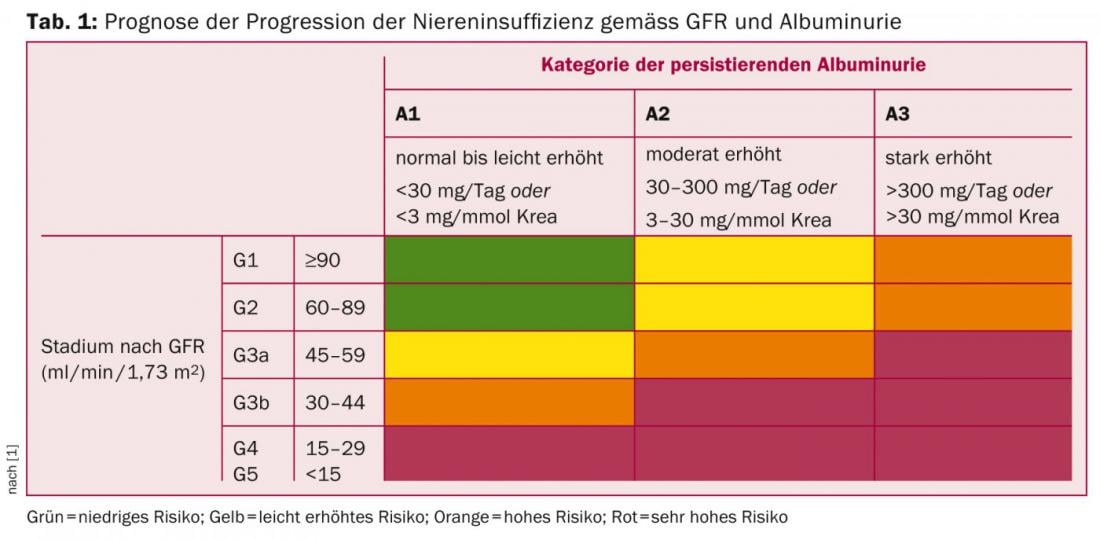
Selon les directives 2012 du KDIGO [1], la maladie rénale chronique (MRC) est définie par un débit de filtration (eGFR) ≤60 ml/min/1,73 m2 ou par des signes d’atteinte rénale (dans les urines, le sérum ou par imagerie) pendant trois mois. Il faut s’efforcer de classer l’IRC en fonction du type de maladie sous-jacente, du taux de filtration et de l’importance de la protéinurie [1], car ces paramètres sont pertinents non seulement pour la progression (tableau 1), mais aussi pour l’estimation de la morbidité et de la mortalité cardiovasculaires.
L’estimation de l’eGFR doit se faire au quotidien par la formule 2009-CKD-EPI [1]. Cystatine C avec la créatinine sérique pour la détermination de l’eGFR (formule 2012-CKD-EPI créatinine-cystatine C) doit être utilisée dans des situations spécifiques [2]. Cela est particulièrement vrai lorsque la créatinine sérique n’est pas corrélée au DFGe (par exemple, perte de muscle, cirrhose du foie, grossesse, prise de triméthoprine) et lorsqu’il n’existe aucune autre preuve de maladie rénale, à l’exception d’un DFG abaissé estimé par la créatinine sérique [1]. Les deux formules sont disponibles sur Internet à l’adresse www.mdrd.com.
La présence d’une microalbuminurie est un facteur de risque cardiovasculaire indépendant [3], mais elle n’est pas toujours associée à une progression de la maladie rénale, car la microalbuminurie peut être régressive au cours de l’évolution [4]. La baisse du taux de filtration chez les patients âgés jusqu’à l’IRC 3a (eGFR 45 ml/min/1,73 m2) peut être considérée comme un processus de vieillissement normal si l’eGFR est stable et en l’absence de protéinurie [1].
Complications cardiovasculaires (prévention)
Les patients atteints d’IRC sont des patients à risque cardiovasculaire. La morbidité cardiovasculaire augmente avec l’augmentation de la protéinurie et la baisse du taux de filtration. L’effet semble être additif [5]. Les facteurs de risque peuvent être classés en traditionnels (âge, cholestérol LDL, hypertension, sexe, etc.) et non traditionnels (albuminurie, anémie, charge volumique, troubles de l’équilibre minéral et osseux). Les nouvelles directives KDIGO recommandent, après une mesure unique du cholestérol chez les patients de plus de 50 ans non dialysés, une réduction modérée du cholestérol LDL avec une dose fixe de statine sans autre contrôle du profil lipidique selon la stratégie “fire and forget” [6]. Chez les patients de moins de 50 ans, un traitement médicamenteux n’est recommandé qu’en présence d’une maladie coronarienne, d’un diabète sucré, d’un accident vasculaire cérébral ou d’un risque calculé sur dix ans d’événements coronariens >10%. Dans ce cas, les valeurs cibles de la maladie sous-jacente s’appliquent [6].
Ralentissement de la progression de l’insuffisance rénale
Le traitement antiprotéinurique par inhibition du système rénine-angiotensine-aldostérone (RAS) reste à ce jour la pierre angulaire du ralentissement de la progression de l’insuffisance rénale. Depuis que l’on dispose de plus d’une classe de substances pour inhiber le SRA, on étudie dans quelle mesure un double blocage du SRA présente des avantages en termes de mortalité cardiovasculaire et de progression de l’insuffisance rénale.
L’étude ONTARGET est à ce jour la plus grande étude ayant évalué l’association d’un IEC et d’un sartan contre un IEC seul ou un sartan seul chez des patients à haut risque. Le traitement combiné n’a pas montré de bénéfice en termes de mortalité cardiovasculaire. En ce qui concerne les critères d’évaluation rénaux, le traitement combiné a même montré un moins bon résultat [7]. Un inconvénient majeur d’ONTARGET était que peu de patients atteints de protéinurie étaient inclus. Dans ce domaine, l’étude ALTITUDE [8] (association de l’inhibiteur de la rénine aliskiren avec l’IEC ou l’ARA) et plus récemment l’étude NEPHRON-D [9] (association de losartan avec le lisinopril vs losartan seul) ont montré chez des patients atteints de diabète de type 2 et de protéinurie que les effets secondaires graves (hyperkaliémie, insuffisance rénale aiguë) étaient plus fréquents sous traitement combiné, ce qui a conduit à l’arrêt prématuré des études. Le double blocage du RAS n’est plus recommandé chez les patients atteints de diabète et de protéinurie. On ne sait toujours pas si les patients atteints de néphropathie protéinurique due à une glomérulonéphrite bénéficient d’un double blocage du RAS.
Bilan calcium-phosphate et perturbation de l’équilibre minéral-osseux
La physiopathologie des troubles de l’équilibre minéral et osseux est classiquement perçue comme entraînant le développement d’une hyperparathyroïdie secondaire due à la carence progressive en calcitriol et à la rétention de phosphate. De nouvelles découvertes sur le système FGF-23/Klotho ont modifié cette perception.
Dès les premiers stades, on observe une augmentation du FGF-23, qui inhibe simultanément la synthèse du calcitriol et de la parathormone [10]. Il est possible que le FGF-23 régule un bilan phosphate positif invisible dans le sérum aux premiers stades de l’insuffisance rénale. Parallèlement, le FGF-23 sert à maintenir la stabilité du bilan calcique. Au fur et à mesure que la perte de performance rénale se poursuit, l’effet du co-récepteur Klotho du FGF-23 diminue. La parathormone et le FGF-23 augmentent alors en parallèle. Cependant, la physiopathologie exacte reste encore incertaine.
Selon les directives de la KDIGO, des valeurs normales de phosphate et d’hormone parathyroïdienne dans le sérum doivent être recherchées chez les patients non dialysés [11]. L’utilisation des adsorbants de phosphate chez les patients non dialysés souffrant d’insuffisance rénale avancée a été récemment remise en question [12,13]. Sur la base des données susmentionnées, la réduction la plus précoce possible de l’apport en phosphate devrait être une priorité dans la pratique clinique quotidienne – l’importance des conseils nutritionnels visant à réduire le phosphate ne cesse de croître [1]. Cependant, il faut éviter d’obtenir une réduction du phosphate par la restriction protéique et la malnutrition [1]. En cas de carence en vitamine D (25[OH]vitamine D <50 nmol/l), ce qui est souvent le cas chez les patients atteints d’IRC [14], une substitution est recommandée.
Hypertension artérielle et réno-vasculaire
La deuxième partie de cet article est consacrée à l’hypertension artérielle et réno-vasculaire : quelles sont les valeurs cibles actuelles de pression artérielle ? Et quelles sont les nouveautés dans ce domaine ?
Les directives concernant le traitement de l’hypertension artérielle ont changé au cours des dernières années. En 2012, les directives KDIGO ont été publiées. Elles traitent spécifiquement du contrôle de la pression artérielle chez les patients non dialysés souffrant d’insuffisance rénale chronique. Les valeurs cibles de pression artérielle ont été augmentées pour les patients sans albuminurie (<30 mg/jour) avec une cible de pression artérielle <140/90 mmHg. Cependant, pour les patients atteints d’albuminurie, les objectifs agressifs sont maintenus sans qu’il y ait de preuves solides [15].
En 2013, les lignes directrices ESH/ESC ont été mises à jour (tableaux 2 et 3) et recommandent une réduction de la pression artérielle systolique à <140 mmHg chez tous les patients à haut risque cardiovasculaire, y compris ceux présentant une protéinurie manifeste (avec ou sans diabète) [16].

La pression artérielle diastolique sous traitement doit être inférieure à 90 mmHg. Une réduction supplémentaire à 85 mmHg n’est recommandée que pour les patients diabétiques [16]. La tendance actuelle est de déconseiller une réduction trop intensive de la pression artérielle. Cela s’explique notamment par des études menées chez des diabétiques de type 2 à haut risque cardiovasculaire, dont le contrôle intensif de la pression artérielle a entraîné une augmentation de la mortalité cardiovasculaire [17,18].

Hypertension rénovasculaire
L’hypertension rénovasculaire est la cause la plus fréquente d’hypertension secondaire chez les patients de plus de 50 ans souffrant d’hypertension résistante (jusqu’à 45%). La prévalence de l’hypertension rénovasculaire est de 1 à 5 % des patients hypertendus [19] et elle est associée à une mortalité cardiovasculaire plus élevée et à une perte plus rapide de la fonction rénale. De grandes études randomisées (STAR et ASTRAL) n’ont pas montré de bénéfice thérapeutique du stenting de l’artère rénale [20,21]. Ces résultats viennent d’être confirmés par l’étude CORAL, la plus grande étude randomisée dans le domaine à ce jour [22]. Même dans l’analyse de sous-groupe des patients présentant des sténoses de degré supérieur (>80%), une fonction rénale réduite (eGFR <45 ml/min/1,73 m2), un diabète sucré, une sténose bilatérale ou une pression artérielle élevée à la base (>160 mmHg), la pose d’un stent n’a pas montré de bénéfice. CORAL a été la première étude dans laquelle de nombreux patients traités dans le bras conservateur ont reçu une combinaison d’aspirine, d’inhibiteurs de l’ECA ou d’ARA et de statines. L’une des critiques adressées à l’étude CORAL est que la pertinence hémodynamique de la sténose n’a été déterminée que par angiographie et non confirmée par une mesure de la pression intra-artérielle. De plus, aucune mesure de l’indice de résistance par échographie duplex n’avait été effectuée, ce qui aurait pu indiquer la pertinence de la sténose comme cause de l’hypertension [23]. La décision d’implanter un stent en cas de sténose hémodynamique avérée de l’artère rénale ne doit être prise qu’après une évaluation complète par échographie duplex et clinique par des angiologues et des néphrologues.
Hypertension résistante
Calhoun et al. se sont penchés sur le problème de l’hypertension résistante au traitement dans un grand collectif (étude REGARDS). Après modification du traitement, exclusion des causes secondaires et contrôle de l’adhérence des patients, seuls 0,5% d’entre eux présentaient une hypertension réfractaire [24]. La dénervation rénale a suscité de grandes discussions ces dernières années, suite aux résultats positifs des études Simplicity 1- [25] et Simplicity 2 [26]. L’étude de Fadl et al. (une petite étude qui exigeait une prise assurée du médicament) a remis en question l’efficacité de la dénervation rénale [27]. C’est pourquoi les résultats de l’étude Simplicity 3 (étude d’approbation de la FDA) étaient très attendus (dénervation vs. ponction artérielle Sham et insertion d’un cathéter sans dénervation). L’étude n’a pas montré d’avantage significatif de l’intervention par rapport au traitement Sham [28]. Ainsi, la dénervation rénale ne doit pas être utilisée à l’heure actuelle comme méthode standard de traitement des patients souffrant d’hypertension “résistante au traitement”.
Prof. Michael Dickenmann, docteur en médecine
Littérature :
- KDIGO 2012 Guide de pratique clinique pour l’évaluation et la prise en charge de la maladie rénale chronique. Kidn Int Suppl 2013 3(1).
- Shlipak MG, et al : N Engl J Med 2013 Sep 5 ; 369(10) : 932-943.
- Go AS, et al : N Engl J Med 2004 Sep 23 ; 351(13) : 1296-1305.
- Glassock RJ, Winearls C : Curr Opin Nephrol Hypertens 2010 Mar ; 19(2) : 123-128.
- Matsushita K, et al. (Consortium pour le pronostic des maladies chroniques du rein) : Lancet 2010 Jun 12 ; 375(9731) : 2073-2081.
- KDIGO Clinical Practice Guideline for Lipid Management in CKD : résumé des déclarations de recommandation et de l’approche clinique du patient. Kidney Int 2014 Feb 19. doi : 10.1038/ki.2014.31.
- Mann JF, et al : Lancet 2008 Aug 16 ; 372(9638) : 547-553.
- Parving HH, et al : N Engl J Med 2012 ; 367 : 2204-2213.
- Fried LF, et al : N Engl J Med 2013 ; 369 : 1892-1903.
- Isakova T, et al : Kidney Int 2011 Jun ; 79(12) : 1370-1378.
- KDIGO Clinical Practice Guideline for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int Suppl 2009 Aug ; 113 : 1-130.
- Hill KM, et al : Kidney Int 2013 May ; 83(5) : 959-966.
- Block GA, et al : J Am Soc Nephrol 2012 Aug ; 23(8) : 1407-1415.
- LaClair RE, et al : Am J Kidney Dis 2005 ; 45 : 1026-1033.
- KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney International Supplements 2012 ; 2.
- Mancia G, et al : Journal of Hypertension 2013, 31 : 1281-1357.
- Cooper-DeHoff RM, et al : JAMA 2010 Jul 7 ; 304(1) : 61-68.
- Cushman WC, et al : N Engl J Med 2010 Apr 29 ; 362(17) : 1575-1585.
- Dworkin LD, Cooper CJ : N Engl J Med 2009 Nov 12 ; 361(20) : 1972-1978.
- Wheatley K, et al. (Investigateurs ASTRAL) : N Engl J Med 2009 ; 361 : 1953-1962.
- Bax L, et al : J Nephrol 2003 ; 16 : 807-812.
- Cooper CJ, et al : N Engl J Med 2014 ; 370 : 13-22.
- Radermacher J, et al : N Engl J Med 2001 344 : 410-417.
- Calhoun DA, et al : Hypertension 2014 Mar ; 63(3) : 451-458.
- Symplicity HTN-1 Investigators : Hypertension 2011 May ; 57(5) : 911-917.
- Esler MD, et al : Circulation 2012 Dec 18 ; 126(25) : 2976-2982.
- Fadl Elmula FE, et al : Hypertension 2014 May ; 63(5) : 991-999.
- Bhatt DL, et al. (SYMPLICITY HTN-3 Investigators) : N Engl J Med 2014 Apr 10 ; 370(15) : 1393-1401.
CARDIOVASC 2014 ; 13(4) : 16-20