La rupture d’anévrisme de l’aorte abdominale (AAAr) peut être traitée soit par chirurgie ouverte, soit par chirurgie mini-invasive, c’est-à-dire par voie endovasculaire. Les annonces enthousiastes de succès suggèrent que la technique endovasculaire récente a enfin permis de faire une percée dans la réduction de la mortalité stagnante. Une analyse plus approfondie montre toutefois que les deux techniques permettent d’obtenir des résultats similaires. Ainsi, le pronostic du rBAA semble principalement déterminé par des facteurs liés à la constitution du patient et à la prise en charge péri-opératoire. Deux avantages clés du remplacement aortique ouvert sont qu’il peut être effectué partout où une équipe expérimentée est disponible et qu’il ne dépend pas d’une infrastructure spécialisée. De plus, il peut être utilisé indépendamment des conditions anatomiques. Par conséquent, le remplacement aortique ouvert devrait continuer à être la norme de référence pour l’ARAr tant que la supériorité d’une technique particulière n’a pas été démontrée de manière propre et scientifiquement impartiale ou qu’une expertise n’est pas disponible.
L’anévrisme de l’aorte abdominale (AAA) est une maladie de l’homme vieillissant qui se développe typiquement sur le terrain de l’athérosclérose. L’augmentation de taille est généralement insidieuse (3 mm/an en moyenne), ce qui explique que la plupart des AAA restent asymptomatiques pendant une longue période, bien que la tension de la paroi augmente avec le diamètre et que la paroi du vaisseau s’amincisse. La conséquence la plus redoutée est la rupture, qui s’accompagne d’une mortalité élevée. Des études épidémiologiques suggèrent que la prévalence du BAA diminue lentement depuis 1999 (actuellement chez les hommes de plus de 65 ans environ 2,2%) [1]. Parallèlement, l’incidence des ruptures diminue, principalement parce que de moins en moins de personnes fument et que des patients de plus en plus âgés sont opérés de manière élective avant que l’AAA n’éclate [2]. En revanche, la mortalité péri-opératoire en cas de rupture n’a guère diminué (toujours 30-50% en moyenne) [3, 4], ce qui est surprenant compte tenu des autres progrès réalisés dans la prise en charge péri-opératoire des patients.
Remplacement aortique ouvert et endovasculaire – deux alternatives de traitement
Les AAA intacts sont aujourd’hui traités pratiquement partout de l’une des deux manières suivantes : Le remplacement aortique ouvert au moyen d’une prothèse en plastique (Dacron ou ePTFE) est pratiqué depuis environ 60 ans et constitue une technique éprouvée avec une excellente résistance à long terme. Le remplacement endovasculaire de l’aorte (EVAR) au moyen d’une endoprothèse est disponible depuis environ 15 ans comme alternative peu invasive.
Les premières études randomisées ont toutes montré que l’EVAR peut réduire la mortalité péri-opératoire d’un facteur allant jusqu’à 3 par rapport à la chirurgie ouverte [5–7]. Cependant, aucune de ces études n’a montré d’avantage de survie à long terme et, par nature, les résultats des études ne s’appliquent qu’aux anévrismes dont la morphologie est favorable à l’imagerie. Malgré ces limites, les résultats électifs suggèrent que l’avantage de l’EVAR en termes de survie péri-opératoire pourrait être particulièrement important dans les AAA rompus. Et en effet, cette hypothèse semble confirmée par des méta-analyses de séries de cas (principalement non contrôlées) qui suggèrent une réduction de la mortalité de 40% à 20% en moyenne [8]. Cependant, premièrement, les patients ont été sélectionnés différemment dans ces séries et, deuxièmement, les comparaisons randomisées (qui n’ont d’ailleurs examiné que des patients éligibles à l’EVAR !) ne montrent jusqu’à présent aucune différence de mortalité entre le remplacement aortique ouvert et endovasculaire. Dans la première étude randomisée, de très petite taille, la mortalité était identique (53%) [9] ; dans l’étude AJAX (acute endovascular treatment to improve outcome of ruptured aortoiliac aneurysms), de plus grande taille, aucune différence statistiquement significative ne semble avoir été observée non plus [10]. La publication de cette étude n’a toutefois pas encore eu lieu.
L’EVAR élective se distingue fondamentalement de l’EVAR d’urgence en cas de rupture sur au moins trois aspects. Tout d’abord, ce dernier ne peut pas, par nature, être planifié à l’avance. Cela signifie des prestations permanentes en termes d’expertise, d’infrastructure et de gamme d’endoprothèses. Comme seulement 50 à 60% des AAA rompus se prêtent anatomiquement à l’EVAR [8], il n’est toutefois pas possible de faire l’économie d’un back-up chirurgical ouvert. Deuxièmement, un ballonnet aortique suprarénal est parfois nécessaire pour contrôler l’hémorragie aiguë, ce qui peut entraîner une ischémie viscérale dont les conséquences délétères passent facilement inaperçues. Troisièmement, le site de rupture aortique empêche la compartimentation du sac anévrismal d’empêcher les artères lombaires rétro-sanglantes de provoquer un syndrome de compartiment abdominal [11]. Dans ce contexte, il est permis de douter d’une relation de cause à effet entre la méthode de traitement (technique) et le risque de mortalité péri-opératoire.
Cet article a pour but d’illustrer, à titre d’exemple, l’importance d’autres stratégies de traitement (indépendantes) qui ont reçu peu d’attention jusqu’à présent. Il est important que les concepts soient indépendants d’une infrastructure technique complexe, de sorte qu’ils puissent être mis en œuvre partout, du moins en théorie.
Facteurs clés de la réussite du traitement rBAA
L’importance pronostique de différents aspects du traitement a été récemment étudiée dans une série consécutive homogène de patients d’un centre unique garantissant la prise en charge d’environ 1,5 million d’habitants [8, 12, 13]. La cohorte était prédestinée à de telles analyses dans la mesure où pratiquement tous les patients ont été traités de la même manière (à savoir par chirurgie ouverte). Cela atténue l’influence perturbatrice du choix de la méthode et de la sélection des patients. Concrètement, tous les patients traités pour un ARAr entre janvier 2001 et décembre 2012 ont été enregistrés dans un registre de données prospectif [8, 12, 13].
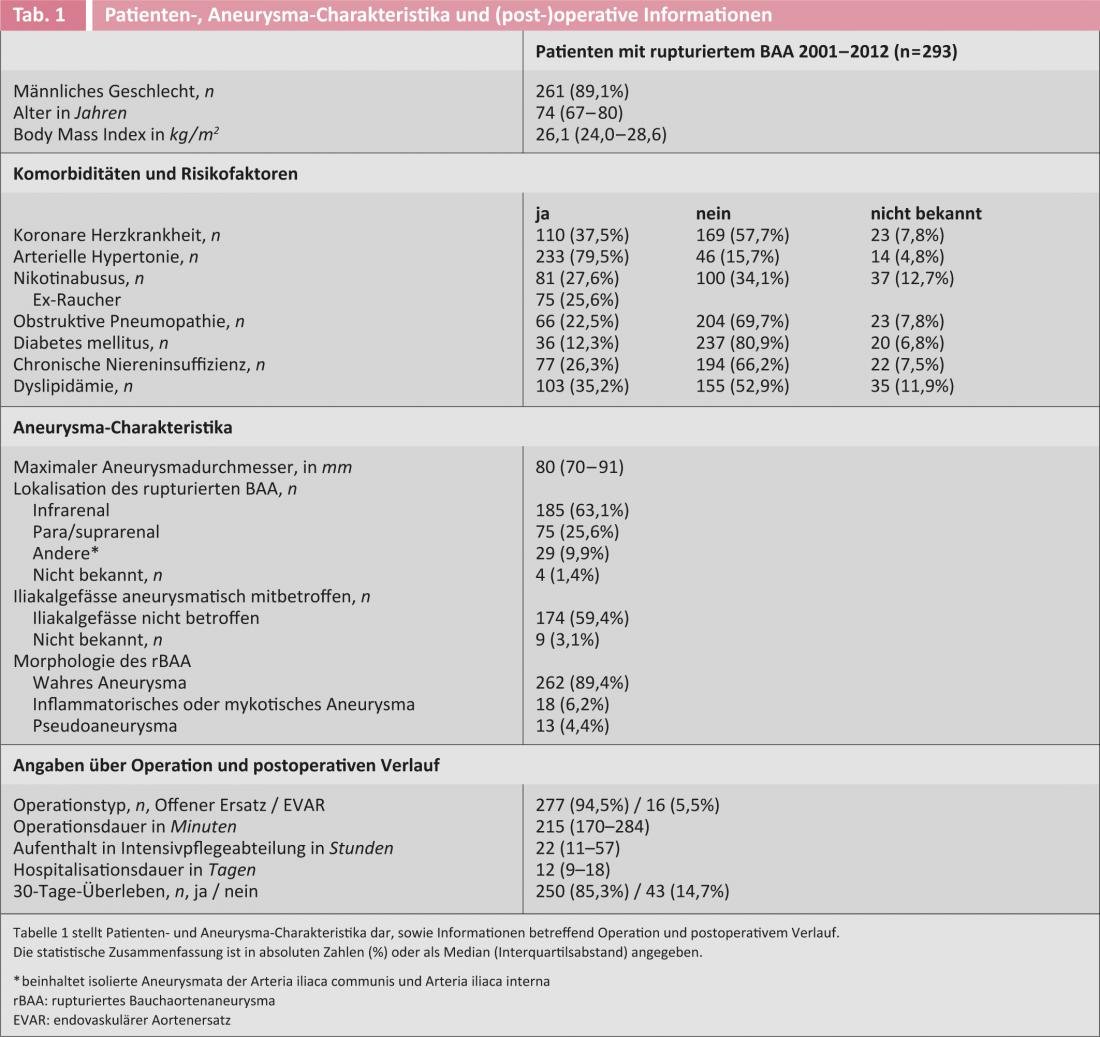
Tous les anévrismes pour lesquels du sang a été détecté à l’imagerie ou trouvé en peropératoire en dehors de la paroi vasculaire ont été analysés de manière non sélective (c’est-à-dire les anévrismes vrais, les pseudo-anévrismes et les anévrismes mycotiques, respectivement juxta- ou infra-arénaux et/ou iliaques). Les patients de la première décennie (2001-2010) ont été étudiés plus en détail dans différents travaux(Fig. 1) [8, 12, 13]. Presque tous (97%) ont été traités par chirurgie ouverte et les survivants ont été suivis pendant une période médiane de 3,2 ans (intervalle interquartile [iqr] 1,1-5,4 ans).

Fig. 1 : Le graphique montre le flux de patients de janvier 2001 à fin 2012. Des analyses séparées ont été effectuées sur les données de la décennie 2001 à fin 2010 (n=248 patients) afin d’évaluer l’influence de différents facteurs préopératoires sur la survie des patients présentant un AAA rompu.
La mortalité péri-opératoire (définie comme la mortalité à 30 jours ; cette information était connue pour tous les patients) de l’ensemble de la série (n=293) était de 14,7%. Seuls 10% des patients ne s’étaient pas vu proposer le traitement pour diverses raisons. Les résultats de cette série de patients non sélectionnés sont donc au moins aussi bons que ceux des meilleures séries EVAR publiées [14], surtout si l’on considère que ces dernières ne rapportent que des patients soigneusement sélectionnés. Chez les 248 patients de la première décennie, présentés plus en détail ci-dessous, la mortalité à 30 jours était de 15,3%, soit une fourchette comparable. Les caractéristiques du patient et de l’anévrisme, ainsi que les informations chirurgicales et péri-opératoires sont enregistrées dans le tableau 1.
“Anatomie aortique favorable” comme explication ?
Tant qu’un effet causal n’a pas été démontré dans des expériences randomisées, l’avantage de survie d’EVAR observé dans les méta-analyses peut en principe être expliqué de deux manières :
- soit (a) l’EVAR est effectivement conceptuellement supérieur en cas d’ARAr (= effet causal),
- soit (b) chez les patients éligibles pour un EVA en urgence, il existe un avantage de survie indépendant (= biais de sélection).
Si la variante (b) était correcte, les patients adaptés à l’EVAR devraient également obtenir de meilleurs résultats après un remplacement aortique ouvert que les patients non adaptés à l’EVAR. Dans la cohorte rBAA ci-dessus, tous les cas ont été classés par deux examinateurs indépendants selon des critères prédéfinis comme “adaptés à l’EVAR”, “non adaptés à l’EVAR” ou “non évaluables” [8]. Il en résulte les catégories ordinales suivantes et une catégorie supplémentaire : (1) “adapté à EVAR” (si les deux examinateurs sont d’accord), (2) “adapté de manière discutable” (s’ils sont en désaccord), (3) “inadapté à EVAR” (si les deux sont d’accord) et (4) “non catégorisable”. Conformément aux rapports précédents, 54% (n=133) de ces patients opérés à ciel ouvert ont été jugés éligibles à l’EVAR (28% “éligibles à l’EVAR” et 26% “douteusement éligibles”) et 40% (n=100) ont été jugés “non éligibles à l’EVAR”. Les 6% restants (n=15) n’ont pas pu être catégorisés, par exemple en raison de l’absence de scanner.
La mortalité à 30 jours a suivi les catégories ordinales de manière impressionnante [8] : les patients “EVAR-appropriés” avaient un risque de décès de 4% comme catégorie de référence, les patients “douteusement appropriés” de 16% (Odds Ratio [OR] 4,73 [95% Konfidenzintervall [KI] 1,13-19,77 ; p=0,033]) et les patients “EVAR-inappropriés” de 24% (OR 8,03 [95% IC 2,06-31, 34 ; p=0,003]). Les résultats ont été corrigés pour les facteurs de confusion potentiels (confounders) et sont restés inchangés dans les analyses de sensibilité, par exemple lorsque les patients non catégorisables ont été affectés à chaque catégorie dans l’ordre. C’est pourquoi l’effet positif de l’anatomie favorable semble effectivement indépendant de la technique de traitement et d’autres facteurs d’influence et très robuste. L’anatomie explique donc au moins en partie la différence observée entre l’EVAR (sélection de patients anatomiquement favorables) et le remplacement aortique ouvert (selon le centre, les patients ont tendance à ne pas être adaptés à l’EVAR, car les patients anatomiquement favorables sont traités par EVAR).
Patients chirurgicaux “à haut risque
Les modèles traditionnels de stratification du risque chirurgical, tels que le score de Hardmann, suggèrent que les patients âgés atteints d’ARAr (c’est-à-dire âgés de plus de 75-80 ans) présentent un risque chirurgical prohibitif et devraient donc être refusés pour un remplacement aortique ouvert en urgence. EVAR pourrait théoriquement offrir un avantage décisif chez ces patients. Cependant, nous savons grâce à l’étude EVAR (élective !) 2 que l’EVAR n’apporte aucun avantage chez les patients chirurgicalement inopérables [15]. Dans la cohorte rBAA étudiée, la question a été posée de savoir si l’âge élevé en soi avait une influence négative sur la mortalité périopératoire au point de justifier un motif de rejet.
24% des patients (n=60) étaient âgés de plus de 80 ans. Comme on pouvait s’y attendre, la mortalité à 30 jours en analyse bivariée était plus élevée chez ces patients (26,7% vs 11,7% ; p=0,007). Cependant, dans les analyses multivariées qui ont corrigé le résultat pour les facteurs de confusion, l’âge avancé a perdu son désavantage statistiquement indépendant (OR de décès péri-opératoire était de 2,1 [IC 95% 0,9-5,2 ; p=0,099]). En effet, l’effet négatif de l’âge était principalement dû au fait que les patients âgés étaient également plus souvent atteints d’une maladie coronarienne, qui était elle-même associée à une mortalité plus élevée. En outre, dans le groupe de patients âgés, un indice de choc >1 (au sens d’une réserve cardiaque limitée) était le principal facteur prédictif d’une mortalité accrue [12]. Il est intéressant de noter que les patients qui ont survécu aux 30 premiers jours avaient le même pronostic de survie que l’ensemble de la population ajustée en fonction de l’âge, du sexe et de l’année civile – et ce, quel que soit l’âge au moment de l’opération de l’ARAr [12].
L’âge avancé à lui seul n’est donc pas un critère d’exclusion valable d’un remplacement aortique d’urgence. Chez les patients âgés par ailleurs en bonne santé, les résultats de la chirurgie ouverte peuvent être tout à fait équivalents à ceux de l’EVAR. Toutefois, le remplacement aortique ouvert n’apporte aucun bénéfice aux patients âgés atteints de coronaropathie et déjà admis en état de choc. Il est certes hypothétiquement possible que l’EVAR donne de meilleurs résultats, mais cela n’a pas encore été démontré.
La gestion des volumes péri-opératoires
Le facteur pronostique le plus important – outre l’intervention rapide en urgence – est peut-être la gestion du volume et de l’hémodynamique entre le diagnostic et l’hémostase chirurgicale. Les études sur les traumatismes et les expériences sur les animaux ont montré que la restriction volumétrique et l’hypotension artérielle permissive jusqu’à l’arrêt chirurgical de l’hémorragie sauvent plus de vies en cas de choc hémorragique que la “stabilisation” volumétrique de la circulation [13]. La tolérance de l’état de choc, en particulier chez les patients atteints de rBAA, qui sont souvent plus polymorbides et plus âgés que les patients traumatisés, semble contre-intuitive à première vue, mais elle est convaincante en théorie. La diminution de la pression sanguine et de la coagulopathie de dilution favorise la formation de coagulation et la tamponnade du rétropéritoine, ce qui réduit les pertes sanguines. De plus, la restriction volumétrique diminue le risque d’hypothermie et de déséquilibre acido-basique.
Il est intéressant de noter que, sur la base de telles considérations, le concept de “restriction volumétrique jusqu’à l’hémostase chirurgicale” est également régulièrement recommandé chez les patients atteints d’ARAr, mais n’a jamais été étudié de manière systématique. C’est pourquoi ce concept a été exploré dans la cohorte étudiée. Les informations sur la quantité de volume administrée en préopératoire et la vitesse d’administration du volume (en l/h) avant le clampage de l’aorte ont été recueillies à partir des protocoles de transfert et d’anesthésie et corrélées à la mortalité à 30 jours après un remplacement aortique ouvert en urgence, après correction des facteurs de confusion potentiels [13].
Le débit volumétrique et le volume absolu administré ont tous deux eu un effet négatif indépendant et statistiquement significatif sur le risque de décès au cours des 30 premiers jours . Les résultats de l’étude ont montré que les patients qui avaient reçu le volume le plus élevé étaient plus susceptibles de décéder que les autres. Concrètement, le risque de mortalité a été multiplié par 1,57 (IC à 95% : 1,1-2,3 ; p=0,026) pour chaque litre de volume supplémentaire par heure. Cela s’est produit indépendamment de l’état du patient, de la pression artérielle moyenne et d’autres facteurs liés au patient ou aux mesures thérapeutiques. L’effet était principalement déterminé par le taux de volume et moins par le volume total [13].
Inversement, cela signifie qu’une restriction volumétrique systématique tout au long de la chaîne de secours, c’est-à-dire depuis l’établissement du diagnostic jusqu’à l’intervention d’urgence, est un concept important en termes de pronostic et d’efficacité chez les patients atteints d’ARAr, qui contribue à assurer leur survie. Par conséquent, tous les acteurs devraient être formés en ce sens. Chez le patient éveillé, le contrôle de la substitution volumique dépend en premier lieu de l’état de conscience. Chez les patients présentant une opacité, la pression artérielle systolique doit être soutenue, mais ne doit pas être augmentée au-delà de 70-80 mmHg pendant une période prolongée. Bien que ces analyses soient valables pour les patients opérés à ciel ouvert, il n’y a aucune raison de ne pas supposer un effet positif similaire de la restriction volumétrique chez les patients EVAR.
Conclusion
Des facteurs tels que (1) une chaîne de secours efficace avec un diagnostic rapide et un transport rapide vers l’hôpital traitant, (2) une restriction volumétrique conséquente avec une hypotension permissive, (3) une évaluation radiologique rapide et systématique, (4) une sélection des risques éthique et raisonnable du point de vue du pronostic et (5) la présence permanente d’une équipe de traitement compétente et entraînée sauvent bien plus de vies de patients atteints d’ARAr qu’une technique de traitement ou un implant particulier. Pour obtenir des résultats optimaux, l’équipe soignante doit faire ce qu’elle fait le mieux et pour quoi l’infrastructure est adaptée, en tenant compte de ces facteurs.
Dr. med. Regula von Allmen
Prof. Jürg Schmidli, docteur en médecine
PD Dr. med. Matthias Widmer
PD Dr. med. Florian Dick
Littérature :
- Svensjo S, et al : Circulation 2011 ; 124 : 1118-1123.
- Anjum A, et al : The British journal of surgery 2012 ; 99 : 637-645.
- Bown M.J, et al : The British journal of surgery 2002 ; 89 : 714-730.
- Holt PJ, et al : The British journal of surgery 2010 ; 97 : 496-503.
- Greenhalgh RM, et al : Lancet 2004 ; 364 : 843-848.
- Blankensteijn JD, et al : The New England journal of medicine 2005 ; 352 : 2398-2405.
- Lederle FA, et al : JAMA : the journal of the American Medical Association 2009 ; 302 : 1535-1542.
- Dick F, et al : The British journal of surgery 2012 ; 99 : 940-947.
- Hinchliffe RJ, et al. : European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery 2006 ; 32 : 506-513 ; discussion 14-15.
- Balm R. : Présentation orale au symposium de Charing Cross, Londres, 15 avril 2012.
- Mayer D, et al : Journal of vascular surgery 2009 ; 50 : 1-7.
- Opfermann P, et al : European journal of vascular and endovascular surgery : the official journal of the European Society for Vascular Surgery 2011 ; 42 : 475-483.
- Dick F, et al. : Journal of vascular surgery 2013.
- Veith FJ, et al. Ann Surg 2009 ; 250 : 818-824.
- Greenhalgh RM, et al : The New England journal of medicine 2010 ; 362 : 1872-1880.











