Le troisième jour du congrès EULAR de cette année a été consacré aux nouveautés dans le domaine de la fibromyalgie, de l’arthrite idiopathique juvénile, de l’arthrite psoriasique et de l’arthrose. Des experts de quatre pays différents ont présenté les connaissances actuelles sur la pathogenèse, les stratégies de diagnostic et les formes de traitement de ces quatre maladies rhumatismales.
Dans la première présentation de la Hot Session 6, le professeur José António P. da Silva, Portugal, s’est penché plus précisément sur la fibromyalgie. La recherche montre que des changements dans le système nerveux central sont à l’origine de la souffrance. En conséquence, le cerveau traite mal les signaux de douleur, ce qui entraîne une augmentation de la sensation de douleur. Chez les patients atteints de fibromyalgie, il faut donc un stimulus beaucoup plus faible que chez les personnes en bonne santé pour provoquer une douleur [1]. “Dans la gestion de cette maladie, les médecins appliquent les mêmes règles que pour toutes les affections chroniques(tableau 1).
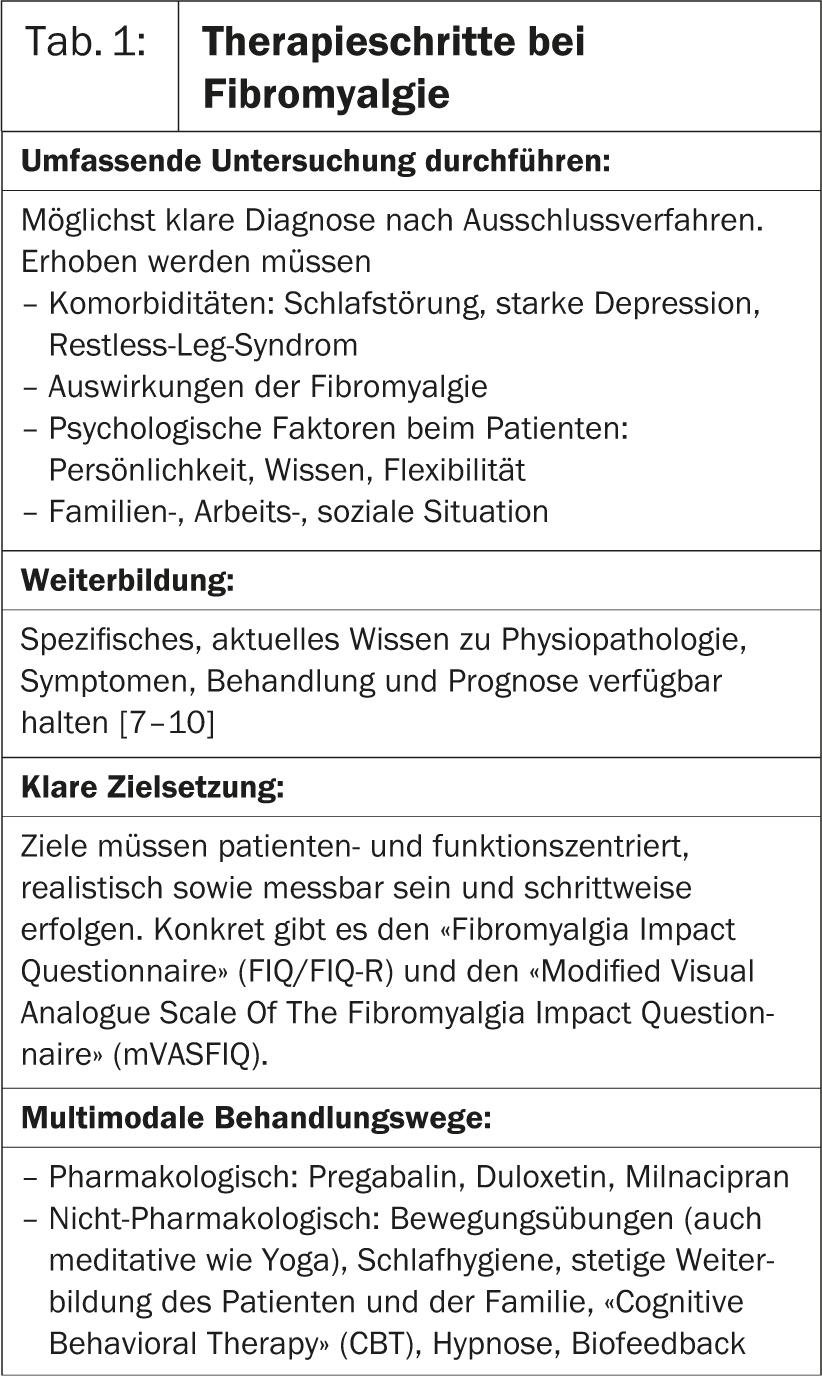
Il faut
- mener une enquête approfondie
- se former
- fixer des objectifs thérapeutiques clairs
- trouver des voies de traitement multimodales, c’est-à-dire pharmacologiques mais aussi non
- surveiller de près la réponse au traitement et les progrès ou les échecs
- en tirer des conclusions pour la redéfinition de la thérapie.
Le médecin doit également montrer qu’il aborde l’expérience individuelle de la maladie du patient de manière ouverte et sans préjugés et qu’il prend vraiment sa douleur au sérieux”, explique le professeur da Silva. Selon sa propre évaluation, la fibromyalgie est induite par le stress, ce qui entraîne une tension musculaire et des douleurs musculaires. Il est donc important de s’enquérir précisément des attentes du patient et d’évaluer en collaboration des objectifs thérapeutiques réalistes, afin que la thérapie génère le moins de stress supplémentaire possible [2].
La prégabaline 450 mg/d s’est avérée efficace dans les études (soulagement de la douleur : 46,9% vs placebo : 31,5%), mais accompagnée de divers effets secondaires tels que vertiges, fatigue, bouche sèche, prise de poids et œdèmes périphériques. Un patient sur quatre a arrêté le traitement pour cette raison (NNH : 6) [3]. La duloxétine et le milnacipran n’offrent qu’un faible bénéfice en termes de soulagement de la douleur. Il ne permet pas non plus d’améliorer de manière substantielle les problèmes de sommeil, la fatigue et la “qualité de vie” (QOL) par rapport au placebo [4].
La dépression étant une comorbidité fréquente de la fibromyalgie, la fluoxétine, la paroxétine ou la sertraline peuvent également être efficaces. Häuser et al. (2012) ont montré un soulagement de la douleur avec peu d’effets secondaires chez un petit groupe de patients sous traitement avec des antidépresseurs. Cependant, un nombre remarquable de participants ont arrêté le traitement précisément en raison du mauvais bilan effet/effet secondaire [5].
“Comme alternative non pharmacologique, on peut par exemple envisager la “Cognitive Behavioral Therapy” (CBT), qui soulage également la douleur et réduit la dépression [6]”, explique le professeur da Silva.
Arthrite idiopathique juvénile
Le Dr Pierre Quartier, Paris, a ensuite parlé de l’arthrite juvénile idiopathique (AJI). “Il existe plusieurs sous-formes : l’arthrite juvénile idiopathique systémique (également appelée maladie de Still), la polyarthrite juvénile, l’oligoarthrite ainsi que l’arthrite psoriasique et d’autres encore. Le point de départ de cette maladie se situe dans tous les cas avant l’âge de 16 ans”, explique le Dr Quartier. L’AJI systémique (AJS), par exemple, est une forme particulièrement grave de rhumatisme infantile. Les critères sont l’onset <16 ans, la durée >6 semaines, l’absence de diagnostic différentiel, la fièvre ≥15 jours et un ou plusieurs des critères suivants : Eruption cutanée, lymphadénopathie, hépatomégalie ou splénomégalie, inflammation des peaux séreuses.
“Dans tous les cas, un rhumatologue pédiatrique doit travailler au sein d’une équipe multidisciplinaire. Cela signifie que les parents de l’enfant, le médecin de famille, les personnes s’occupant de l’enfant à l’école ou à la crèche, etc. doivent être étroitement impliqués dans le traitement. Dans la mesure du possible, un traitement non agressif est recommandé. On utilise des anti-inflammatoires non stéroïdiens (AINS), des injections dans les articulations (corticostéroïdes), la physiothérapie et diverses autres formes de prise en charge”, explique le Dr Quartier. “De nombreux essais cliniques sont actuellement en cours sur les options médicamenteuses pour les formes d’AJI(tableau 2). Dans l’ensemble, le traitement de l’AJI peut être considéré comme un work-in-process”.
Arthrite psoriasique
“Quelles sont les nouveautés dans le domaine de l’arthrite psoriasique ?” C’est à cette question qu’a répondu la conférence du Dr Juan J. Gomez-Reino, Santiago. De nouvelles études renforcent les preuves selon lesquelles il existe un lien entre un IMC élevé (obésité) et le développement de l’arthrite psoriasique (PsA) chez les patients atteints de psoriasis confirmé [11, 12]. En outre, le tabagisme a été confirmé comme un facteur de risque important pour le psoriasis [13].
En ce qui concerne les moyens de diagnostic dans la PsA précoce, il apparaît que les critères du “CASPAR-Study-Group” sont plus sensibles que les critères de Moll et de Wright [14]. En outre, l’imagerie par IRM et par ultrasons (US) est de plus en plus importante dans la PsA. Ils améliorent la compréhension de cette maladie et contribuent ainsi à un meilleur diagnostic et à un meilleur contrôle du traitement. Le score PsAMRI récemment développé est déjà utilisé pour des tests randomisés et contrôlés. Il est très utile pour mesurer objectivement l’activité de la maladie. “L’IRM “Whole-Body-Multi-Joint” (WBMJ-IRM) permet d’obtenir une sorte d’instantané de l’inflammation dans les articulations touchées dans la PsA [15]”, a expliqué le Dr Gomez-Reino. “En outre, l’IRM peut aider à différencier la polyarthrite rhumatoïde de la PsA. Ceci surtout chez des patients sélectionnés pour lesquels les examens cliniques, de laboratoire et radiologiques conventionnels n’ont pas donné de résultats clairs”.
Le traitement fait apparaître différents degrés d’efficacité et de preuves des méthodes traditionnelles.
Les médicaments anti-rhumatismaux à action modificatrice (DMARD) sont résumés dans le tableau 3.
Dans l’ensemble, selon le Dr Gomez-Reino, les points suivants sont pertinents pour la pratique :
- Des voies pathogéniques nouvellement identifiées peuvent être considérées comme des cibles thérapeutiques dans la PsA.
- L’obésité et le tabagisme sont des facteurs de risque réversibles pour la PsA et pour la réponse au traitement.
- Les US et l’IRM ont un grand potentiel pour le diagnostic de la PsA.
- L’aprémilast, un inhibiteur oral de la PDE-4, et peut-être aussi des produits biologiques qui interfèrent avec la voie de l’IL-23/IL-17, pourraient constituer une alternative dans le traitement des patients atteints de PsA chez lesquels les inhibiteurs du TNF ne sont pas suffisamment efficaces.
- Les facteurs de risque cardiovasculaire (dyslipidémie, hypertension, obésité, diabète sucré, tabagisme) sont plus prévalents chez les patients atteints de PsA que chez les groupes témoins [16].

Arthrose
Selon le professeur Margreet Kloppenburg de Leiden, deux sujets sont particulièrement intéressants en ce moment :
- Le rôle de l’os sous-chondral dans l’arthrose : la molécule de signalisation “Transforming Growth Factor β” (TGF-β) dans l’os sous-chondral, qui fait partie des cytokines, pourrait constituer une cible thérapeutique potentielle.
- La thérapie non pharmacologique. Dans le traitement, une thérapie physique peut notamment être efficace. Cependant, seules certaines formes de ce phénomène sont prises en compte, comme le montre une méta-analyse de Wang et al. (2012) montre que : Les exercices aérobiques et aquatiques ont réduit l’incapacité. Les exercices d’aérobic et de musculation ainsi que l’échographie ont permis de réduire la douleur et d’améliorer la fonction. Une seule forme de thérapie ne pouvait donc pas améliorer simultanément toutes les limitations. La diathermie, l’orthopédie et la stimulation magnétique ont été inefficaces [17].
“Nous sommes toujours en train de comprendre cette maladie”, a déclaré le professeur Kloppenburg. “Par exemple, la densité minérale osseuse (DMO) est associée à la pathogenèse de l’arthrose : Un changement dans la DMO systémique est associé à une progression de la maladie. Le rôle de l’os doit également être examiné de plus près. Une étude récente montre que l’administration de bisphosphonates peut réduire la douleur [18].”
D’autres desiderata actuels concernent de nouvelles stratégies de diagnostic. Selon le professeur Kloppenburg, l’IRM n’est pas adaptée à la pratique clinique, car la grande majorité des personnes qui ne présentent pas d’évidence radiographique d’arthrose ont des lésions détectables à un âge moyen ou avancé [19].
“En outre, le ranélate de strontium, qui est en fait un médicament contre l’ostéoporose, s’est révélé efficace dans le traitement. Une analyse post-hoc d’un essai sur l’ostéoporose montre que le ranélate de strontium a réduit la progression radiographique et les douleurs dorsales dans l’arthrose spinale par rapport à un placebo [20]. Des résultats similaires existent pour l’arthrose du genou. Dans l’ensemble, le médicament a été bien toléré [21]”, a expliqué le professeur Kloppenburg.
Source : EULAR, 12-15 juin 2013, Madrid
Littérature :
- Fibro Collaborative : Mayo Clin Proc 2012 ; 87 : 488.
- Paiva, Jones : Best Pract Res Clin Rheumatol 2010 ; 24 : 341-352.
- Tzellos, et al : J Clin Pharm Ther 2010 Dec ; 35(6) : 639-56.
- Hauser, et al : The Cochrane Library janvier 31, 2013.
- Häuser, et al. : CNS Drugs 2012 ; 26(4) : 297-307.
- Bernardy, et al : J Rheumatol 2010 Oct ; 37(10) : 1991-2005.
- Burckhardt, et al. : J Rheumatol 1994 ; 21 : 714-720.
- King, et al : J Rheumatol 2002 ; 29 : 2620-2627.
- Rooks, et al : Arch Intern Med 2007 ; 167 : 2192-2200.
- White, et al. : Arthritis Rheum 2002 ; 47 : 260-265.
- Wenqing, et al : Ann Rheum Dis 2012 ; 71 : 1267-1272.
- Jon Love, et al : Ann Rheum Dis 2012 ; 71(8) : 1273-1277.
- Li, et al. : American Journal of Epidemiology 2011 ; 175(5) : 402-413.
- Coates, et al : Arthritis Rheum 2012 Oct ; 64(10) : 3150-5.
- Coates, et al : Best Pract Res Clin Rheumatol 2012 ; 26(6) : 805-22.
- Jamnitski, et al : Ann Rheum Dis 2013 ; 72 : 211-216.
- Wang, et al : Ann Intern Med 2012 Nov 6 ; 157(9) : 632-44.
- Laslett, et al. : Ann Rheum Dis. doi : 10.1136/annrheumdis-2012-202989.
- Guermazi, et al : BMJ 2012 ; 345. doi : http://dx.doi.org/10.1136/bmj.e5339 (Published 29 août 2012).
- Bruyere, et al. : Ann Rheum Dis 2008 ; 67 : 335-339.
- Reginster, et al : Ann Rheum Dis 2013 ; 72 : 179-186.