Dans le cas des plaies chroniques, la persistance d’un biofilm malgré le meilleur traitement possible de la maladie sous-jacente entraîne une stagnation de la cicatrisation. Le débridement mécanique est très important, mais il n’est pas suffisant en tant que mesure unique et, dans certains cas, il n’est pas pratique. Pour que les solutions antimicrobiennes de rinçage des plaies et les pansements soient efficaces contre le biofilm, il est essentiel qu’ils parviennent à pénétrer la substance polymère extracellulaire. En conséquence, l’efficacité des différentes préparations varie.
Les plaies qui restent ouvertes après 30 jours sont considérées comme chroniques, quelle qu’en soit la cause, et sont susceptibles de s’infecter en raison de différents facteurs [1]. Ainsi, l’environnement chaud et humide de la plaie est un terrain idéal pour les bactéries et les champignons, et la fermeture retardée de la plaie augmente le risque d’exposition permanente aux pathogènes, avec le risque de formation d’un biofilm. Lors du Congrès sur les plaies de cette année à Nuremberg, le professeur Ewa Klara Stürmer, directrice médicale du Comprehensive Wound Center et directrice de la recherche translationnelle sur les plaies à l’Hôpital universitaire de Hambourg-Eppendorf, a fait un exposé sur la pratique clinique et les nouvelles découvertes dans le traitement du biofilm des plaies [2].

Le biofilm est présent sur plus des trois quarts des plaies chroniques
Un biofilm se forme lorsque la colonisation bactérienne dans la plaie entraîne la formation de colonies ou d’associations bactériennes dans lesquelles les bactéries mûrissent et se propagent (encadré) [16]. Selon une méta-analyse, environ 78% des plaies chroniques sont colonisées par des micro-organismes pathogènes sous forme de biofilms [3]. Le biofilm de la plaie assure localement une réaction immunitaire ou une inflammation durable et plus ou moins prononcée [4]. Si le biofilm n’est pas rompu et éliminé, la cicatrisation stagne, ce qui entraîne la persistance de la chronicité d’une plaie, même si la maladie sous-jacente est traitée au mieux [2,4,5]. Les principales espèces bactériennes présentes dans les biofilms des plaies, à l’exemple de l’ulcère de jambe, sont (Aperçu 1) : Staphylococcus aureus, sa variante résistante à la méthicilline (SARM), Pseudomonas aeruginosa, les entérobactéries et Proteus mirabilis [6].

La substance polymère extracellulaire, un point crucial
La société symbiotique multi-espèces de micro-organismes à partir de laquelle les biofilms sont formés produit une substance polymère extracellulaire (EPS) dans laquelle ils “s’emmurent” [2,4]. L’EPS est essentiellement composé de polysaccharides ainsi que d’un grand nombre de protéines, de lipides, de glycoprotéines et de glycolipides, ce qui le fait adhérer fermement au fond de la plaie [7]. Ce mélange de sucre et de protéine constitue un “bouclier” bactérien contre les antiseptiques et les antibiotiques [2]. Après 2 à 4 jours, on parle de “biofilm mature”. Un biofilm de la plaie ou une forte colonisation bactérienne de la plaie peuvent être rendus visibles à l’œil nu à l’aide d’une lumière proche des UV (par ex. MolecuLight®, MolecuLight Corp., Toronto, Canada) [4].
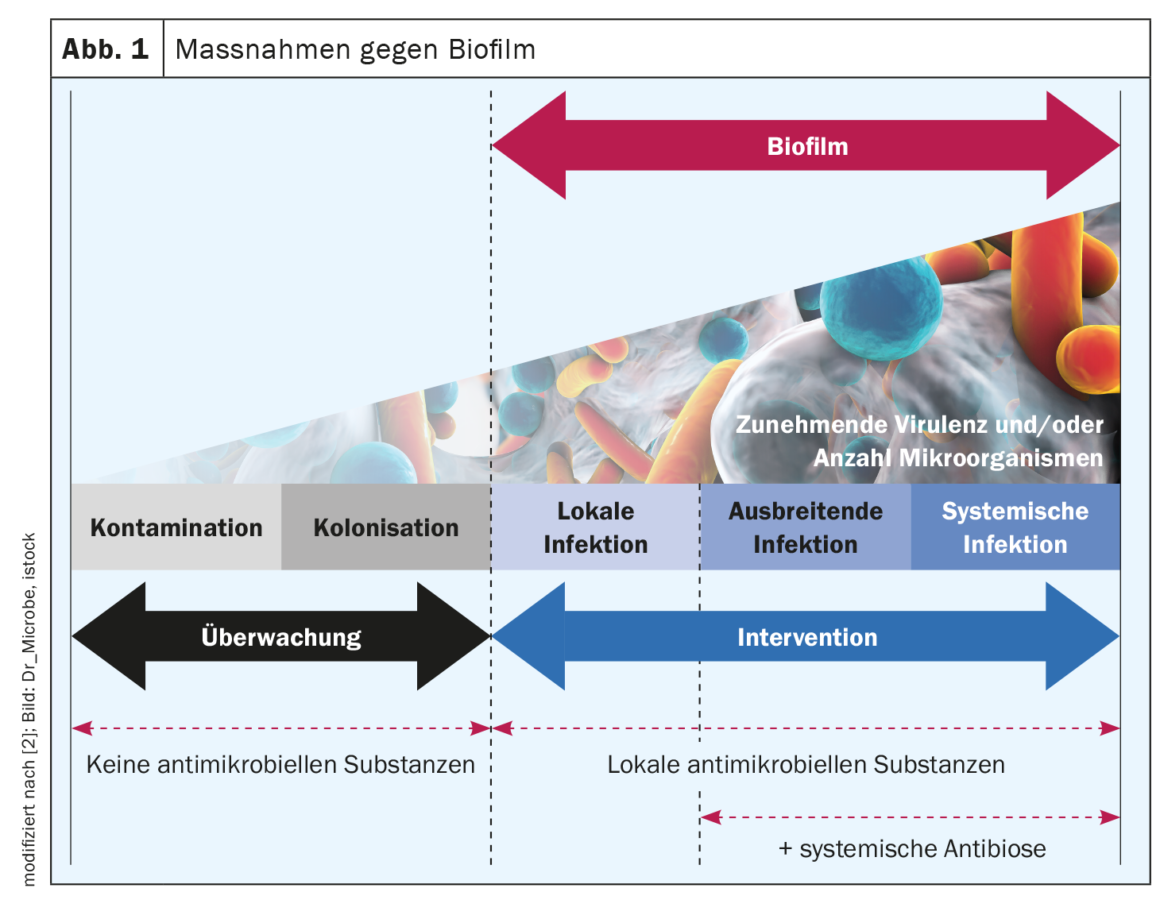
Efficacité des rinçages de plaies et des pansements antimicrobiens
Le débridement mécanique est actuellement le seul traitement du biofilm de la plaie recommandé par le consensus d’experts, mais d’une part, le débridement seul n’élimine pas tout le biofilm et d’autre part, il ne constitue pas toujours une option viable dans le cadre des soins à domicile (par ex. hygiène limitée, patients sous anticoagulants médicamenteux) [4,8]. Les solutions antimicrobiennes de rinçage des plaies ciblent et détruisent les parois et les membranes bactériennes ainsi que les protéines de transport des bactéries ou inhibent leur fonction [4]. S’ils ne parviennent pas à traverser l’EPS – qui fonctionne comme une barrière biochimique contre le système immunitaire de l’hôte et en particulier contre les agents antimicrobiens – ils ne peuvent pas agir efficacement. Par conséquent, l’efficacité des différentes solutions de rinçage des plaies contre les biofilms bactériens varie [4]. Des tests translationnels systématiques utilisant le modèle de biofilm humain hpBIOM montrent qu’Octenisept® est capable de briser les biofilms et de tuer les bactéries qui s’y trouvent en 72 h [4,9,10,17]. Le PHMB y parvient dans une mesure limitée dans le même laps de temps, mais une éradication complète n’est pas non plus atteinte après 72 heures. Les solutions de rinçage des plaies hypochloriques et la chlorhexidine ne parviennent pas à éliminer efficacement les bactéries du biofilm [4,10].

En ce qui concerne l’importance des pansements, il est certes quelque peu difficile de formuler des recommandations thérapeutiques différenciées à partir de la faible base de preuves d’études cliniques comparatives sur les pansements (antimicrobiens), car non seulement les substances actives (ions d’argent, argent nanocristallin, PHMB, dérivés iodés, etc.) et leurs concentrations varient, mais aussi la base respective des pansements (mousse PU, alginates, fibres, etc.). [4,11]. Mais des tests in vitro multiples utilisant un modèle de biofilm humain ont montré qu’un produit combiné d’iode et d’amidon (Cadexomer-Iod) était capable d’éradiquer complètement les bactéries du biofilm en six jours [2,4]. D’autres pansements contenant des principes actifs, tels que le PHMB ou l’argent, n’ont entraîné qu’une réduction de la charge bactérienne [12]. Les analyses ont été effectuées après une période de six jours sans changement de pansement et il est probable qu’un changement quotidien ou tous les deux jours permette d’obtenir une meilleure efficacité pour tous les pansements testés [4].
Le mécanisme d’action du produit combiné à base d’iode et d’amidon (Iodosorb™) est basé sur des microsphères de cadexomer qui détruisent la structure du biofilm ou la substance polymère extracellulaire bactérienne par déshydratation, condition préalable pour que l’iode puisse éliminer facilement les bactéries ainsi mises à nu dans le biofilm [12,18].
Congrès : Congrès sur les plaies de Nuremberg
Littérature :
- Hunt S, Elg F : The clinical effectiveness of haemoglobin spray as adjunctive therapy in the treatment of chronic wounds. J Wound Care 2017 ; 26(9) : 558-568.
- “Biofilm – Le défi de la décennie dans le traitement des plaies – Reconnaître, comprendre et éliminer durablement le biofilm des plaies”, Prof. Dr med. Stürmer, Symposium industriel Smith & Nephew GmbH, Congrès sur les plaies de Nuremberg, 1.12.2022.
- Malone M, et al. : The prevalence of biofilms in chronic wounds : a systematic review and meta-analysis of published data. J Wound Care 2017 ; 26(1) : 20-25.
- Stürmer EK, Rembe J-D : Reconnaître et comprendre le biofilm de la plaie : Les possibilités thérapeutiques et leurs limites. Formation continue CME, DERMATOLOGIE PRAXIS 2/2022, 6-11.
- James GA, et al. : Biofilms in chronic wounds. Wound Repair Regen 2008 ; 16(1) : 3-44.
- Jockenhofer F, et al : Bacteriological pathogen spectrum of chronic leg ulcers : Results of a multicenter trial in dermatologic wound care centers differentiated by regions. J Dtsch Dermatol Ges 2013 ; 11(11) : 1057-1063.
- Flemming HC, Wingender J : La matrice du biofilm. Nat Rev Microbiol 2010 ; 8(9) : 623-633.
- Schwartz JA, et al : Le débridement chirurgical seul ne permet pas de réduire suffisamment les bioburdies planctoniques dans les plaies chroniques de l’extrémité inférieure. J Wound Care. 2014 Sep ; 23(9) : S4, S6, S8 passim. doi : 10.12968/jowc.2014.23.Sup9.S4.
- Besser M, et al. : Efficacité des antiseptiques dans un nouveau modèle de biofilm de plasma humain en 3 dimensions (hpBIOM). Sci Rep 2020 ; 10(1) : 4792.
- Rembe JD, et al. : Antimicrobial Hypochlorous Wound Irrigation Solutions Demonstrate Lower Anti-biofilm Efficacy Against Bacterial Biofilm in a Complex in-vitro Human Plasma Biofilm Model (hpBIOM) Than Common Wound Antimicrobials. Front Microbiol 2020 ; 11 : 564513.
- Schwarzer S, et al. : The efficacy of topical agents used in wounds for managing chronic biofilm infections : A systematic review. J Infect 2020 ; 80(3) : 261-270.
- Stuermer EK, et al. : Activité in vitro des revêtements antimicrobiens pour plaies sur le biofilm de plaie de P. aeruginosa. Front Microbiol 2021 ; 12 : 664030.
- Stuermer EK, et al. : Bacterial infiltration in biofilm-colonized wounds : Analyses in the hpBIOM ex vivo wound model and possible impact on swabbing and debridement. Int Wound J 2022 (sous révision)
- 14. “Principes de soins des plaies, nettoyage des plaies/techniques de débridement”, www.bk-trier.de/media-bkt/docs/Bildung/Handouts-Wundmanagement/Basisseminar-Handouts/03_Debridement.pdf,(dernière consultation 20.01.2023).
- Rembe JD, Stürmer EK : L’antisepsie moderne des plaies – Indications et limites, entre connaissance, désir et incertitude. Chirurgie vasculaire 2020 ; 25, 272-276.
- Percival SL, McCarty SM, Lipsky B : Biofilms and Wounds : An Overview of the Evidence. In : Advances in wound care 2015 ; 4(7) : 373-381.
- Compendium suisse des médicaments,
https://compendium.ch,(dernier appel 20.01.2023) - Iodosorb™ Dressing, www.smith-nephew.com/switzerland/fachgebiete/wundmanagement/iodosorb-dressing,(dernière consultation 20.01.2023).
DERMATOLOGIE PRAXIS 2023 ; 33(1) : 32-33 (publié le 16.2.23, ahead of print)











