Ces dernières années, l’hémostase a connu une évolution révolutionnaire des connaissances, tant sur le plan préclinique avec la recherche fondamentale que sur le plan clinique avec le développement de stratégies thérapeutiques innovantes. Prendre le patient comme référence, c’est mettre en lumière les derniers développements de la recherche dans le domaine de l’hémostase en fonction de leur impact sur les soins actuels et futurs des patients. La réunion annuelle de cette année a répondu à cette exigence.
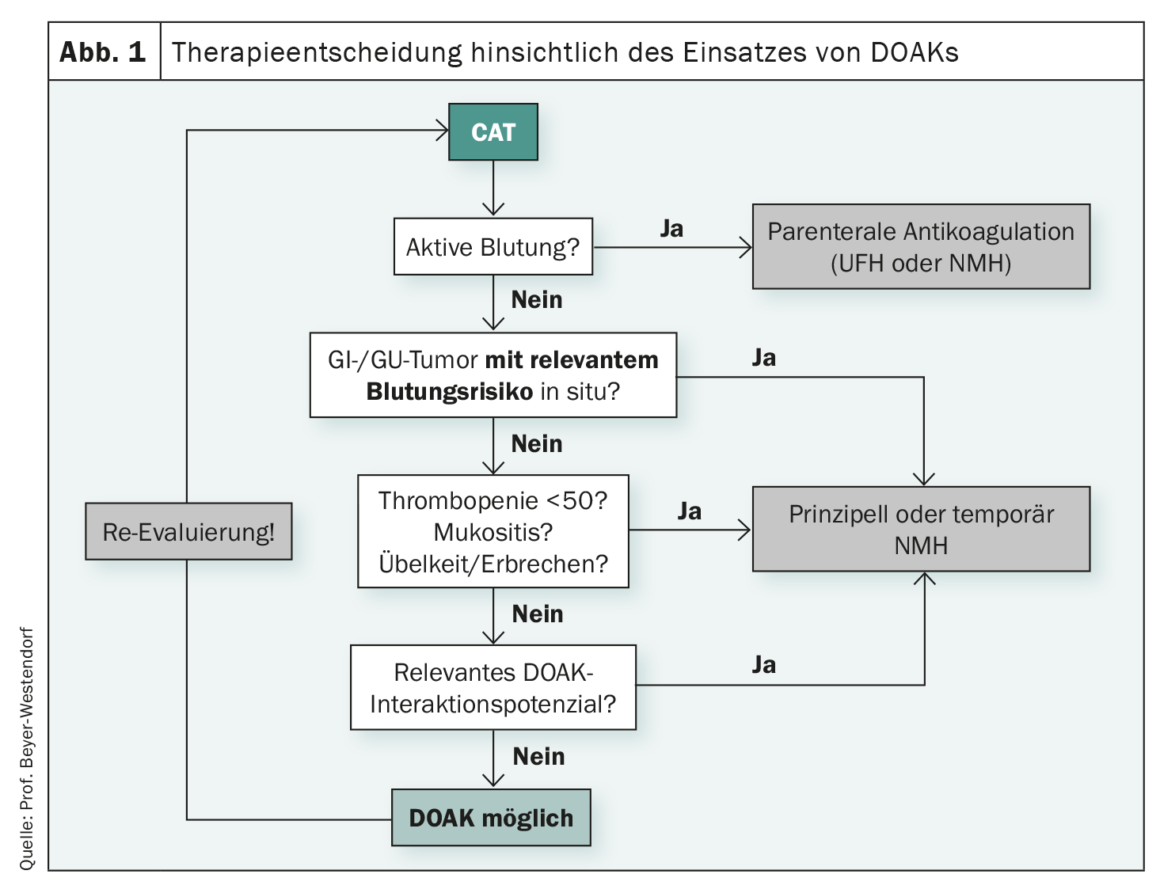
Les lignes directrices sont destinées à simplifier les décisions dans la pratique quotidienne. Mais ce n’est pas toujours le cas, comme l’a montré le professeur Jan Beyer-Westendorf, Dresde (Allemagne), en se basant sur l’anticoagulation en cas de thromboembolie veineuse associée à une tumeur (TEV tumorale). Si un traitement anticoagulant doit être instauré chez des patients atteints de tumeurs, on sait que le risque de récidives et d’hémorragies est très élevé. Sous traitement par antagonistes de la vitamine K (AVK), une TEV récidivante a été observée chez 6,8% des patients non oncologiques et chez 20,7% des patients cancéreux. Le risque d’hémorragie grave est de 12,4% pour les patients atteints de tumeur sous traitement AVK et de 4,9% pour les patients sans maladie oncologique. Pour compliquer les choses, le risque de TEV ne cesse d’évoluer au fil du temps. En conséquence, l’évaluation des risques et des bénéfices de l’anticoagulation est particulièrement difficile chez les patients atteints de thromboembolisme associé au cancer (CAT), a souligné l’expert. Si l’on se réfère maintenant aux lignes directrices, les recommandations actuelles indiquent que les DOAK et les HNM doivent être utilisés pour traiter la TEV tumorale. Cela reflète un changement de paradigme, car la question n’est plus de savoir s’il faut ou non anticoaguler, l’héparine non fractionnée et les antagonistes de la vitamine K ne jouent plus que très rarement un rôle et le standard thérapeutique des 20 dernières années avec les héparines de bas poids moléculaire (HBPM) est désormais complété par les anticoagulants oraux directs (AOD). La véritable question clé aujourd’hui est plutôt de savoir quand il faut recourir aux NMH et quand il vaut mieux recourir aux DOAK. La sélection des patients dans les études DOAC-CAT peut donner une indication. Les patients thrombopéniques, les personnes atteintes de tumeurs cérébrales et de tumeurs du tractus gastro-intestinal supérieur étaient généralement exclus ou sous-représentés. A cela s’ajoute le risque accru de saignement sous DOAK et le risque de saignement qui varie selon le type de tumeur. Le potentiel d’interaction avec d’autres médicaments devrait également être pris en compte, a déclaré l’orateur. Selon son expérience, le traitement par AOD atteint ses limites cliniques chez les patients présentant des troubles de la déglutition, des lésions des muqueuses, des nausées ou des vomissements, et lorsque l’anticoagulation est nécessaire malgré des stigmates de saignement et une thrombopénie cliniquement significative. (Fig. 1). En principe, Beyer-Westendorf est cependant convaincu que les NMH et les DOAK sont des options “côte à côte” équivalentes et importantes pour les patients atteints de tumeurs et souffrant de TEV, que de nombreuses personnes concernées peuvent également profiter de la simplicité de l’utilisation des DOAK, mais qu’il convient d’examiner attentivement quand, entre autres, des contre-indications rendent leur utilisation difficile ou même impossible.
Aspects spécifiques aux femmes dans la TAO
L’incidence de la TEV dans les pathologies tumorales est élevée – en particulier dans les cancers de l’ovaire. De plus, l’incidence dépend du stade de la maladie. Si, aux stades I et II, le cancer du pancréas occupe encore la première place et le cancer des ovaires la deuxième, ils sont dépassés au stade IV par le cancer de l’endomètre. Si l’on se penche sur les effets de la TEV sur la mortalité, on constate qu’elle a des effets significatifs sur les cancers de l’endomètre et du sein, comme l’a expliqué le Dr Christian Pfrepper, Leipzig (D). En conséquence, la prévention de la thrombose joue un tout autre rôle dans les tumeurs gynécologiques. Celle-ci doit être effectuée pendant la chimiothérapie chez les patientes à haut risque sous apixaban, rivaroxaban ou HNM. En cas de chirurgie tumorale dans l’abdomen/le pelvis, il convient d’administrer de l’HNF, de l’HNF ou de l’apixaban pendant quatre semaines, sauf s’il existe un risque élevé de saignement.
Le Dr Sandra Marten, Dresde (Allemagne), a ajouté que la principale indication de l’anticoagulation chez les patients de moins de 50 ans est la prévention et le traitement de la TEV. Pour cela, on utilise en grande partie des DOAK – de plus en plus souvent aussi chez les femmes en âge de procréer. Il en résulte de nouveaux défis concernant l’impact du traitement sur les saignements menstruels, la prévention ou la planification d’une grossesse et le risque d’exposition aux DOAK pendant la grossesse et l’allaitement. On trouve sur Internet de nombreuses discussions de patients sur le thème de l’augmentation des saignements menstruels sous DOAK. C’est ce que montrent également les grandes études dans lesquelles une hyperménorrhée ou des règles prolongées ont pu être observées. Seul le dabigatran n’a pas montré ce signal. Cela est dû, d’une part, à la modification du statut hormonal suite à la modification de la contraception ou de l’hormonothérapie après une TEV et, d’autre part, à l’action directe des DOAK sur les facteurs de coagulation, la paroi utérine ainsi qu’à la synergie avec les anticoagulants naturels nécessaires à l’hémorragie menstruelle, explique-t-elle. Si une hyperménorrhée ou des saignements utérins atypiques surviennent, il convient de réduire la dose de DOAK ou de passer au dabigatran, ou encore d’arrêter le traitement et de passer à l’AAS.
La question suivante porte sur la prévention ou la planification d’une grossesse sous traitement DOAK. Une contraception adéquate est sans aucun doute la bonne approche, selon l’experte. L’augmentation du risque de TEV récurrente due aux contraceptifs hormonaux semble faible et les bénéfices supérieurs aux risques. Avant de désescalader le traitement DOAK, il est conseillé de le réévaluer, y compris de changer de pilule œstroprogestative pour une alternative plus sûre.
En ce qui concerne une grossesse prévue, il faut envisager de changer d’anticoagulant. Le passage à la NMH est sûr, efficace et il n’y a aucun signe d’embryotoxicité. Cependant, le traitement est inconfortable et comporte des risques tels que la TIH et l’ostéoporose. Le passage aux AVK est possible jusqu’au début de la grossesse en raison d’une embryotoxicité connue. Le traitement oral est par ailleurs efficace et il existe des données et des recommandations valables. Il ne faut pas sous-estimer la période critique d’exposition de six à douze semaines de grossesse et le chevauchement fréquent entre la détection de la grossesse et la demi-vie de l’AVK. En principe, la patiente pourrait également rester sous traitement DOAK jusqu’à la confirmation de la grossesse. Le traitement est également oral, efficace, et les DOAK présentent une piécette de demi-vie très courte. Cependant, les risques d’embryotoxicité inconnus et l’absence de recommandations à ce jour s’opposent à cette idée, a résumé Mme Marten.
En revanche, pendant la grossesse, il faut absolument passer des DOAK aux NMH. Néanmoins, l’exposition aux DOAK ne constitue pas un motif d’interruption de grossesse. Un suivi gynécologique précoce et un monitoring fœtal sont toutefois recommandés. Le traitement par DOAK n’est pas non plus indiqué pendant l’allaitement. Par conséquent, en fonction de l’évaluation des risques et des avantages, il convient soit d’interrompre l’allaitement, soit de passer à l’HNM.
Congrès: 67. Jahrestagung der Gesellschaft für Thrombose- und Hämostaseforschung (GTH) 2023
InFo ONKOLOGIE & HÄMATOLOGIE 2023; 11(2): 20–21