Le pronostic de l’amylose à chaînes légères (AL), une dyscrasie plasmocytaire, est en grande partie déterminé par la présence d’une atteinte cardiaque. La stadification conventionnelle est basée sur les biomarqueurs cardiaques et la différence de chaînes légères libres. Une nouvelle étude a tenté d’évaluer le rôle des paramètres échocardiographiques en tant que marqueurs pronostiques de l’amylose AL et d’examiner leur utilité par rapport au staging conventionnel.
L’amylose cardiaque est l’archétype de la cardiomyopathie infiltrative et présente souvent le phénotype clinique d’une insuffisance cardiaque à fraction d’éjection préservée. L’amylose systémique à chaînes légères (amylose AL) est une dyscrasie plasmocytaire avec une implication multisystémique ; cependant, le pronostic de l’amylose AL est souvent lié à l’implication cardiaque. Cela se reflète dans l’utilisation du “score de Mayo” dans la stadification de l’amylose AL. Ce score comprend les biomarqueurs cardiaques troponine à haute sensibilité (hs-Trop) et peptide natriurétique pro-cérébral N-terminal (NT-proBNP) ainsi que la différence de chaînes légères libres (dFLC) [2].
Bien que le score de Mayo initial et le score révisé pour la classification de l’amylose AL aient démontré leur utilité pronostique, il existe des restrictions à l’utilisation de ces biomarqueurs. Les différences entre les tests de troponine utilisés dans les différents centres, par exemple hs-TropI et hs-TropT, qui ont chacun leurs propres plages définies, rendent les comparaisons temporelles difficiles. Les tests de NT-proBNP ont également évolué au fil du temps, ce qui représente des effets similaires à ceux de la troponine. En outre, la troponine et le NT-proBNP sont tous deux influencés par des facteurs tels que l’indice de masse corporelle et l’insuffisance rénale concomitante, cette dernière étant relativement fréquente en cas d’amylose AL systémique.
En revanche, les marqueurs échocardiographiques traditionnels de la structure et de la fonction cardiaques sont standardisés et ont des plages normales définies de manière universelle. En outre, les patients atteints d’amylose AL subissent systématiquement une échocardiographie transthoracique (ETT) pour évaluer l’implication cardiaque, car elle est peu coûteuse et largement disponible. De nouveaux indices échocardiographiques tels que la dilatation longitudinale globale du ventricule gauche (LVGLS) ont été validés pour un large éventail de processus pathologiques et sont de plus en plus utilisés dans l’évaluation clinique de l’amylose AL [3]. Une étude récente a donc examiné l’utilité pronostique des paramètres échocardiographiques par rapport au staging Mayo chez les patients atteints d’amylose AL [1].
Caractéristiques des patients et paramètres échocardiographiques
75 patients consécutifs atteints d’amylose AL, examinés dans une clinique amyloïde référente et ayant subi un examen échocardiographique complet, ont été identifiés de manière rétrospective. L’âge moyen était de 61,8 ± 10 ans et 51/75 patients étaient des hommes. 71 patients sur 75 ont reçu une chimiothérapie, la plupart avec du bortezomib (Velcade), du cyclophosphamide et de la dexaméthasone (VCD ; 30/75) ; 11 patients ont subi une transplantation de cellules souches allogéniques. 25 patients ont été classés au stade I de Mayo, 22 au stade II, tandis que les stades III et IV comprenaient respectivement 15 et 13 patients.
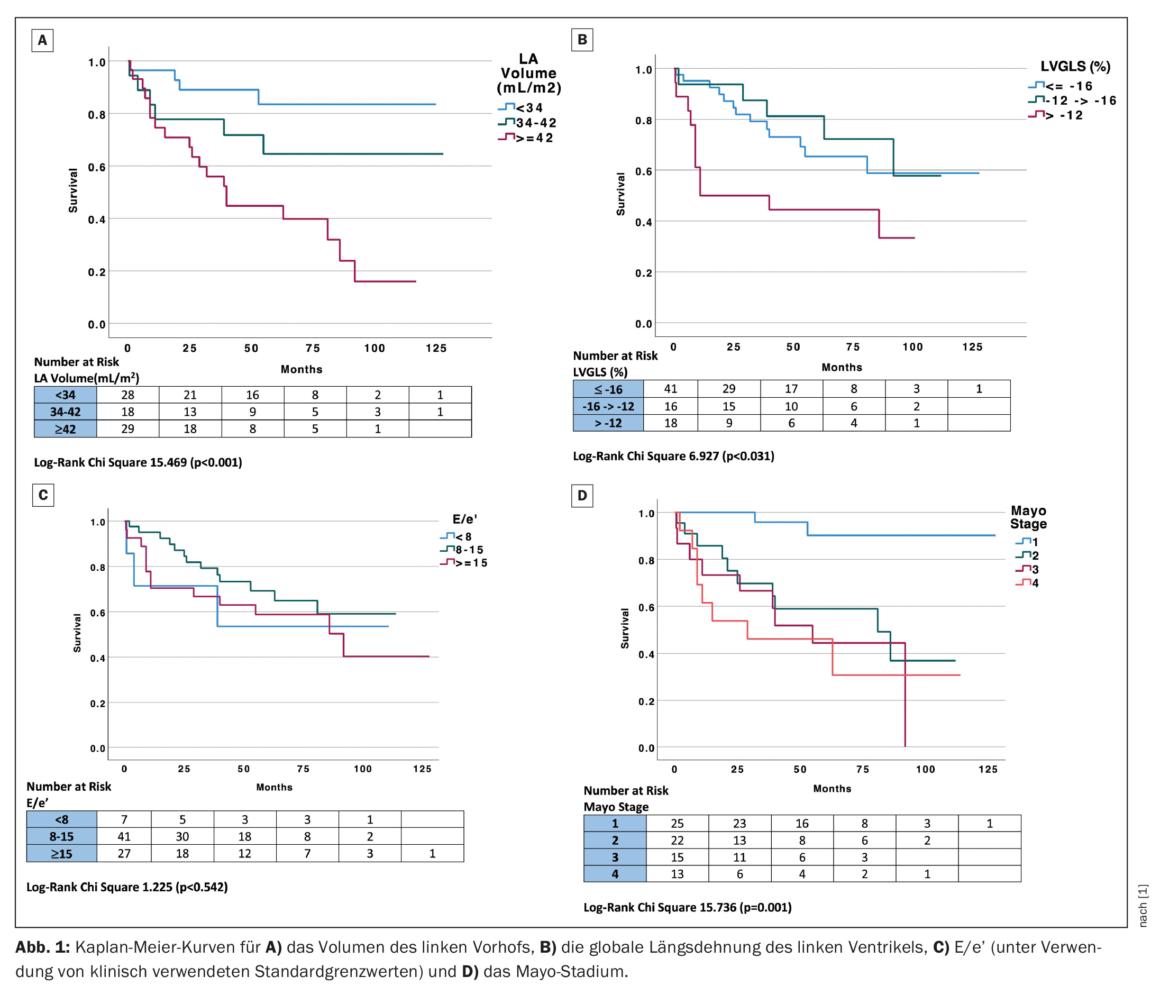
Les paramètres échocardiographiques étudiés comprenaient la fraction d’éjection du ventricule gauche, la masse, les paramètres fonctionnels diastoliques, la dilatation longitudinale globale (GLS) et le volume de l’oreillette gauche (LA). La mortalité a été déterminée par un examen des dossiers cliniques. Au cours d’une période de suivi médiane de 51 mois, 29/75 (39%) patients sont décédés. Les patients ont été divisés en deux sous-groupes sur la base de la mortalité, qui ne différaient pas en termes d’âge, de sexe ou d’indice de masse corporelle, bien que la pression artérielle systolique ait atteint un niveau de signification statistique (p=0,051). 11 patients ont présenté une fibrillation auriculaire ; le taux de fibrillation auriculaire était similaire dans les deux groupes : 6/46 (13%) chez les survivants contre 5/29 (17%) chez les non-survivants (p=0,617). Les patients qui sont décédés avaient un volume de LA significativement plus grand (35 ± 10 vs. 47 ± 12 mL/m2, p<0,001) et un E/e’ plus élevé (14 ± 6 vs. 18 ± 10, p=0,026) ; la masse du VG et le LVGLS s’approchaient tous deux de la significativité statistique. Il n’y avait pas de différence entre les groupes en ce qui concerne la fonction systolique du VG, évaluée par la FEVG. Comme prévu, la mortalité a augmenté avec le stade Mayo, atteignant respectivement 8, 45, 60 et 62% chez les patients des stades Mayo I-IV.
Stade Mayo et prédicteurs échocardiographiques univariés de la survie
L’analyse univariée a montré que les paramètres échocardiographiques qui prédisaient la mortalité avec une significativité de p<0,1 comprenaient le LAVI, la vitesse e’, E/e’ et le LVGLS. Le stade Mayo était également un prédicteur indépendant de la survie. Des prédicteurs échocardiographiques univariés de la mortalité (significativité de p<0,1) ont été introduits dans un modèle multivariable de risques proportionnels de Cox et comprenaient E/e’ et le volume de LA ainsi que LVGLS (la vitesse e’ n’a pas été incluse dans le modèle en raison de sa colinéarité avec E/e’). Dans ce modèle multivariable de paramètres échocardiographiques, LAVI était le seul prédicteur échocardiographique indépendant de la mortalité. Le volume indexé de l’oreillette gauche était corrélé au stade Mayo (coefficient de corrélation de Spearman 0,5, p<0,001), et tous les patients aux stades Mayo III et IV avaient des oreillettes gauches dilatées (LAVI ≥34 mL/m2).
Répartition des patients en trois groupes de risque différents
LVGLS (fonction systolique du ventricule gauche), LAVI et E/e’ (fonction diastolique) ont été analysés en tant que variables catégorielles en utilisant des valeurs de cut-off cliniquement applicables afin d’évaluer leur impact sur la mortalité par rapport au stade Mayo. La distension longitudinale globale du ventricule gauche a été divisée en trois groupes, sur la base de la limite clinique précédemment rapportée de mieux que -16, de -12 à -16% et de moins que -12% pour les GLS normaux, réduits et fortement réduits, respectivement [4]. Le volume auriculaire gauche indexé a été divisé en trois groupes, en utilisant une valeur limite clinique de ≤34, 34-42 et ≥42 mL/m2, ce qui correspond à une dilatation LAVI normale, légère à modérée ou à une dilatation LAVI plus importante que modérée [5]. E/e’ a été classé en trois groupes sur la base des valeurs cliniques de <8, 8-15 et ≥15, ce qui correspond à une pression de remplissage du VG normale, probablement anormale et élevée [6]. La stratification par groupe clinique de LAVI (p<0,001), LVGLS (p=0,031) et stade Mayo (p=0,001) ont été des prédicteurs significatifs de la mortalité, tandis que E/e’ n’a pas atteint la significativité dans l’analyse Kaplan-Meier (Fig. 1) [1]. Il convient de noter que les patients ayant un LAVI normal <34 mL/m2 ont obtenu des résultats particulièrement bons à long terme (durée médiane de suivi de 60,5 ± 46 mois) et qu’à l’inverse, les patients ayant un LVGLS inférieur à -12% ont obtenu de mauvais résultats.
Système de points pour la dilatation de l’oreillette gauche et la dilatation longitudinale globale réduite du ventricule gauche
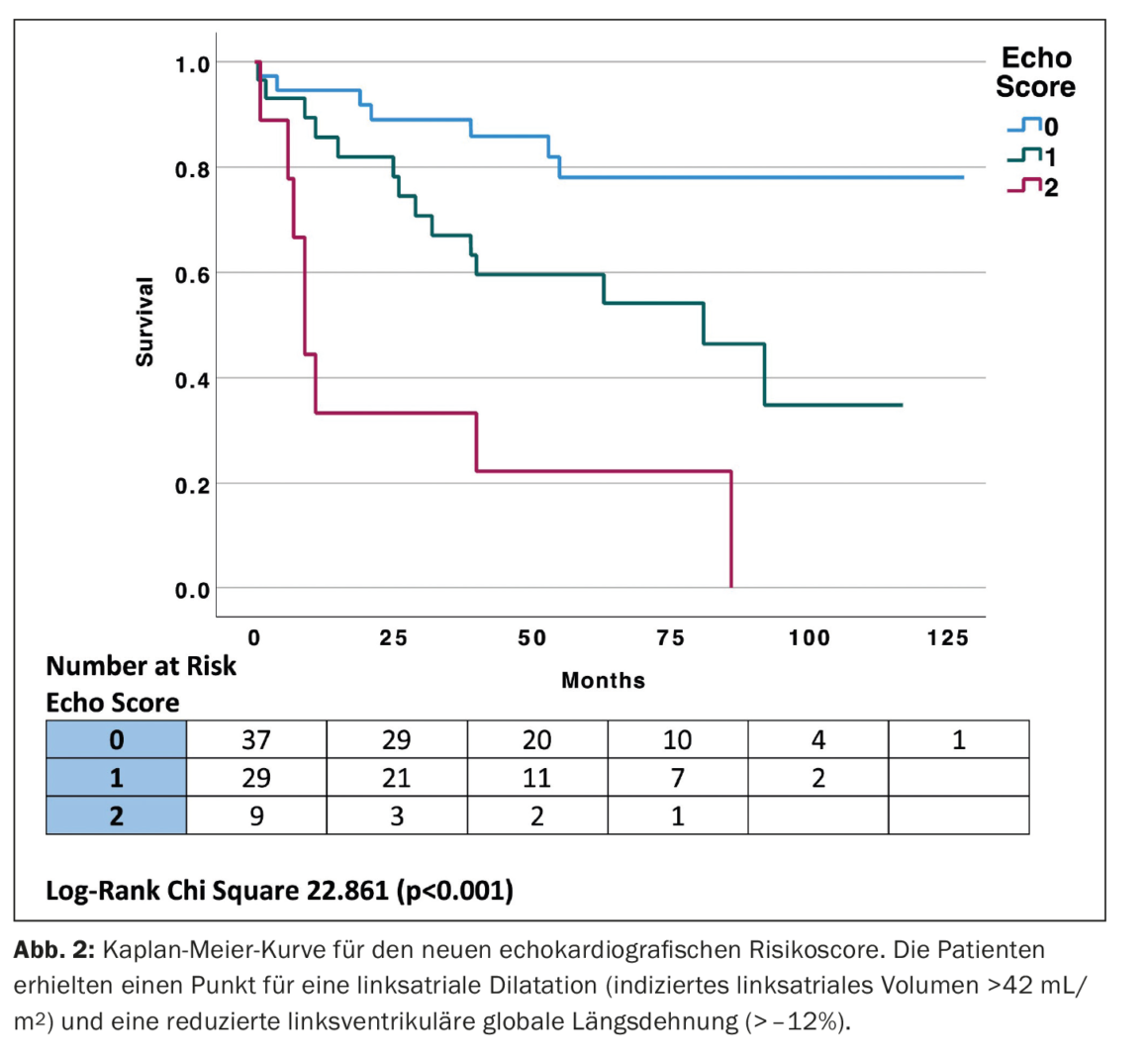
En utilisant les seuils cliniques pour la LVGLS et la LAVI pour créer un score échocardiographique simple, le groupe le plus à risque présentait à la fois une LVGLS (pire que -12%) et une LAVI (>42 mL/m2), le groupe à risque moyen avait LVGLS -12 à -16% et LAVI 34-42 mL/m2, et le groupe à risque le plus faible avait LVGLS meilleur que -16% ou LAVI <34 mL/m2. Un score de risque a ensuite été établi en attribuant un point pour chaque LVGLS inférieur à -12% et LAVI >34 mL/m2, ce qui a permis de classer les patients dans l’un des trois groupes. Le groupe le plus à risque avait à la fois LVGLS (pire que -12%) et LAVI (>42 mL/m2), le groupe à risque moyen avait soit un LVGLS inférieur à -12%, soit un LAVI >42 mL/m2 et le groupe à plus faible risque avait LVGLS meilleure que -12% et LAVI <42 mL/m2 avec respectivement deux, un et zéro points. Des courbes de Kaplan-Meier ont été établies pour le nouveau score de risque échocardiographique (score Echo) (Fig. 2) [1]. Le nouveau “score Echo” avait une performance pronostique similaire à celle du stade Mayo [AUC 0,745, intervalle de confiance (IC) à 95% 0,638-0,853 vs AUC 0,752, IC à 95% 0,645-0,858, p=0,911].
Prédiction de la mortalité totale comparable au système Mayo-Staging existant
La variabilité intra- et inter-observateurs du LAVI était excellente, avec un coefficient de corrélation intraclasse de 0,987 (IC à 95% : 0,946-0,997), tandis que le coefficient de corrélation inter-observateurs était de 0,935 (IC à 95% : 0,731-0,984). La LVGLS était également très reproductible, avec un coefficient de corrélation intraclasse de 0,989 (IC 95% 0,864-0,998), tandis que le coefficient de corrélation interobservateur était de 0,980 (IC 95% 0,924-0,995). La fraction d’éjection du ventricule gauche présentait une bonne variabilité intra- et inter-observateurs, avec un coefficient de corrélation intraclasse de 0,871 (IC à 95 % : 0,517-0,967) et un coefficient interobservateur de 0,772 (IC à 95 % : 0,115-0,943). Ces résultats montrent que l’imagerie cardiaque permet d’identifier les patients dont la mortalité est plus élevée, de sorte qu’une telle stratification du risque pourrait éventuellement conduire à la sélection de traitements optimaux.
Messages Take-Home
- Un simple paramètre échocardiographique, le LAVI, était un marqueur pronostique indépendant chez les patients atteints d’amylose AL.
- Le volume auriculaire gauche indexé et le LVGLS, stratifiés sur la base de valeurs de cut-off cliniques, ont montré des résultats moins bons avec un LVGLS moins bon et un LAVI croissant.
- Un score échocardiographique composite dérivé de LAVI et LVGLS a une valeur prédictive similaire à celle du staging Mayo.
Littérature :
- Genty P, et al.: A novel echocardiographic risk score for light-chain amyloidosis. Eur Heart J 2023; https://doi.org/10.1093/ehjopen/oead040.
- Kumar S, et al.: Revised prognostic staging system for light chain amyloidosis incorporating cardiac biomarkers and serum free light chain measurements. J Clin Oncol 2012; 30: 989–995.
- Cohen OC, Ismael A, Pawarova B, et al.: Longitudinal strain is an independent predictor of survival and response to therapy in patients with systemic AL amyloidosis. Eur Heart J 2021; 43: 333–341.
- Potter E, Marwick TH: Assessment of left ventricular function by echocardiography: the case for routinely adding global longitudinal strain to ejection fraction. JACC Cardiovasc Imaging 2018; 11: 260–274.
- Lang RM, et al.: Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28: 1–39.e14.
- Ommen SR, et al.: Clinical utility of Doppler echocardio-graphy and tissue Doppler imaging in the estimation of left ventricular filling pressures: a comparative simultaneous Doppler-catheterization study. Circulation 2000; 102: 1788–1794.
CARDIOVASC 2023; 22(2): 50–52
| Image de couverture : Micrographe à haute magnitude de l’amylose cardiaque sénile. Congo red stain. Spécimen d’autopsie. ©Wikimedia (Nephron) |