La stéatose hépatique non alcoolique est la maladie du foie la plus répandue dans le monde. La ligne directrice S2k allemande, mise à jour en 2022, recommande de dépister les patients à risque. L’algorithme de dépistage proposé prévoit l’évaluation de la fibrose et la détection de la stéatose comme éléments principaux et est largement en accord avec les recommandations de l’EASL. Les principaux piliers du traitement sont la modification du mode de vie et le contrôle des comorbidités.
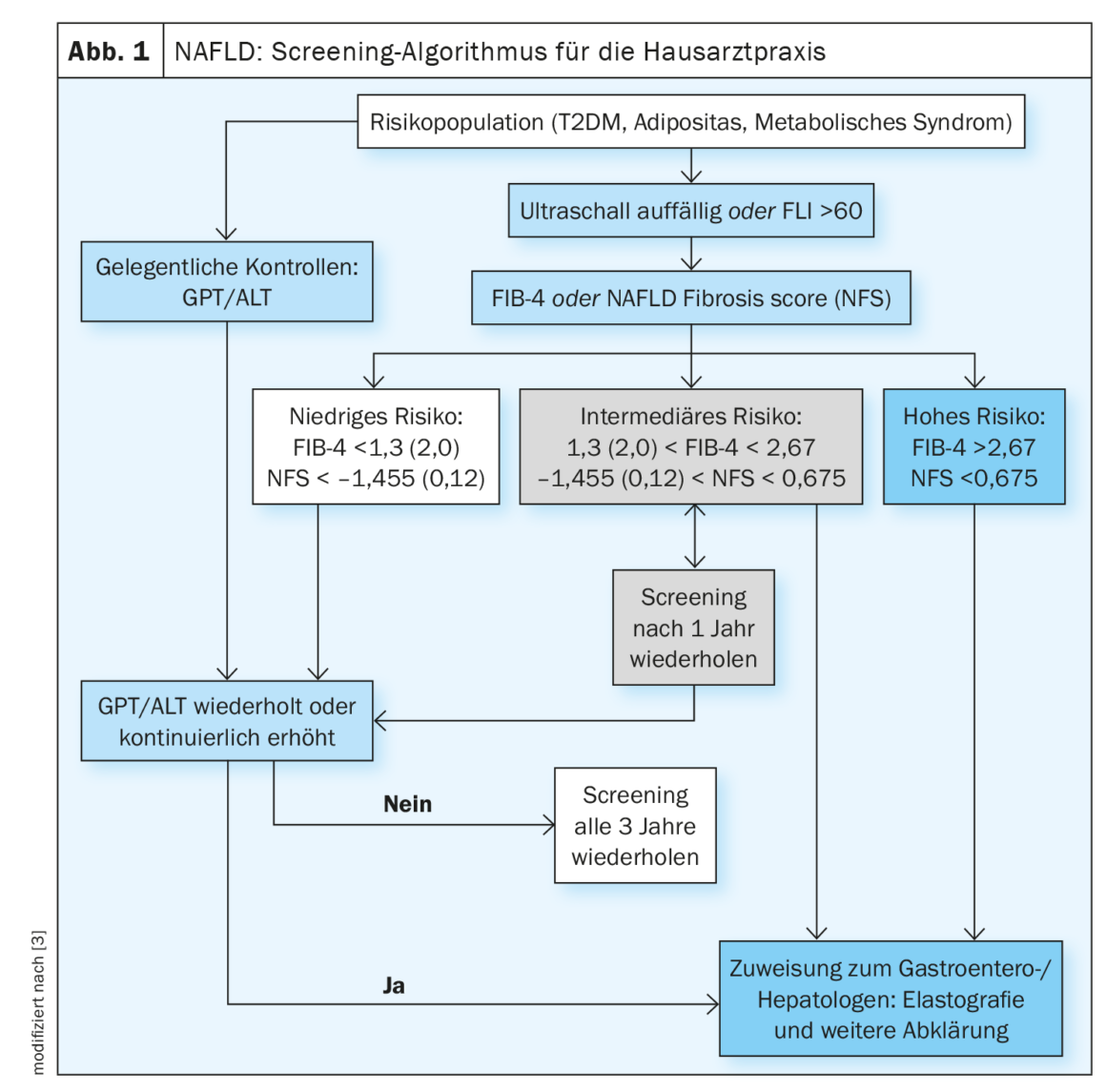
La stéatose hépatique non alcoolique est l’une des principales causes de complications et de décès liés au foie. Un taux de fibrose élevé est associé à un risque accru de complications. Une régression du remodelage cirrhotique est possible [1]. Une étude publiée en 2022 a montré qu’une amélioration de la fibrose hépatique pouvait réduire le risque de complications par 10 (HR, 0,08 ; IC à 95% : 0,02-0,32) [2]. L’algorithme de dépistage de la NAFLD proposé pour le setting des soins primaires (Fig. 1) comprend des scores tels que le quotient AST/ALT ou le FIB-4 [3]. Les patients qui présentent un ou plusieurs facteurs de risque de fibrose avancée doivent être dépistés : Âge >45-55 ans, diabète de type 2 (DT2), syndrome métabolique, obésité (IMC >30 kg/m²), hypertension artérielle [2,3]. Le DT2 et l’obésité sont des facteurs de risque indépendants pour le développement d’une fibrose liée à la NASH [4]. Chez les patients suspects de NAFLD, l’échographie transabdominale est la première méthode d’imagerie utilisée pour le dépistage.
En fonction du stade de fibrose, les patients atteints de NAFLD ont une mortalité liée au foie et une mortalité totale plus élevées que les témoins sains [5,6]. Les causes de décès cardiovasculaires sont les plus fréquentes [7,8].
Dans une analyse rétrospective de 619 patients atteints de NAFLD sur la période 1975-2005, avec un suivi médian de 12,6 ans, les maladies cardiovasculaires étaient la principale cause de décès (38%), suivies par les tumeurs non hépatiques (19%) et les complications de la cirrhose (8%) [9]. Des données similaires proviennent de deux études prospectives menées en Suède avec un suivi allant jusqu’à 33 ans : causes de décès cardiovasculaires 43% et 48%, tumeurs non hépatiques 23% et 22% et mortalité liée au foie 9% et 10% [10,11].
Dépistage de la progression de la fibrose chez les patients à risque
Le guide s2k propose de dépister les patients à risque tous les 2-3 ans à l’aide d’un algorithme qui correspond en grande partie à celui des Clinical Practice Guidelines de l’European Association for Study of the Liver (EASL) et à d’autres recommandations consensuelles pour les médecins généralistes et les diabétologues, mais qui est plus simple à utiliser (fig. 1) [3,12]. Le FLI (indice de foie gras) peut être utilisé pour déterminer de manière non invasive la teneur en graisse du foie. Les outils couramment utilisés pour la prédiction non invasive de la fibrose sont le FIB-4 et le score de fibrose NAFLD (NFS).
Le FIB-4 est facile à calculer à partir des valeurs de l’AST, de l’ALT, des plaquettes et de l’âge du patient. L’évaluation est basée sur deux valeurs limites : les patients avec une valeur <1,45 haben ein geringes Fibroserisiko, während Patienten mit einem Wert>2,67 ont un risque élevé de fibrose avancée [13].
Le score de fibrose de la NAFLD (NFS) peut être facilement calculé à partir de valeurs de laboratoire standard via un masque de saisie en ligne. Les paramètres suivants sont saisis pour le calcul : Âge, IMC, diabète oui/non, AST, ALT, plaquettes et albumine. Une valeur inférieure à -1,455 exclut une fibrose avancée avec une sensibilité de 90%. Un NFS >0,676 diagnostique une fibrose avancée avec une spécificité de 97% et une sensibilité de 67%.
Les deux scores étant largement basés sur des paramètres de routine, ils sont bien adaptés à une utilisation dans le cadre d’un dépistage. D’autres scores de fibrose non invasifs, tels que le rapport AST/plaquettes (AST/platelet ratio, APRI) ou le scoreBARD (BMI, AST/ALT ratio, and Diabetes)présentent de bonnes valeurs prédictives négatives et sont donc appropriés pour exclure une fibrose avancée.
La séquence du FLI (Fatty Liver Index) et du FIB-4 a été étudiée de manière spécifique pour le dépistage dans un groupe à risque de diabétiques de type 2 [14].
L’utilisation de seuils ajustés en fonction de l’âge peut être utile pour réduire la proportion élevée de personnes testées intermédiaires. La gestion des patients à risque intermédiaire fait l’objet de discussions et peut prendre différentes formes (re-dépistage ou orientation directe vers un hépatologue). Les études futures doivent montrer si de nouveaux marqueurs de substitution (par exemple NIS4, score FAST) ou des techniques d’imagerie comme l’élastographie par RM ou la RM-PDFF peuvent également être utilisés pour évaluer la progression individuelle de la fibrose et l’évolution de la NASH [15].
Les données du registre de la NAFLD fournissent des informations révélatrices
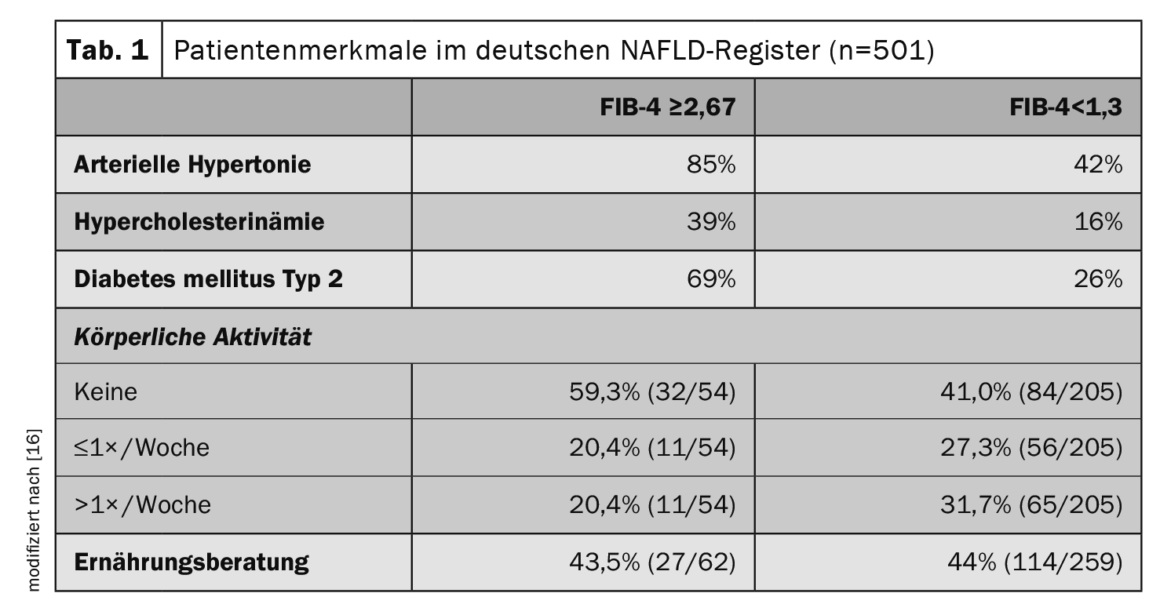
Les données des registres sont utiles pour en savoir plus sur les marqueurs de risque et les facteurs pronostiques associés à la NAFLD. Le registre allemand de la NAFLD est une étude prospective non interventionnelle menée par la Fondation allemande du foie pour décrire les caractéristiques cliniques et l’évolution de la maladie chez les patients atteints de NAFLD dans les structures de soins secondaires et tertiaires [16]. Sur 501 patients atteints de NAFLD (âge moyen 54 ans, 48% de femmes), 13% présentaient un risque élevé de fibrose avancée (indice FIB-4 ≥2,67) et 10% un diagnostic clinique de cirrhose du foie. Les statines ont été utilisées chez 22% de la population totale de l’étude, tandis que chez les diabétiques, la metformine, les agonistes du GLP-1 et les inhibiteurs du SGLT2 ont été utilisés respectivement chez 65%, 17% et 17%. Parmi les patients atteints de fibrose avancée (FIB-4 ≥2,67), 85% présentaient une hypertension artérielle, 69% un diabète de type 2 et 39% une hypercholestérolémie (tableau 1). Le contrôle des comorbidités métaboliques et les modifications du mode de vie (perte de poids et exercice physique) constituent le principal pilier du traitement de la NAFLD.
Congrès : mise à jour des pratiques
Littérature :
- “Foie”, Gastroentérologie, Prof Dr med. Andreas Stallmach, Praxis Update, Berlin, 28-29.04.2023.
- Sanyal AJ, et al : La régression de la cirrhose est associée à une amélioration des résultats cliniques chez les patients atteints de stéatohépatite non alcoolique. Hepatology 2022 ; 75 : 1235-1246.
- Roeb E, et al ; Collaborateurs : Mise à jour du guide S2k sur la stéatose hépatique non alcoolique de la Société allemande de gastroentérologie, maladies digestives et métaboliques (DGVS) – avril 2022 – numéro de registre AWMF : 021-025. Z Gastroenterol 2022 ; 60(9) : 1346-1421.
- Jarvis H, et al : Metabolic risk factors and incident advanced liver disease in non-alcoholic fatty liver disease (NAFLD) : A systematic review and meta-analysis of population-based observational studies. PLoS Med 2020 ; 17 : e1003100
- Dulai PS, et al : Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease : Systematic review and meta-analysis. Hepatology 2017 ; 65 : 1557-1565.
- Vilar-Gomez E, et al : La sévérité de la fibrose en tant que facteur déterminant de la mortalité liée à la cause chez les patients atteints de la maladie du foie gras non alcoolique avancée : une étude de cohorte multi-nationale. Gastroenterology 2018 ; 155 : 443-457.
- Younossi ZM, et al : Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology 2016 ; 64 : 73-84.
- Kim D, et al. : Association entre les marqueurs non invasifs de la fibrose et la mortalité chez les adultes atteints de maladie hépatique graisseuse non alcoolique aux États-Unis. Hepatology 2013 ; 57 : 1357-1365.
- Angulo P, et al : La fibrose hépatique, mais pas d’autres caractéristiques histologiques, est associée aux résultats à long terme des patients atteints de maladie du foie gras non alcoolique. Gastroenterology 2015 ; 149 : 389-397.e310
- Nasr P, et al : Histoire naturelle de la maladie hépatique graisseuse non alcoolique : une étude prospective de suivi avec des biopsies en série. Hepatol Commun 2018 ; 2 : 199-210.
- Ekstedt M, et al : Le stade de fibrose est le plus fort prédicteur de mortalité spécifique à la maladie dans la NAFLD après jusqu’à 33 ans de suivi. Hepatology 2015 ; 61 : 1547-1554.
- Berzigotti A, et al : EASL Clinical Practice Guidelines (Cpgs) On Non-Invasive Tests For Evaluation Of Liver Disease Severity And Prognosis- 2020 Update. J Hepatol 2021 ; DOI : 10.1016/j.jhep.2021.05.025.
- Kaswala DH, Lai M, Afdhal NH : Fibrosis Assessment in Nonalcoholic Fatty Liver Disease (NAFLD) in 2016. Dig Dis Sci 2016 ; 61 : 1356-1364.
- Ciardullo S, et al : Screening for non-alcoholic fatty liver disease in type 2 diabetes using non-invasive scores and association with diabetic complications. BMJ Open Diabetes Res Care 2020 ; 8.
DOI: 10.1136/bmjdrc-2019-000904. - Loomba R, et al : Multicenter Validation of Association Between Decline in MRI-PDFF and Histologic Response in NASH. Hépatologie 2020 ;
DOI : 10.1002/hep.31121. - Geier A, et al. : Caractéristiques cliniques des patients atteints de la maladie hépatique graisseuse non alcoolique (NAFLD) en Allemagne – Premières données du registre allemand de la NAFLD. Journal de gastroentérologie 2023 ; 61 : 60-70.
| Image de couverture : Micrograph of non-alcoholic fatty liver disease (NAFLD). Trichrome de Masson & tache de Verhoeff. Auteur : Nephron, wikimedia |
HAUSARZT PRAXIS 2023; 18(7): 28–29