Quelle est l’importance de la douleur pour les patients souffrant de SpA?.
– Contenu sponsorisé –
La PsA et l’axSpA ont de nombreux symptômes en commun, y compris la douleur, qui peut representer une charge physique et émotionnelle considérable pour les patients atteints de SpA.5
Les patients et les rhumatologues s’accordent à dire que les douleurs articulaires sont un facteur important de la gravité de la maladie.6
Dans cet article, nous explorons comment Taltz® peut rapidement améliorer les symptômes de la douleur chez les patients atteints de PsA et d’axSpA et comment cet effet peut être maintenu.1-4
Regardez une courte vidéo dans laquelle le Prof. Carlo Selmi explique comment Taltz peut soulager la douleur chez les patients atteints de PsA et d’axSpA.
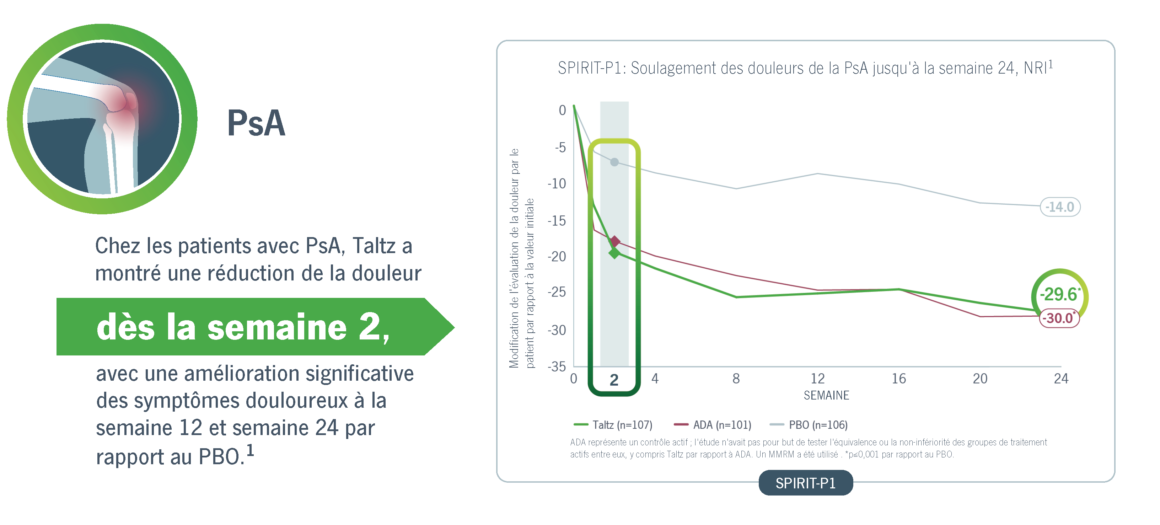
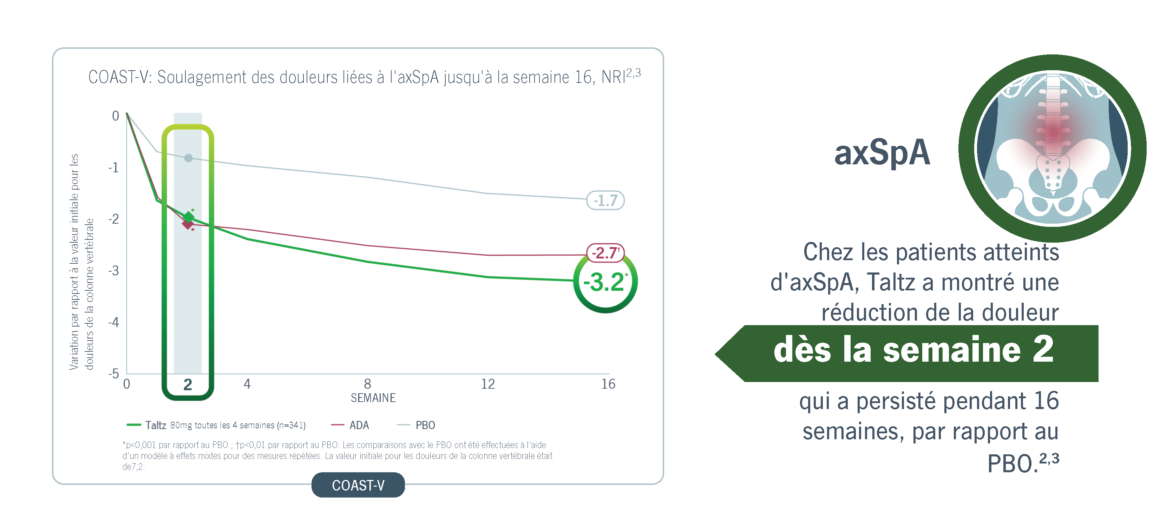
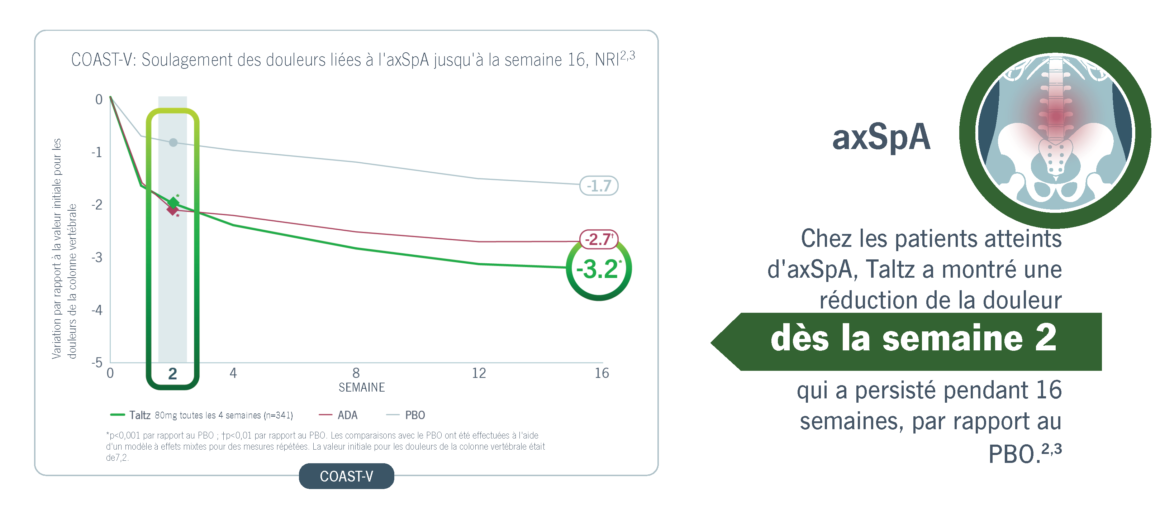
Taltz a obtenu une amélioration significative et rapide de la douleur chez les patients atteints de PsA et d’axSpA.

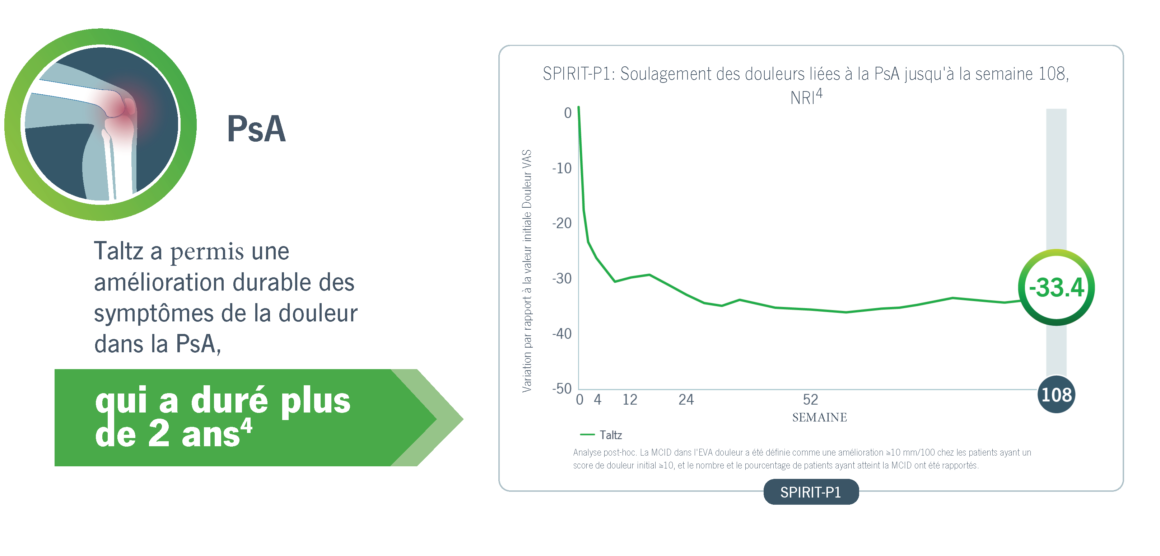
Taltz a entraîné une amélioration durable des symptômes douloureux dans la PsA et l’axSpA.4

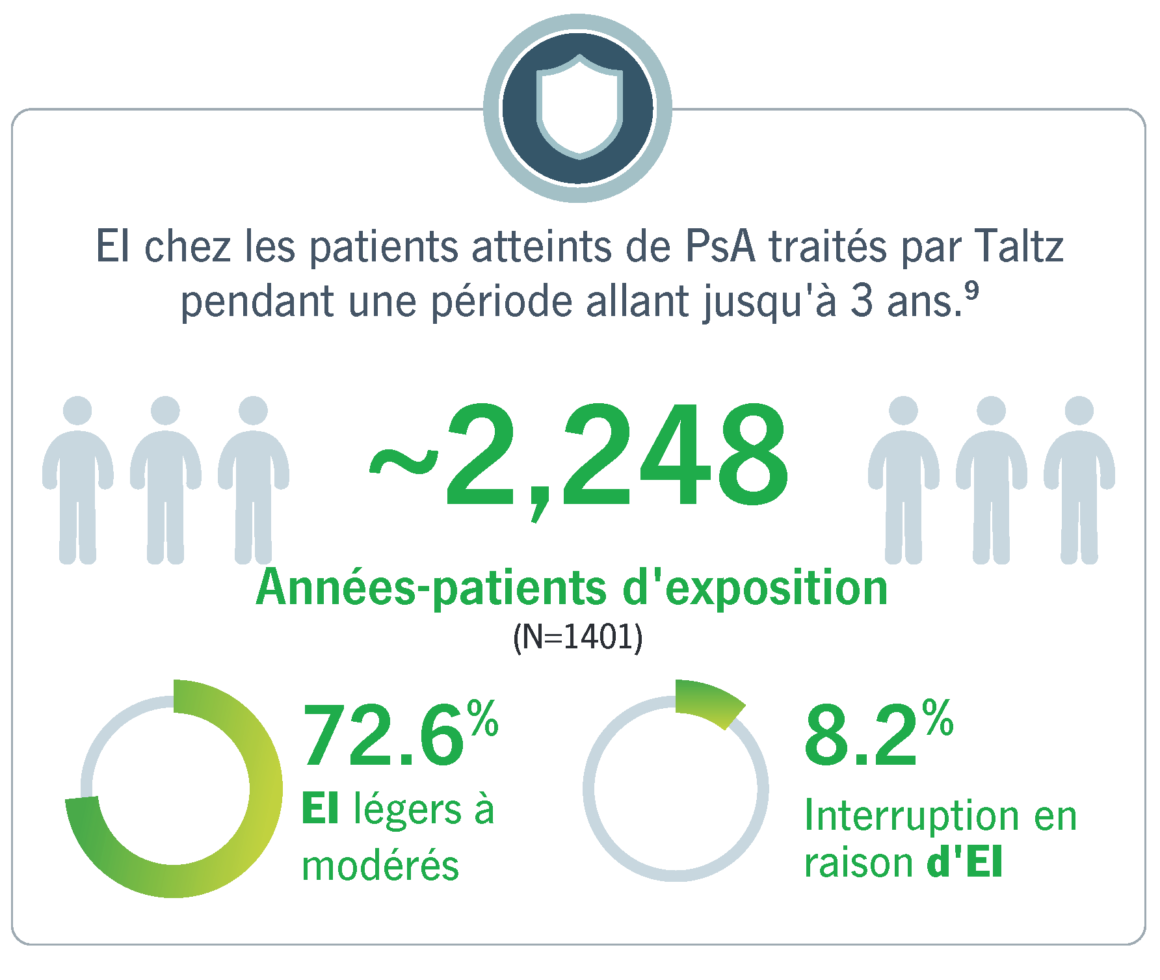
21 études cliniques menées sur Taltz® confirment le profil de sécurité favorable de cet inhibiteur de l’IL-17A8
Le profil de sécurité de Taltz a été évalué
dans 21 études cliniques pour toutes les indications chez
>8,000 Patients avec
>20,000 années-patients d’exposition.8
Chez les patients atteints d’ une PsA active et traités par Taltz pendant une période de 3 ans maximum, la majorité des EIST étaient légers à modérés.9 Les EIST les plus fréquemment rapportés étaient la rhinopharyngite et les infections des voies respiratoires supérieures.9 Le profil général de sécurité et la tolérance de Taltz chez les patients atteints de PsA étaient conformes au profil de sécurité connu de Taltz. 9,10
- La douleur des patients avec PsA et axSpA entraîne un stress physique et émotionnel considérable.5
- Taltz agit contre les symptômes de la douleur dans la PsA et l’axSpA et offre un soulagement rapide et durable pour aujourd’hui et demain.1-4
- Taltz a un profil de sécurité bien établi.9
Indications10
Arthrite psoriasique (PsA): Taltz®, seul ou en association avec des antirhumatismaux modificateurs de la maladie (DMARD, disease-modifying anti-rheumatic drugs) conventionnels, est indiqué chez les patients adultes atteints d’arthrite psoriasique (PsA) active n’ayant pas suffisamment répondu à un traitement par un ou plusieurs DMARD ou ne l’ayant pas toléré.
Spondylarthrite axiale (axSpA): spondylarthrite ankylosante (maladie de Bechterew): Taltz® est indiqué dans le traitement de la spondylarthrite ankylosante active sévère chez les patients adultes n’ayant pas suffisamment répondu à une thérapie conventionnelle (par ex. anti-inflammatoires non stéroïdiens [AINS]) ou ne la tolérant pas.
Spondylarthrite axiale non radiographique: Taltz® est indiqué dans le traitement de la spondylarthrite axiale non radiographique active sévère chez les patients adultes qui ont répondu de manière inadéquate aux AINS. Les patients doivent présenter des signes objectifs d’inflammation comme indiqué par l’imagerie par résonance magnétique (IRM) et par un taux élevé de protéine C-réactive (CRP).
Abbbréviations
ACR20, American College of Rheumatology 20% response; ADA, Adalimumab; ADR, adverse drug reaction; EI, événement indésirable; AS, Ankylosierende Spondylitis; ASAS40, Assessment of Spondyloarthritis International Society response criteria, ≥40% improvement; (nr/r)-axSpA, Spondylarthrite axiale non-radiographique/
radiographique; CRP, protéine C-réactive; DMARD, disease-modifying antirheumatic drug; MCID, minimal clinically important difference; MMRM, mixed-effects model for repeated measures; IRM, imagerie par résonance magnétique; MTX, Methotrexate; NRI, non-responder imputation; NSAID, nonsteroidal anti-inflammatory drugs; PBO, placebo; PsA, Arthrite psoriasique; SpA, Ankylosierende Spondylitis; EIST, événements indésirables survenus pendant le traitement; VAS, visual analogue scale.
Taltz® (ixekizumab) solution injectable
I: Traitement du psoriasis en plaques modéré à sévère chez les patients adultes et chez les enfants et les adolescents dès 6 ans ayant un poids corporel d’au moins 25 kg, qui n’ont pas répondu à d’autres traitements systémiques (y compris la ciclosporine ou le méthotrexate ou la puvathérapie) ou qui ne peuvent pas les suivre en raison de contre-indications ou d’intolérance. Seul ou en association avec des antirhumatismaux modificateurs de la maladie (DMARD) conventionnels, traitement de l’arthrite psoriasique active chez les patients adultes n’ayant pas suffisamment répondu à un traitement par un ou plusieurs DMARDs ou ne l’ayant pas toléré. Traitement de la spondylarthrite ankylosante active sévère chez les patients adultes n’ayant pas suffisamment répondu à une thérapie conventionnelle (par ex. anti-inflammatoires non stéroïdiens [AINS]) ou ne la tolérant pas. Traitement de la spondylarthrite axiale non radiographique active sévère chez les adultes qui ont répondu de manière inadéquate aux AINS. Les patients doivent présenter des signes objectifs d’inflammation comme indiqué par l’imagerie par résonance magnétique (IRM) et une élévation de la protéine C-réactive (CRP).
Po: Injection sous-cutanée. Psoriasis en plaques chez l’adulte : 160 mg à la semaine 0, suivie de 80 mg aux semaines 2, 4, 6, 8, 10 et 12, puis 80 mg toutes les 4 semaines. Chez les patients <100 kg, un schéma posologique alternatif avec 160 mg à la semaine 0 et dès la semaine 2, 80 mg toutes les 4 semaines peut être pris en considération. Psoriasis en plaques chez les enfants et les adolescents (dès 6 ans) : Poids > 50 kg : 160 mg à la semaine 0, suivie de 80 mg toutes les 4 semaines ; poids 25-50 kg : 80 mg à la semaine 0, suivie de 40 mg toutes les 4 semaines. Arthrite psoriasique : 160 mg à la semaine 0, suivie de 80 mg toutes les 4 semaines.Spondylarthrite ankylosante : 80 mg toutes les 4 semaines.
CI : Hypersensibilité sévère. Infections actives graves (p.ex. tuberculose active, sepsis, infection opportuniste grave).
Pr/MG: Prudence chez les patients atteints d’une infection chronique ou active ou ayant des antécédents d’infections récidivantes. En cas de réaction d’hypersensibilité grave, l’administration de Taltz doit être interrompue immédiatement et un traitement approprié instauré. Taltz n’est pas recommandé chez les patients atteints de maladie inflammatoire de l’intestin. Si un patient développe des signes et symptômes de maladie inflammatoire de l’intestin ou d’exacerbation d’une maladie inflammatoire de l’intestin préexistante, Taltz doit être interrompu et un traitement médical approprié doit être initié. Prudence en cas de comorbidité psychiatrique (p.ex. dépression). Prudence chez les patients atteints de axSpa et à risque de MACE. Taltz ne doit pas être utilisé avec des vaccins vivants. L’administration concomitante de Taltz avec d’autres médicaments biologiques n’est pas recommandée.
IA: La sécurité de Taltz en association avec d’autres agents immunomodulateurs ou de la photothérapie ainsi qu’avec des vaccins vivants n’a pas été étudiée.
G/A : Pendant la grossesse et chez les femmes en âge de procréer qui n’utilisent pas de contraception efficace, Taltz ne doit pas être administré, à moins d’une nécessité absolue. Les patientes doivent être informées d’utiliser des méthodes contraceptives efficaces et de ne pas allaiter pendant au moins 10 semaines après la dernière dose de Taltz. Il convient de décider soit d’arrêter l’allaitement, soit d’interrompre le traitement par Taltz en tenant compte du bénéfice de l’allaitement pour l’enfant et de celui du traitement pour la mère.
EI: Très fréquent: infection des voies respiratoires supérieures, réactions au site d’injection. Fréquent : infection fongique à dermatophytes (teigne), herpès simplex (mucocutané), candidose buccale, rhinite, grippe, conjonctivite, douleurs oropharyngées, nausées, diarrhée, enzymes hépatiques élevées, urticaire. Occasionnel : réactions anaphylactiques, candidose oesophagienne, neutropénie, thrombocytopénie, maladie de Crohn, colite ulcéreuse. EI qui ont été observés plus fréquemment que chez les adultes ou sont survenus spécifiquement chez les enfants et les adolescents: Très fréquent: réactions d’hypersensibilité. Fréquent : neutropénie, maladie de Crohn, dermatite, rash, eczéma, fièvre. Occasionnel : bronchospasme.
P: Taltz 80 mg 1 ou 2 stylo(s) prérempli(s) / 1 ou 2 seringue(s) préremplie(s). Catégorie de remise B. Pour de plus amples informations, consulter www.swissmedicinfo.ch.
Eli Lilly (Suisse) SA, ch. des Coquelicots 16, CP 580, 1214 Vernier (GE). V08-2023
Les professionnels peuvent demander les références à l’entreprise à tout moment.
Références
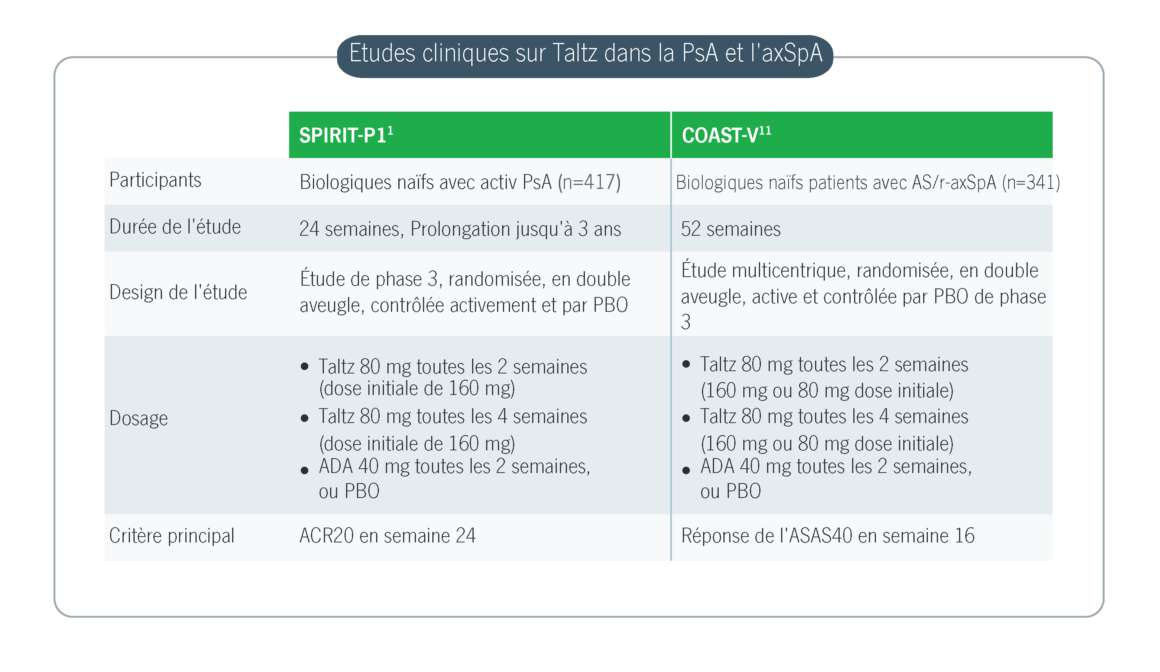
- Mease P.J. et al. Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic-naive patients with active psoriatic arthritis: results from the 24-week randomised, double-blind, placebo-controlled and active (adalimumab)-controlled period of the phase III trial SPIRIT-P1. Ann Rheum Dis. 2017; 76(1):79-87.
- Deodhar A.A. et al. Ixekizumab improves spinal pain, function, fatigue, stiffness, and sleep in radiographic axial Spondyloarthritis: COAST-V/W 52-week results. BMC Rheumatol. 2021; 5(1):35.
- Mease P. et al. Translating Improvements with Ixekizumab in Clinical Trial Outcomes into Clinical Practice: ASAS40, Pain, Fatigue, and Sleep in Ankylosing Spondylitis. Rheumatol Ther. 2019 Sep;6(3):435-450.
- Orbai A.M. et al. Rapid and sustained improvements in patient-reported signs and symptoms with ixekizumab in biologic-naive and TNF-inadequate responder patients with psoriatic arthritis. Clin Exp Rheumatol. 2021; 39(2):329-336.
- Mease PJ, Liu M, Rebello S, Kang H, Yi E, Park Y, Greenberg JD. Comparative Disease Burden in Patients with Rheumatoid Arthritis, Psoriatic Arthritis, or Axial Spondyloarthritis: Data from Two Corrona Registries. Rheumatol Ther. 2019; 6(4):529-542.
- Richette P. et al. Are Patients´ and Rheumatologists´ perceptions of the burden and treatment of psoriatic arthritis aligned? Results from the uplift survey. Annals of the Rheumatic Diseases 2022;81:404-405. Poster POS0309 presented at EULAR 2022, Jun 1-4, Copenhagen, Denmark.
- Tillett W. et al. Disease Characteristics and the Burden of Joint and Skin Involvement Amongst People With Psoriatic Arthritis: A Population Survey. Rheumatol Ther. 2020; 7(3):617-637.
- Genovese M.C. et al. Safety of ixekizumab in adult patients with plaque psoriasis, psoriatic arthritis and axial spondyloarthritis: data from 21 clinical trials. Rheumatology (Oxford). 2020; 59(12):3834-3844.
- Deodhar A.A. et al. Safety of ixekizumab in patients with psoriatic arthritis: data from four clinical trials with over 2000 patient-years of exposure. Ann Rheum Dis. 2022;81(7):944-950.
- Taltz® Fachinformation, www.swissmedicinfo.ch.
- van der Heijde D. et al. Ixekizumab, an interleukin-17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease-modifying anti-rheumatic drugs (COAST-V): 16 week results of a phase 3 randomised, double-blind, active-controlled and placebo-controlled trial. Lancet. 2018;392(10163):2441-2451.
Ce contenu a été développé, organisé et financé par Eli Lilly and Company. Destiné exclusivement aux professionnels de la santé de Suisse. Les professionnels peuvent demander les références à l’entreprise à tout moment.

Pour plus d’informations sur nos produits Lilly & nos domaines thérapeutiques, veuillez contacter notre service d’information médicale:
Heures de service: lundi-vendredi, 09:00-17:00 heures
Téléphone: +41 44 654 57 52
E-Mail: ch_medinfo@lilly.com
© 2023 Eli Lilly (Suisse) SA,
Chemin des Coquelicots 16, P.O. 580, CH-1214 Vernier.
Tous droits réservés.
PP-IX-CH-0990/08.2023


