Une utilisation parcimonieuse et ciblée des antibiotiques contribue à minimiser le risque de résistance aux antibiotiques. Chaque administration d’antibiotiques laisse en outre des dommages collatéraux dans notre microbiome. En règle générale, le traitement doit être aussi court que nécessaire et aussi fortement dosé que possible.
Les antibiotiques ont contribué à rendre traitables des maladies infectieuses autrefois graves et souvent mortelles, qui ont ainsi perdu leur caractère effrayant d’antan. Ainsi, par rapport à l’ère pré-antibiotique, la mortalité due à la pneumonie a été réduite d’environ 23% à environ 7%, celle due à l’endocardite de 100% à 25% et celle due à la méningite bactérienne de >80% à <20% [1]. L’introduction des antibiotiques a donné une impulsion au développement de la médecine moderne de pointe. Sans antibiotiques efficaces, les soins intensifs, la chirurgie, notamment les endoprothèses et les transplantations, ainsi que les chimiothérapies ne sont pas envisageables [2].
Résistance aux antibiotiques
Après l’introduction d’un nouvel antibiotique, il ne faut généralement que quelques années pour que les bactéries y deviennent résistantes. Les antibiotiques exercent une pression de sélection sur les variantes bactériennes résistantes préexistantes, qui ont ainsi un avantage de survie sur les bactéries sensibles et sont enrichies.
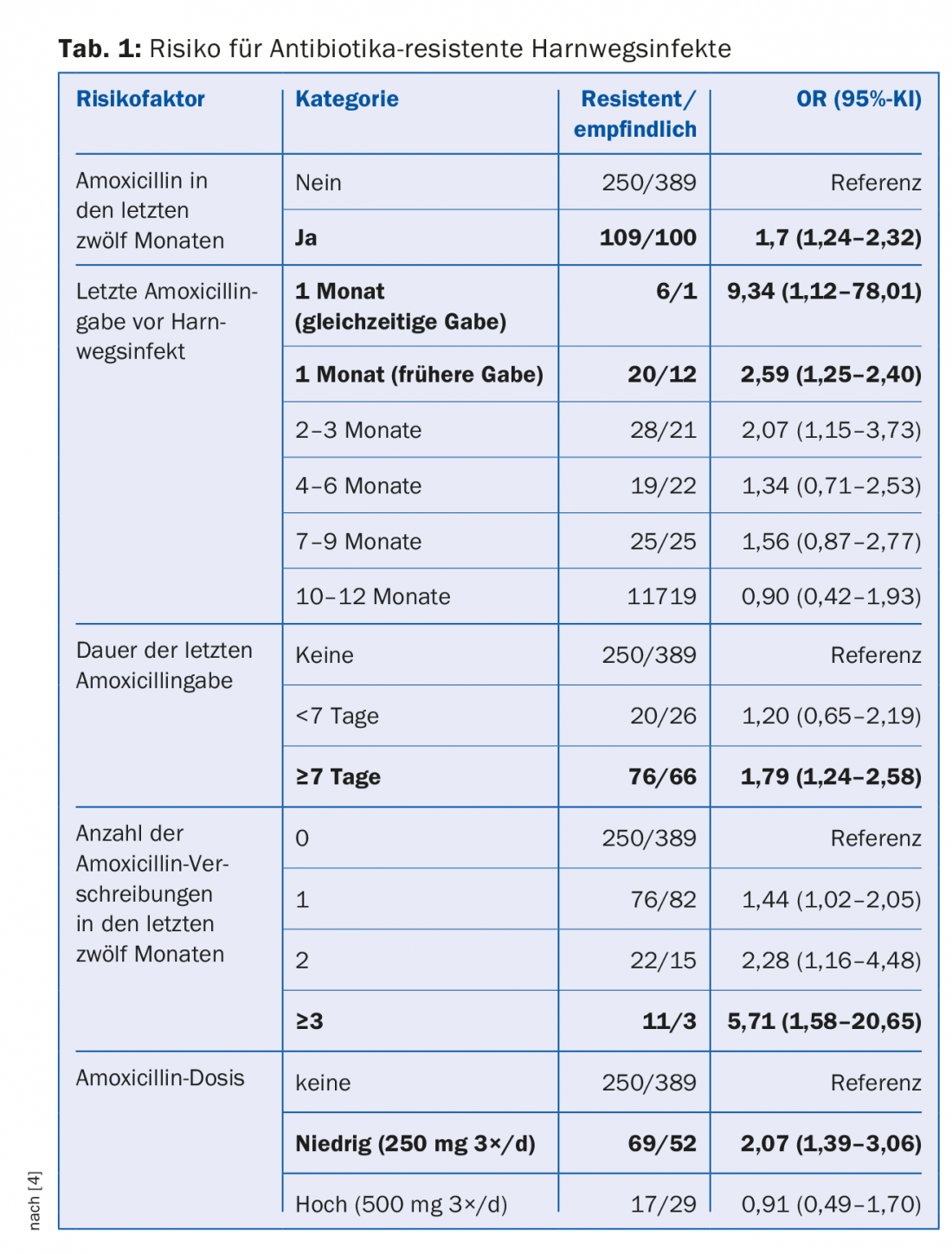
La résistance aux antibiotiques existe dans la nature depuis des millions d’années, mais c’est clairement l’utilisation d’antibiotiques dans l’agriculture et la médecine, donc en fin de compte l’homme, qui en est le moteur. Plus les antibiotiques sont prescrits dans une population, plus le risque de bactéries résistantes aux antibiotiques est élevé [3]. Une étude cas-témoins portant sur des patients souffrant d’infections urinaires a mis en évidence plusieurs facteurs de risque : administration fréquente d’antibiotiques, longue durée du traitement, faible dose (tableau 1) [4]. Le risque de colonisation par des pneumocoques résistants à la pénicilline a augmenté de 4% chez les enfants australiens chaque jour où ils ont reçu des antibiotiques β-lactamines au cours des six derniers mois [5]. Environ 60 à 90% des antibiotiques humains sont prescrits dans le secteur ambulatoire, dont environ 75 à 85% pour des infections respiratoires souvent virales. Cependant, environ 80% de tous les antibiotiques sont utilisés dans le monde entier dans l’élevage, principalement comme “promoteur de croissance” pour l’engraissement du bétail.
La résistance aux antibiotiques peut apparaître et se propager de différentes manières. Ils peuvent être intrinsèques (c’est-à-dire qu’une bactérie est toujours résistante à cet antibiotique), apparaître de novo par mutation spontanée et être sélectionnés en raison de la pression de sélection exercée par l’antibiotique, être transmis d’une bactérie à une autre par transfert horizontal de gènes (par exemple au moyen de plasmides sur lesquels se trouvent souvent différents gènes de résistance en même temps) et également être transmis entre patients par une mauvaise hygiène (des mains).
La résistance aux antibiotiques a des conséquences importantes telles qu’une augmentation de la mortalité, une prolongation de la durée d’hospitalisation et une hausse des coûts (aperçu 1). Selon de sombres prévisions, les infections dues à des agents pathogènes résistants aux antibiotiques devraient passer d’environ 25 000 décès dans l’UE et environ 700 000 dans le monde en 2014 à jusqu’à 390 000 ou 10 millions en 2050. On craint ainsi un retour à une ère préantibiotique avec des infections non traitables – déjà une réalité dans de nombreux pays – et des coûts indirects inimaginables de 100 000 milliards de dollars (amr-review.org).

En Suisse, les données sur la résistance aux antibiotiques sont collectées par le biais d’une surveillance nationale et peuvent être consultées sur www.anresis.ch dans une base de données interactive. Dans ce domaine, les résultats obtenus pour endiguer le Staphylococcus aureus résistant à la méthicilline (SARM) sont remarquables. Moins de 3% des pneumocoques sont résistants à la pénicilline, notamment grâce à la vaccination antipneumococcique chez les enfants. Malheureusement, la résistance aux antibiotiques des agents pathogènes à Gram négatif ne cesse de se propager, notamment à cause des bêtalactamases à spectre étendu (BLSE), qui sont de plus en plus responsables d’infections abdominales et urinaires. Ainsi, à l’échelle nationale, environ 10% de toutes les Escherichia coli sont formatrices de BLSE et environ 20% sont résistantes à la ciprofloxacine.
Effets des antibiotiques sur le microbiome
Outre la sélection de la résistance, les effets secondaires indésirables, les réactions allergiques et le coût des médicaments, chaque utilisation d’antibiotiques a un impact pertinent, pouvant durer jusqu’à plusieurs années, sur notre microbiote (ensemble des organismes présents dans notre corps) et notre microbiome (microbiote ainsi que son génome) [6]. La prédisposition à la diarrhée associée à Clostridium difficileaprès les antibiotiques est la plus connue, mais les antibiotiques augmentent également le risque, entre autres, de septicémie en cours d’évolution, de développement de l’obésité, du diabète sucré, de l’asthme et des allergies [7]. L’influence la plus importante concerne le microbiote en développement de l’enfant, c’est pourquoi il faut veiller à utiliser les antibiotiques de la manière la plus restrictive possible, en particulier chez les femmes enceintes et les enfants (surtout au cours des deux premières années de leur vie) [8].
Ce sont surtout les bactéries anaérobies de la flore locale du côlon qui contribuent à la résistance à la colonisation par des agents pathogènes, ce qui explique qu’une antibiothérapie dirigée contre les anaérobies prédispose à d’autres infections. Il est intéressant d’observer qu’après un voyage en zone d’endémie, le risque de nouvelle colonisation par des entérobactéries multirésistantes était deux fois plus élevé chez les personnes ayant eu une diarrhée pendant le voyage et plus de quatre fois plus élevé chez les personnes ayant pris un antibiotique β-lactame pendant le voyage (dysbiose de la flore intestinale) par rapport aux voyageurs en bonne santé [9]. C’est un argument important contre une antibioprophylaxie trop généreuse contre la diarrhée du voyageur.
Règles de base pour l’utilisation des antibiotiques
Les aspects suivants doivent être pris en compte lors de tout traitement antibiotique :
Indication : toute administration d’antibiotiques doit être strictement indiquée. Pour cela, l’utilisation de biomarqueurs peut être utile. Étant donné que le risque d’infection bactérienne est corrélé au niveau de procalcitonine (PCT), l’utilisation d’algorithmes de PCT permet, sans risque accru de complications, de réduire la consommation d’antibiotiques de 35 à 45 % chez les patients souffrant d’exacerbation de broncho-pneumopathie chronique obstructive (BPCO) et d’environ 65 % chez les personnes souffrant d’infections des voies respiratoires supérieures [10]. Les antibiotiques doivent être évités chez les patients présentant des symptômes typiquement viraux lors d’infections des voies respiratoires supérieures ou de bronchites aiguës (conjonctivite, rhinite, arthralgie, exanthème). Une étude britannique a montré qu’une utilisation restrictive des antibiotiques pour les infections respiratoires hautes permettait d’économiser plus de 2000 prescriptions d’antibiotiques sur dix ans dans un cabinet médical accueillant 7000 patients par an [11]. Les complications redoutées sont très rares (environ dix épisodes de pneumonie et moins d’un abcès péritonéal sur dix ans). Il convient de noter que les voies respiratoires supérieures et inférieures ne sont pas stériles et que, par conséquent, la détection de bactéries n’indique pas automatiquement une antibiothérapie.
La bactériurie asymptomatique ne doit être recherchée qu’en cas de grossesse et avant une intervention urologique avec lésion de la muqueuse, et ne doit être traitée par antibiotiques que dans ce cas. Sinon, l’antibiothérapie en cas de bactériurie asymptomatique est associée à un risque accru de pyélonéphrite (probablement à nouveau via une dysbiose du microbiote) et à un développement accru de résistances [12,13]. Il en va de même pour les porteurs de cathéters permanents asymptomatiques, qui ont un taux de colonisation d’environ 8%/j, qui ne devrait pas conduire à une antibiothérapie en l’absence de symptômes clairs.
La sinusite aiguë a généralement une étiologie virale. Seuls 0,5 à 2% des adultes et jusqu’à 5% des enfants développent une surinfection bactérienne. Les antibiotiques ne sont recommandés qu’en cas de symptômes persistants ou d’absence d’amélioration après au moins dix jours, de symptômes sévères (fièvre ≥39°C ou crachats purulents) pendant au moins trois à quatre jours ou d’aggravation ou d’évolution biphasique après au moins trois à quatre jours. Le traitement de choix est l’amoxicilline 1 g toutes les huit heures pendant cinq à sept jours, éventuellement l’amoxicilline/acide clavulanique 1 g toutes les douze heures pendant cinq à sept jours en cas d’évolution sévère ou de facteurs de risque.
Une antibiothérapie immédiate n’est indiquée qu’en cas d’otite moyenne aiguë (OMA) bilatérale chez les enfants de moins de deux ans ou en cas d’OMA perforée. Sinon, une “attente vigilante” de 24 à 48 heures chez les enfants de moins de deux ans et de 48 à 72 heures chez les personnes de plus de deux ans est recommandée, car l’antibiothérapie a peu d’effet sur la durée des symptômes ou le taux de complications dans le cas d’une OMA généralement virale au départ. Le traitement de choix est l’amoxicilline, et en cas de récidive ou d’absence de réponse après 72 heures, l’amoxicilline/acide clavulanique.
Chez les patients de plus de trois ans, si une pharyngite non virale est suspectée, le score de Centor (un point pour chaque exsudat sur les amygdales ; fièvre >38°C ; ganglions lymphatiques cervicaux antérieurs douloureux et gonflés ; absence de toux) doit être calculé. Ce n’est que si celui-ci donne ≥3 points qu’un test rapide pour Streptococcus pyogenes doit être effectué. Et ce n’est que si celui-ci est positif qu’une antibiothérapie doit être commencée dans les neuf jours afin de minimiser le risque de fièvre rhumatismale aiguë. Le traitement de choix est l’amoxicilline 1 g toutes les douze heures pendant six jours (jusqu’à présent, S. pyogenes est toujours sensible à la pénicilline, mais l’amoxicilline a une biodisponibilité plus élevée que la pénicilline).
Plusieurs études récentes ont montré qu’en cas de diverticulite aiguë non compliquée, l’antibiothérapie n’est pas meilleure que le placebo en termes de soulagement des symptômes, de taux de complications, de nécessité d’une intervention chirurgicale et de taux de récidive [14].
En cas de gastro-entérite aiguë (diarrhée avec vomissements/diarrhée aqueuse) sans fièvre avec/sans antécédents de voyage, un traitement symptomatique est généralement suffisant. Les antibiotiques ne doivent être utilisés qu’en cas de diarrhée sanglante ou fébrile ou de toxicité systémique.
Spectre pathogène : toute antibiothérapie empirique doit tenir compte du spectre pathogène attendu. Il s’agit de traiter aussi bien les agents pathogènes les plus fréquents que les agents pathogènes parfois rares mais associés à une évolution particulièrement grave. Selon l’infection, un diagnostic microbiologique des agents pathogènes est indiqué. Si un agent pathogène est détecté, le traitement doit être réduit (désescalade). Ceci est fait en particulier pour minimiser les dommages collatéraux possibles sur le microbiome ainsi que la sélection de la résistance aux antibiotiques. Par exemple, il a été montré que les patients atteints de pneumonie bactériémique à pneumocoques avaient une mortalité plus faible lorsqu’ils étaient désescaladés vers une monothérapie à base de pénicilline ou d’amoxicilline au cours de l’évolution [15].
Mode d’administration : les antibiotiques à biodisponibilité orale élevée doivent être administrés principalement par voie orale, par exemple le triméthoprime-sulfaméthoxazole, le métronidazole, la clindamycine, les quinolones. Les exceptions sont les patients dont l’absorption entérale est compromise ou les infections nécessitant des taux très élevés au site d’action (par ex. infections très graves, infections endovasculaires, infections osseuses initiales, infections du SNC).
Posologie : La dose dépend de la concentration minimale inhibitrice (CMI) de l’agent pathogène, de la charge bactérienne, de la gravité de l’infection, des niveaux tissulaires attendus (généralement faibles dans la prostate, le SNC) et de la marge thérapeutique de l’antibiotique (élevée pour les antibiotiques β-lactames, faible pour les aminoglycosides). La dose initiale doit être aussi élevée que possible, car c’est là que la charge bactérienne est la plus élevée et qu’une dose de charge est souvent nécessaire pour atteindre le plus rapidement possible des niveaux d’efficacité suffisants. Les doses optimales sont souvent plus élevées que celles recommandées dans le Compendium (voir par exemple www.guidelines.ch). En cas d’insuffisance hépatique ou rénale, un allongement de l’intervalle peut être nécessaire, mais la dose de charge reste la même. Les antibiotiques β-lactamines (pénicillines, céphalosporines) ont un effet dépendant du temps, pour lequel le niveau d’action doit être maintenu le plus longtemps possible au-dessus de la CMI de l’agent pathogène grâce à des doses aussi fréquentes que possible (intervalles courts). En revanche, les macrolides, les aminoglycosides ou les quinolones agissent en fonction de la concentration et obtiennent un effet optimal à des pics de concentration élevés. Pour ces antibiotiques, il convient d’administrer une dose aussi élevée que possible avec un long intervalle entre les doses.
Durée : la durée de la thérapie doit être aussi longue que nécessaire et aussi courte que possible. L’objectif est de réduire au maximum la pression de sélection pour l’émergence et la propagation de la résistance aux antibiotiques. Ce concept est également de plus en plus pris en compte au niveau international et les durées de traitement courtes sont désormais bien établies pour la majorité des infections qui intéressent les médecins généralistes. Il convient de mentionner deux très bons articles de synthèse [16,17]. Le site 2 en donne un aperçu.

Antécédents d’allergie : de toutes les allergies aux antibiotiques, l’allergie à la pénicilline est la plus fréquemment rapportée par les patients. Cependant, il est probable que moins de 10% de ces patients sont réellement allergiques à la pénicilline et que moins de 2% des patients réellement allergiques à la pénicilline présentent une allergie croisée aux céphalosporines de troisième génération [18]. Il convient de noter que les pénicillines et autres antibiotiques β-lactamines sont généralement la classe de substances la plus efficace et que leur privation en raison d’une prétendue allergie entraîne une morbidité et une mortalité accrues chez les patients ainsi “marqués”. Il convient donc de toujours différencier les allergies des réactions indésirables et de procéder à une enquête allergologique en cas de suspicion d’allergie aux antibiotiques.
Réparation du microbiote endommagé : tout comme un chirurgien est responsable de sa plaie, toute prescription d’antibiotiques devrait être accompagnée d’une réflexion sur les conséquences (notamment la sélection de la résistance et les dommages collatéraux en termes de microbiote). L’objectif devrait être de les minimiser ou de les “réparer”. Cependant, les études futures doivent d’abord fournir des preuves pour déterminer quel probiotique est le meilleur dans quelle situation. Différentes espèces de Lactobacillus et de Bifidobacillus, que l’on trouve dans divers yaourts à boire ou compléments alimentaires disponibles dans le commerce, sont recommandées pour restaurer le microbiote endommagé par les antibiotiques [6].
Messages Take-Home
- 60 à 90% des antibiotiques sont prescrits dans la pratique, dont environ 75 à 85% pour des infections respiratoires généralement virales.
- Pour chaque traitement antibiotique, les aspects suivants doivent être pris en compte : Indication, spectre pathogène attendu, mode d’application, dosage, durée.
- Une utilisation aussi parcimonieuse et ciblée que possible contribue à minimiser le risque de développement de la résistance aux antibiotiques, les effets secondaires, les allergies et les coûts.
- Toute administration d’antibiotiques laisse des dommages collatéraux dans notre microbiome avec des effets multiples et encore incomplètement connus sur le risque de diverses maladies (diarrhée associée à Clostridium difficile, septicémie, obésité et syndrome métabolique, allergies, etc.)
- Règle générale de l’antibiothérapie : aussi courte que nécessaire et à la dose la plus élevée possible.
Littérature :
- Spellberg B, et al : Combattre la résistance aux antimicrobiens : recommandations politiques pour sauver des vies. Clin Infect Dis 2011 ; 52(Suppl 5) : S397-428.
- Marston HD, et al : Résistance aux antimicrobiens. JAMA 2016 ; 316(11) : 1193-1204.
- Albrich WC, Monnet DL, Harbarth S : Antibiotic selection pressure and resistance in Streptococcus pneumoniae and Streptococcus pyogenes. Emerg Infect Dis 2004 ; 10(3) : 514-517.
- Hillier S, et al : Prior antibiotics and risk of antibiotic-resistant community-acquired urinary tract infection : a case-control study. J Antimicrob Chemother 2007 ; 60(1) : 92-99.
- Nasrin D, et al : Effet de l’utilisation des antibiotiques bêta-lactamines chez les enfants sur la résistance des pneumocoques à la pénicilline : étude de cohorte prospective. BMJ 2002 ; 324(7328) : 28-30.
- Kahlert C, Müller P : Microbiome – la découverte d’un organe. Swiss Med Forum 2014 ; 14(16-17) : 342-344.
- Willing BP, Russell SL, Finlay BB : Shifting the balance : antibiotic effects on host-microbiota mutualism. Nat Rev Microbiol 2011 ; 9(4) : 233-243.
- Blaser MJ : The theory of disappearing microbiota and the epidemics of chronic diseases (La théorie de la disparition du microbiote et les épidémies de maladies chroniques). Nature reviews Immunology 2017 ; 17(8) : 461-463.
- Ruppe E, et al : High Rate of Acquisition but Short Duration of Carriage of Multidrug-Resistant Enterobacteriaceae After Travel to the Tropics. Clin Infect Dis 2015 ; 61(4) : 593-600.
- Schuetz P, et al. : Moins, c’est plus : antibiothérapie individualisée par la mesure de la procalcitonine. Swiss Med Forum 2012 ; 12(46) : 887-892.
- Gulliford MC, et al : Safety of reduced antibiotic prescribing for self limiting respiratory tract infections in primary care : cohort study using electronic health records. BMJ 2016 ; 354 : i3410.
- Cai T, et al : Le rôle de la bactériurie asymptomatique chez les jeunes femmes souffrant d’infections urinaires récurrentes : à traiter ou à ne pas traiter ? Clin Infect Dis 2012 ; 55(6) : 771-777.
- Cai T, et al : Le traitement asymptomatique de la bactériurie est associé à une prévalence plus élevée de souches résistantes aux antibiotiques chez les femmes souffrant d’infections du tractus urinaire. Clin Infect Dis 2015 ; 61(11) : 1655-1661.
- Chabok A, et al : Essai clinique randomisé d’antibiotiques dans la diverticulite aiguë non compliquée. The British journal of surgery 2012 ; 99(4) : 532-539.
- Cremers AJ, et al : Effet du streamlining antibiotique sur le résultat des patients dans la bactériémie pneumococcique. J Antimicrob Chemother 2014 ; 69(8) : 2258-2264.
- Llewelyn MJ, et al : The antibiotic course has had its day. BMJ 2017 ; 358 : j3418.
- Dawson-Hahn EE, et al : Short-course versus long-course oral antibiotic treatment for infections treated in outpatient settings : a review of systematic reviews. Family practice 2017 ; 34(5) : 511-519.
- Trubiano JA, Adkinson NF, Phillips EJ : Penicillin Allergy Is Not Necessarily Forever. JAMA 2017 ; 318(1) : 82-83.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(4) : 11-14