Les effets indésirables des médicaments sont divisés en réactions de type A et de type B. Les réactions de type A sont les plus fréquentes. Les réactions de type A sont basées sur le mécanisme d’action du médicament. Les réactions de type B (allergies médicamenteuses) sont moins fréquentes mais potentiellement dangereuses et sont dues à une réaction immunitaire au médicament.
Les allergies médicamenteuses (AM) surviennent généralement de manière imprévue. Les manifestations sont cliniquement très variables et potentiellement dangereuses. Les mécanismes sous-jacents sont hétérogènes et l’identification des causes est difficile. Des données récentes ont montré que la stimulation immunitaire dans le cadre de l’AMM est déclenchée par trois mécanismes différents, qui se distinguent par la vitesse de manifestation, la dose-dépendance, les possibilités d’investigation et la génétique [3]. L’attribution d’une réaction est rendue difficile par le fait que de nombreux patients reçoivent plusieurs médicaments en même temps. En cas de suspicion d’AM, un examen minutieux est nécessaire. S’il s’agit d’une AMM, le patient concerné doit être suffisamment informé de sa maladie. Un passeport d’allergie de la SSAI (Société suisse d’allergologie et d’immunologie) est recommandé ; il contient des informations sur la gravité de l’allergie, les médicaments alternatifs tolérés et le contexte du diagnostic d’allergie. Le passeport d’allergie est disponible auprès du Centre d’Allergie Suisse (www.aha.ch).
“Réaction indésirable à un médicament”
Les effets indésirables (EI), également appelés “Adverse Drug Reaction” (ADR), sont divisés en réactions de type A et de type B [1,2]. Les réactions de type A sont fréquentes (85%) et sont dues à des réactions pharmacologiques (p.ex. fatigue après de fortes doses d’anti-H1 bloquants, gastrite érosive après des AINS, etc). On appelle réaction de type B (environ 15%) les réactions d’hypersensibilité dont les symptômes ne correspondent pas au mécanisme d’action du médicament, mais sont dus à des réactions immunitaires : un exanthème après amoxicilline n’a rien à voir avec le mécanisme d’action de l’antibiotique, mais est dû à une réaction immunitaire à l’amoxicilline.
Réactions d’hypersensibilité : Réaction de type B
Formation d’un nouvel antigène/allergène (modèle haptène) : Un médicament chimiquement réactif (par ex. la pénicilline) se lie à une protéine par liaison covalente (mécanisme haptène) : le complexe haptène-protéine est reconnu comme un nouvel antigène par le système immunitaire, contre lequel se développe une réaction immunitaire complexe basée sur différentes simulations de cellules B ou T. Le complexe haptène-protéine est reconnu comme un nouvel antigène par le système immunitaire. Cliniquement, les symptômes varient en fonction du type de stimulation immunitaire : anaphylaxie rapide (médiée par les IgE), eczéma et exanthème ne se manifestant qu’après plusieurs jours (tous deux médiés par les cellules T) ou hémolyse (IgG/IgM). Cette réaction immuno-allergique suit les principes de la stimulation immunitaire sur les protéines et peut être détectée par des tests cutanés et des tests in vitro. Le nombre de médicaments qui stimulent clairement via le mécanisme haptène est limité. Certains médicaments ne deviennent des médicaments réactifs qu’après avoir été métabolisés (par exemple, les sulfanilamides) (tableau 1).

p-i (interaction pharmacologique avec les récepteurs immunitaires) : Ce concept, développé au sein du groupe de recherche sur les allergies médicamenteuses de l’Hôpital de l’Île, associe la pharmacologie et l’immunologie [4]. Les médicaments ont tendance à s’attacher aux protéines via des liaisons hydrogène, des interactions électrostatiques et des forces de van der Waals, comme c’est le cas dans les interactions normales ligand-récepteur. Certaines de ces interactions non covalentes entraînent le blocage ou la stimulation des récepteurs importants pour l’activation des lymphocytes T. Les interactions non covalentes peuvent également entraîner des effets secondaires. Dans le mécanisme p-i, ces interactions “pharmacologiques” comprennent les récepteurs immunitaires HLA et TCR. Contrairement au modèle haptène, le modèle p-i n’entraîne qu’une stimulation sélective des lymphocytes T. Les lymphocytes T ne sont donc pas stimulés. Il existe un certain nombre de médicaments qui stimulent principalement le mécanisme p-i, et ces réactions sont souvent cliniquement problématiques (hépatite, DRESS, SJS/TEN) (tableau 1).
Dans le cas de l’abacavir, de la carbamazépine ou de l’allopurinol, une liaison affine relative se produit principalement ou exclusivement avec certains allèles HLA : par exemple, le principal métabolite de l’allopurinol (oxypurinol) peut se lier fortement à l’allèle HLA-B*58:01, l’abacavir à B*57:01 et la carbamazépine à B*15:01 ou A*31:01. Les personnes présentant ces allèles HLA sont particulièrement vulnérables aux effets indésirables graves comme le SJS ou le DRESS : le typage HLA permet de détecter le risque d’effets indésirables graves, ce qui est souvent fait pour l’abacavir et la carbamazépine chez les personnes originaires d’Asie du Sud-Est, car le HLA-B*15:02 est relativement fréquent dans cette région. Alternativement, le médicament peut se lier directement au TCR, qui reconnaît les peptides dans le HLA : c’est par exemple le cas dans les allergies au sulfaméthoxazole, où différents sites de liaison au TCR ont été identifiés [4]. Le diagnostic repose sur la détection des réactions des cellules T dans un test cutané ou in vitro (cyto-LTT).
Effets secondaires pseudo-allergiques : Ils sont dus à la stimulation directe des cellules effectrices du système immunitaire. La stimulation des mastocytes via le récepteur MRGPRX2 par la fixation de quinolones ou de myorelaxants est la plus étudiée [5]. Il explique la survenue d’urticaire et d’anaphylaxie avec ces médicaments. Les réactions pseudo-allergiques aux AINS sont les plus importantes, une partie de ces EI pouvant être attribuée à une augmentation de la production de leucotriènes [6]. Il en résulte une activation des éosinophiles et des basophiles ainsi qu’une stimulation des mastocytes. Les symptômes sont la rhinosinusite et le bronchospasme dans le sens d’un asthme sensible à l’aspirine, et/ou l’urticaire et l’anaphylaxie. Les effets secondaires pseudo-allergiques sont fréquents. En l’absence d’implication du système immunitaire spécifique (cellules B et T), les tests immunologiques (tests cutanés, BAT, cyto-LTT) sont négatifs (tableau 1). Le diagnostic repose sur des tests de provocation ainsi que sur l’anamnèse et l’observation de l’évolution de la maladie afin de déterminer quels médicaments sont tolérés ou déclenchent des symptômes.
Réactions de type immédiat ou tardif ?
Les questions suivantes sont importantes pour le clinicien : pourrait-il s’agir d’une allergie médicamenteuse ? Distinction entre les réactions de type immédiat et de type tardif ? Signaux de danger ? Quel médicament est en cause ? Souvent, on ne pense à l’AM que tardivement dans le diagnostic différentiel, car les manifestations cliniques de l’AM imitent diverses autres maladies immunitaires ou auto-immunes virales ou bactériennes. En cas de maladie inexplicable, il faut toujours inclure l’AMM dans le diagnostic différentiel. Les indices d’une MA comme cause des symptômes sont : Lien avec un médicament nouvellement prescrit (depuis <1-45 jours) ou symptômes typiques d’une éruption prurigineuse (exanthème), d’une urticaire, d’une anaphylaxie ou d’une éosinophilie.
Il est important de distinguer les réactions de type immédiat des réactions de type tardif. Les réactions qui surviennent dans l’heure qui suit l’administration du médicament (parfois de manière peraiguë, en quelques minutes) sont soit à médiation IgE, soit à médiation pseudo-allergique. Elles se manifestent par des flashs, des démangeaisons (typiquement palmaires, plantaires, cuir chevelu, axillaires, génitales), de l’urticaire et, si des organes internes sont également touchés, par une anaphylaxie supplémentaire (bronchospasme, vomissements, diarrhée, hypotension, choc cardiogénique). La plupart des réactions n’apparaissent qu’au bout de six heures (le plus souvent au bout de quatre jours). Avec l’amoxicilline, qui est le déclencheur le plus fréquent d’une MA en Suisse (2-8% des personnes traitées), l’exanthème n’apparaît souvent qu’après une durée de traitement de 7-12 jours, parfois même après l’arrêt du médicament. Les exanthèmes sont relativement hétérogènes sur le plan clinique et sont généralement dus à des cellules T stimulées par des médicaments.
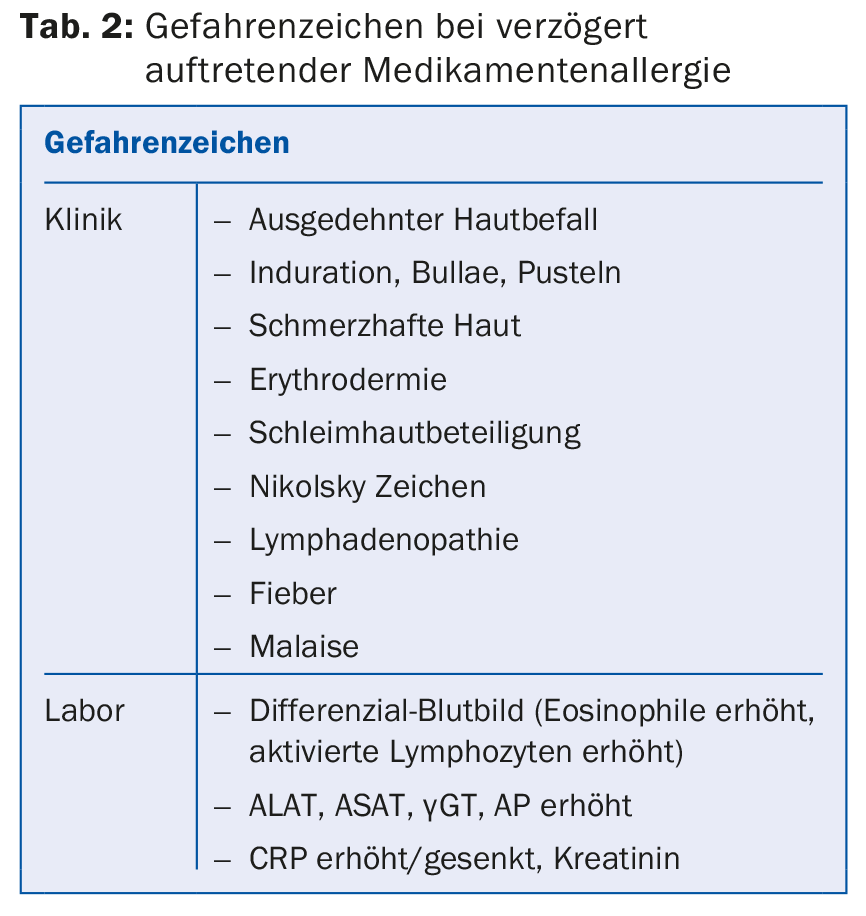
Les réactions de type tardif sont dominées par des exanthèmes maculaires, urticariens et maculopapuleux. Il n’est pas rare qu’une hépatite légère à modérée soit associée, rarement une pleurésie, une pancréatite, etc. Les réactions cutanées bulleuses et les réactions des muqueuses (conjonctivite, ulcères/aphtènes oraux ou génitaux) qui caractérisent le SJS/TEN sont toujours considérées comme dangereuses et présentent un taux de létalité de 10 à 30%. Les augmentations massives des éosinophilies (souvent des >1 G/l) et des lymphoblastes (comme dans l’infection par le virus Epstein-Barr), qui sont souvent ignorés : En cas de suspicion d’AMM, toujours réaliser une formule sanguine différentielle ou rechercher des lymphoblastes et, en cas d’exanthème généralisé, toujours déterminer les paramètres hépatiques (SGOT/SGPT, LDH, AP, γGT) afin de détecter une implication hépatique ; informé des signes de danger Tableau 2. Rarement, des effets indésirables hématologiques (thrombopénie, anémie hémolytique, agranulocytose) peuvent survenir. Elles sont en grande partie médiées par les IgG.
Quel médicament est en cause ?
Identifier les déclencheurs d’une MA est très complexe. Une documentation aussi précise que possible de la médication en ce qui concerne la durée, la dose et le moment des premiers symptômes de l’AMM est essentielle pour l’examen, en particulier pour savoir si l’on connaît le type d’AMM pour les médicaments concernés. Parfois, cela permet déjà de délimiter et de classer. Comme de nombreux patients suivent une thérapie combinée, l’anamnèse est souvent difficile et peu claire. Le diagnostic d’une allergie médicamenteuse doit être posé avec le moins de risque d’erreur possible, car les conséquences qui y sont liées peuvent être, entre autres, la privation d’un groupe important de médicaments et l’augmentation/la diminution du coût du traitement.
Tests cutanés et in vitro : lors de l’évaluation in vivo, il faut tenir compte des concentrations, de la solubilité, de la mise à disposition de médicaments stériles ainsi que de la prise simultanée de médicaments pendant le test et de bien d’autres choses encore, de sorte que l’évaluation se fait chez l’allergologue. Il convient également de tenir compte des mécanismes immunitaires possibles, c’est-à-dire de savoir si la réaction pourrait être due aux IgE ou aux cellules T. Si l’on soupçonne un mécanisme médié par les IgE, il est possible de réaliser des prick-tests cutanés avec des substances solubles et des tests intradermiques avec des médicaments solubles stériles. Pour un petit nombre de médicaments, il existe un test de laboratoire permettant de détecter les IgE spécifiques aux médicaments par sérologie (méthode ImmunoCap). Les réactions des cellules T contre le médicament peuvent être détectées par des tests cutanés (test intradermique et test épicutané). Les possibilités d’investigations in vitro ont été récemment améliorées : Si l’on soupçonne une réaction médiée par les IgE, on utilise le BAT. En cas de réactions tardives, le cyto-LTT in vitro est le plus approprié pour détecter une sensibilisation.
Réactions de type immédiat : test d’activation des basophiles : Pour le diagnostic d’une réaction de type immédiat (généralement quelques minutes/heures après la prise du médicament), le BAT est approprié. La MTD consiste à “recréer” en laboratoire la réaction qui se produit dans le corps. Le sang est incubé avec le médicament présumé déclencheur, à l’état pur et à des concentrations croissantes, ce qui active les basophiles présents dans le sang en cas de sensibilisation. Outre la libération de médiateurs (histamine, héparine), différents marqueurs d’activation sont exprimés à la surface des basophiles et peuvent être quantifiés par cytométrie de flux. Comme le test nécessite des cellules vivantes, un temps de transport rapide des échantillons (<24h) est essentiel. Le test doit également être annoncé au laboratoire. Le matériel d’analyse nécessaire est au moins 4 ml de sang EDTA.
Les groupes de médicaments suivants se sont avérés appropriés pour l’évaluation d’une MA de type immédiat avec le BAT (expérience de l’ADR-AC) : pénicillines, céphalosporines, myorelaxants, IPP, fluoroquinolones ainsi que divers désinfectants. Si d’autres médicaments sont testés, le test doit encore être considéré comme expérimental. Comme pour le test cutané, la sensibilité du BAT diminue avec la distance de l’événement. L’idéal est donc d’effectuer le BAT dans l’année qui suit la réaction allergique.
Réactions de type tardif : Test de transformation des cytokines et des lymphocytes (cyto-LTT) : le cyto-LTT s’avère utile pour le diagnostic des réactions allergiques tardives au moyen d’un diagnostic de laboratoire in vitro et – sur la base des données actuelles – supérieur au test cutané et au LTT normal : Dans une culture cellulaire de 7 jours des cellules du patient avec le médicament, des cellules T spécifiques sont stimulées et sécrètent des cytokines : L’analyse de certains médiateurs dans les surnageants de culture cellulaire, à savoir l’IL-5, l’IL-13, l’IFN-y, la granzyme B et la granulysine, est appropriée pour détecter les différents types de réaction. Selon le schéma de distribution des cytokines, il est même possible de tirer des conclusions sur le tableau clinique. Ainsi, les patients atteints d’exanthème maculopapuleux ont tendance à présenter des taux élevés d’IL-5 et d’IL-13, alors que les mécanismes de réaction cytotoxiques tels que l’AGEP ou le DRESS entraînent une augmentation des cytokines cytotoxiques. Le cyto-LTT nécessite 4050 ml de sang hépariné, le délai optimal de prélèvement étant de deux semaines à 1-2 ans après la disparition de la réaction, sauf dans le cas du SJS/TEN où le test doit être réalisé dès que possible. Un large éventail de substances actives peut être testé en cyto-LTT. Il s’agit des principaux déclencheurs typiques de réactions tardives à médiation médicamenteuse (détails sur www.adr-ac.ch).
Évolution des symptômes et mesures à prendre
La première mesure à prendre est d’arrêter le médicament administré depuis peu. En effet, il est peu probable qu’un médicament déjà pris pendant une longue période (par exemple un an) déclenche une allergie. D’autres mesures sont nécessaires en fonction de la sévérité des symptômes (tableau 2). Le DRESS désigne une réaction systémique cliniquement grave (exanthème massif, malaise, gonflement du visage, hépatite et souvent éosinophilie) et est principalement déclenché par certains médicaments spécifiques (tab. 3). Le DRESS n’apparaît souvent qu’après plusieurs semaines de traitement et peut provoquer une défaillance d’organe létale (cardite, hépatite). Les patients atteints d’exanthème sévère et de DRESS peuvent développer une nouvelle MA (“Multiple Drug Hypersensitivity”, MDH) pendant plusieurs années encore contre de nouveaux médicaments [7]. Dans le cas d’une MA légère, un traitement de courte durée avec des bloqueurs anti-H1, complété par des stéroïdes topiques, est suffisant. Les stéroïdes systémiques sont utilisés en cas d’AM sévère. L’hospitalisation et le recours à des spécialistes sont nécessaires et utiles en cas de maladies cutanées bulleuses (SJS/TEN), de DRESS et généralement d’AGEP, car l’évolution est souvent surprenante et l’expérience de ces MA graves est importante. Le suivi des patients atteints de DRESS est compliqué, car de nombreux patients présentent des réactions “flare up” malgré la suspension des déclencheurs et certains patients développent une MDH.

La durée de la sensibilisation après l’AM n’a pas été suffisamment étudiée. Des cas ont été observés qui, après plus de 12 à 20 ans, réagissaient encore fortement au médicament par des tests cutanés ou des LTT, de sorte que l’on peut supposer que l’AMM est permanente : C’est notamment le cas pour les MA sévères comme le DRESS, le SJS/TEN et l’hépatite. En cas d’anaphylaxie, la détection d’une allergie est plus élevée au cours de la première année après l’événement que plus tard, car une diminution spontanée des IgE spécifiques aux médicaments a été observée à plusieurs reprises. Cette diminution n’est toutefois pas certaine, de sorte que – si le même médicament doit être réutilisé – une dose d’essai est d’abord administrée : Le médicament est administré à raison de 1/100 à 1/10 de la dose quotidienne, puis il est rapidement augmenté jusqu’à la dose normale en l’espace de 3 à 6 heures (“graded challenge”). La réexposition (“challenge”/tests de provocation) à la dose complète est contre-indiquée en cas de réactions graves. Pour les réactions tardives fréquentes et initialement légères (exanthème), une ré-exposition serait possible après >2 ans s’il s’agit d’une classe importante de médicaments.
Messages Take-Home
- Les effets indésirables des médicaments (“Adverse Drug Reaction”) sont divisés en réactions de type A et de type B [1,2]. Les réactions de type A sont basées sur le mécanisme d’action du médicament. Les réactions de type B (allergies médicamenteuses) sont moins fréquentes mais potentiellement dangereuses et sont dues à une réaction immunitaire au médicament.
- Les allergies aux médicaments peuvent être classées en formes immuno-allergiques, p-i et pseudo-allergiques en fonction du mécanisme d’action du médicament avec les cellules immunitaires et inflammatoires. Les caractéristiques distinctives concernent la vitesse de manifestation, la dose-dépendance, les possibilités de dépistage et la génétique.
- Il faut également distinguer les réactions de type immédiat des réactions de type différé. Outre l’anamnèse et l’observation de l’évolution, un hémogramme différentiel peut fournir des éléments de diagnostic. L’identification des médicaments déclencheurs est compliquée. De nouveaux tests in vitro facilitent la détection de l’agent déclencheur, tant pour les réactions immédiates (test d’activation des basophiles, BAT) que pour les réactions tardives (cyto-LTT).
Littérature :
- Rawlins MD, Thompson JW : Pathogenesis of adverse drug reactions. In : Davies DM, ed. Textbook of adverse drug reactions. Oxford : Oxford University Press, 1977 : 10-17.
- Rawlins MD : Clinical pharmacology : adverse reactions to drugs. BMJ 1981 ; 282 : 974-976.
- Pichler WJ, Hausmann O : Classification de l’hypersensibilité aux drogues en formes allergiques, p-i, et pseudo-allergiques. Int Arch Allergy Immunol 2016 ; 171 (3-4) : 166-179.
- Pichler WJ, et al : Drug hypersensitivity : how drugs stimulate T cells via pharmacological interaction with immunity receptors. Intern Arch Allerg Clin Immunol 2015 ; 168(1) : 13-24.
- McNeil BD, et al : Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature 2015 ; 519 (7542) : 237-241. doi : 10.1038/nature14022.
- Kowalski ML, et al : Classification et approche pratique du diagnostic et de la prise en charge de l’hypersensibilité aux anti-inflammatoires non stéroïdiens. Allergy 2013 ; 68(10) : 1219-1232.
- Pichler WJ, Srinoulprasert Y, Yun J, Hausmann O : Multiple Drug Hypersensitivity. Int Arch Allergy Immunol 2017 ; 172(3) : 129-138.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(10) : 12-16