Le programme d’études SURPASS a évalué l’efficacité et la sécurité du tirazépatide, un agoniste double des récepteurs GIP/GLP-1, chez des patients atteints de diabète de type 2. Une analyse exploratoire des études de phase III SURPASS 1-4 montre que la normoglycémie a été atteinte chez une proportion significative de participants, sans augmentation du risque d’hypoglycémie. Cela s’est accompagné d’une amélioration de la santé métabolique générale. Ces résultats ont été publiés dans la revue Diabetes Care .
Le tirazépatide est le premier agoniste double des récepteurs GIP/GLP-1 autorisé. Le spectre d’action du tirazépatide comprend une augmentation de la sécrétion d’insuline, une réduction des taux de glucagon et de glucose, un retard de la vidange gastrique et une réduction du poids corporel. Ces effets sont dus à l’agonisme sur les récepteurs GIP et GLP-1. En Suisse, le tirazépatide (Mounjaro®) est autorisé depuis 2022 pour le traitement du diabète de type 2. Dans l’UE et dans certaines autres régions, l’indication a été étendue à l’obésité [1,2]. Le médicament est administré en injection sous-cutanée une fois par semaine.
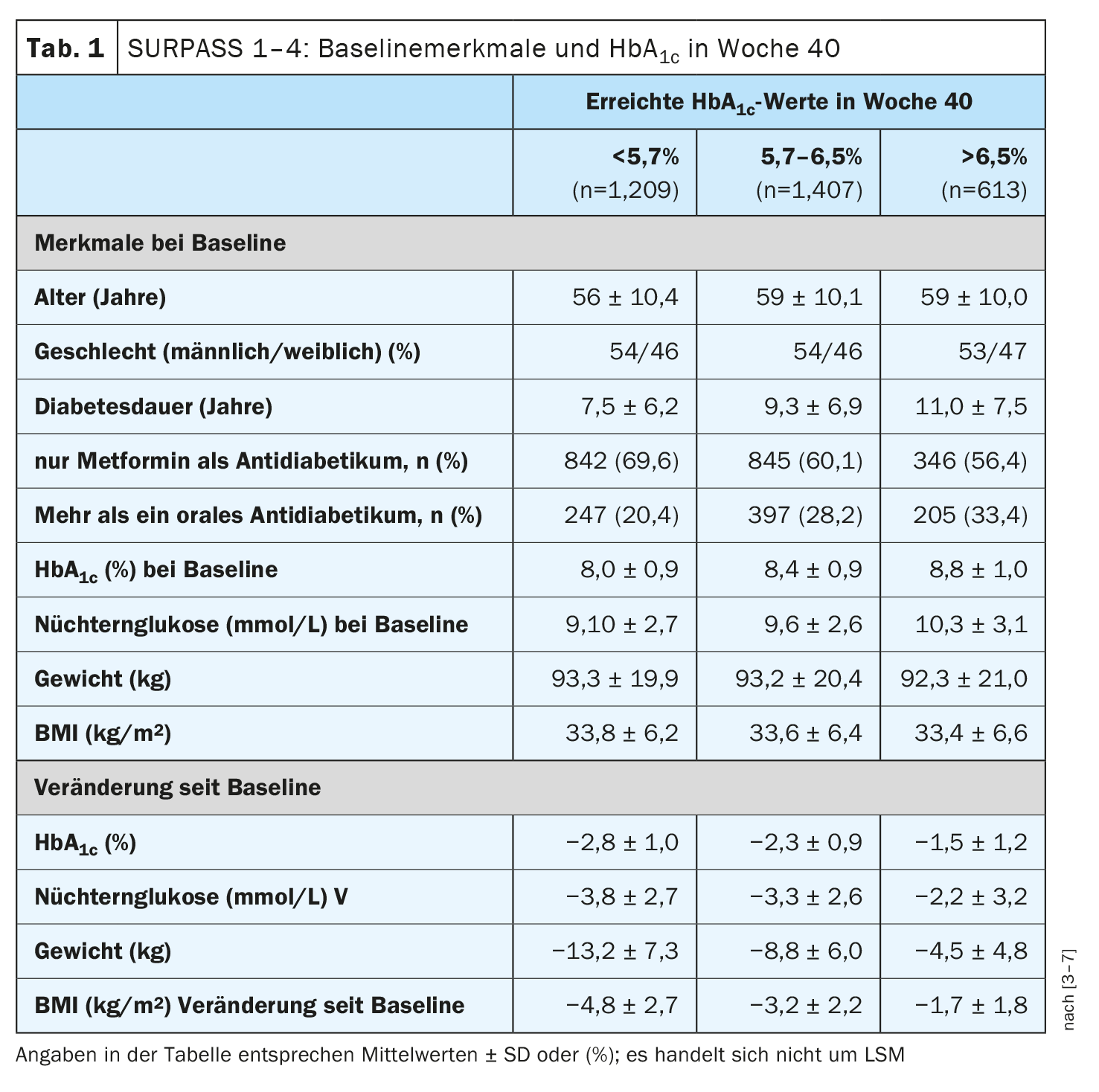
Rosenstock et al. ont analysé les valeurs des participants qui avaient pris au moins 75% des doses de traitement de tirazépatide sans médication d’urgence dans les études SURPASS 1-4 (n=3229), par catégorie d’HbA1c(<5,7%, 5,7-6,5% et >6,5%) [3–7]. Afin d’évaluer l’impact des caractéristiques des patients sur l’obtention d’une HbA1c <5,7%, les odds ratios ont été calculés à l’aide de modèles de régression logistique avec le tirazépatide comme covariable. Il s’est avéré que les participants traités par le tirazépatide qui ont atteint un taux d’HbA1c <de 5,7% étaient légèrement plus jeunes au début de l’étude, avaient une durée de diabète plus courte et un taux d’HbA1c plus bas (tableau 1). Au cours de l’étude, ces participants ont en outre montré des améliorations plus importantes de l’HbA1c, du poids corporel, du tour de taille, de la pression artérielle, des enzymes hépatiques et des paramètres lipidiques, sans que le risque d’hypoglycémie n’augmente.
Baseline jusqu’à la semaine 40 : aperçu des principaux résultats
Le groupe de patients ayant atteint un taux d’HbA1c <de 5,7% à la semaine 40 a présenté une variation moyenne d’HbA1c de -3,0%, contre -2,3% pour ceux dont le taux d’HbA1c était de 5,7-6,5% et contre -1,1% pour ceux dont le taux d’HbA1c était de >6,5% (moindres carrés moyens [LSM]; p<0,001 dans les deux cas). Le groupe avec une HbA1c <5,7% a obtenu une réduction moyenne du poids corporel de 14,1%, celui avec une HbA1c 5,7-6,5% de 9,6% et dans le groupe avec une HbA1c >6,5%, la perte de poids a été de 5,1% (LSM, p<0,001 dans les deux cas). Un taux d’HbA1c initial plus élevé (chaque augmentation de 1%) et le glucose à jeun (chaque augmentation de 50 mg/dl) étaient associés à une probabilité plus faible d’atteindre un taux d’HbA1c <5,7% à la semaine 40 (42% et 24% respectivement). En outre, la probabilité d’atteindre un taux d’HbA1c <5,7% diminuait de 13% et de 24% respectivement à chaque augmentation de l’âge et de la durée du diabète sur 5 ans. Seuls les patients recevant de la metformine avaient plus de chances d’atteindre un taux d’HbA1c <5,7%. En ce qui concerne les taux d’effets indésirables, 63% des patients ayant obtenu un taux d’HbA1c <5,7% ont présenté ≥1 effet indésirable (AE), alors que ces taux étaient respectivement de 62% et 57% dans le groupe de patients ayant obtenu un taux d’HbA1c compris entre 5,7-6,5% et >6,5%. Les EI les plus fréquents liés au traitement étaient les troubles gastro-intestinaux (42% vs 39% et 32% respectivement).
Littérature :
- Swissmedic : Information sur les médicaments, www.swissmedicinfo.ch,(dernière consultation 11.06.2024)
- Commission européenne, https://ec.europa.eu/health/documents/community-register/2023/
20231211161235/anx_161235_fr.pdf, (dernière consultation 11.06.2024). - Rosenstock J, et al : Achieving Normoglycemia With Tirzepatide : Analysis of SURPASS 1-4 Trials. Diabetes Care 2023 ; 46(11) : 1986-1992.
- Rosenstock J, et al : Efficacité et sécurité d’un nouvel agoniste double du GIP et du récepteur GLP-1, le tizépatide, chez les patients atteints de diabète de type 2 (SURPASS-1) : un essai de phase 3, randomisé, en double aveugle. Lancet 2021 ; 398 : 143-155.
- Frías JP, et al. ; SURPASS-2 Investigators . Tirzepatide versus semaglutide once weekly in patients with type 2 diabetes. N Engl J Med 2021 ; 385 : 503-515.
- Ludvik B, et al. : Tirzepatide once-weekly versus insuline degludec once-daily as add-on to metformin with or without SGLT2 inhibitors in patients with type 2 diabetes (SURPASS-3) : a randomised, open-label, parallel-group, phase 3 trial. Lancet 2021 ; 398 : 583-598.
- Del Prato S, et al. ; SURPASS-4 Investigators . Tirzepatide versus insulin glargine in type 2 diabetes and increased cardiovascular risk (SURPASS-4) : a randomised, open-label, parallel-group, multicentre, phase 3 trial. Lancet 2021 ; 398 : 1811-1824.
PRATIQUE DU MÉDECIN DE FAMILLE 2024 ; 19(6) : 31