Lors des Medidays, la formation continue en médecine interne de l’Hôpital universitaire de Zurich (USZ), des exposés ont également été présentés sur différents thèmes hématologiques. Comment évaluer judicieusement une anémie ? Quels sont les patients qui doivent passer aux nouveaux anticoagulants dans la pratique ? Et quelles sont les mesures thérapeutiques dont bénéficient les patients atteints de leucémie lymphoïde chronique ?
(ee) Le Dr Jeroen Goede, médecin directeur a.i. de la clinique d’hématologie de l’hôpital universitaire de Zurich, a donné des informations sur l’évaluation et le traitement de l’anémie. Il existe plusieurs causes de discordance entre la concentration d’hémoglobine et la masse érythrocytaire (tableau 1). En principe, la concentration d’hémoglobine dépend de différents facteurs tels que l’âge, le sexe, la race et l’altitude du lieu de résidence. Les valeurs de référence pour l’anémie sont <120 g/l chez les femmes, <110 g/l pendant la grossesse et <130 g/l chez les hommes. La valeur plus faible chez les femmes n’est pas due aux menstruations, mais à la baisse du taux de testostérone ; lorsque les taux de testostérone diminuent chez les hommes avec l’âge, la concentration d’hémoglobine diminue également.
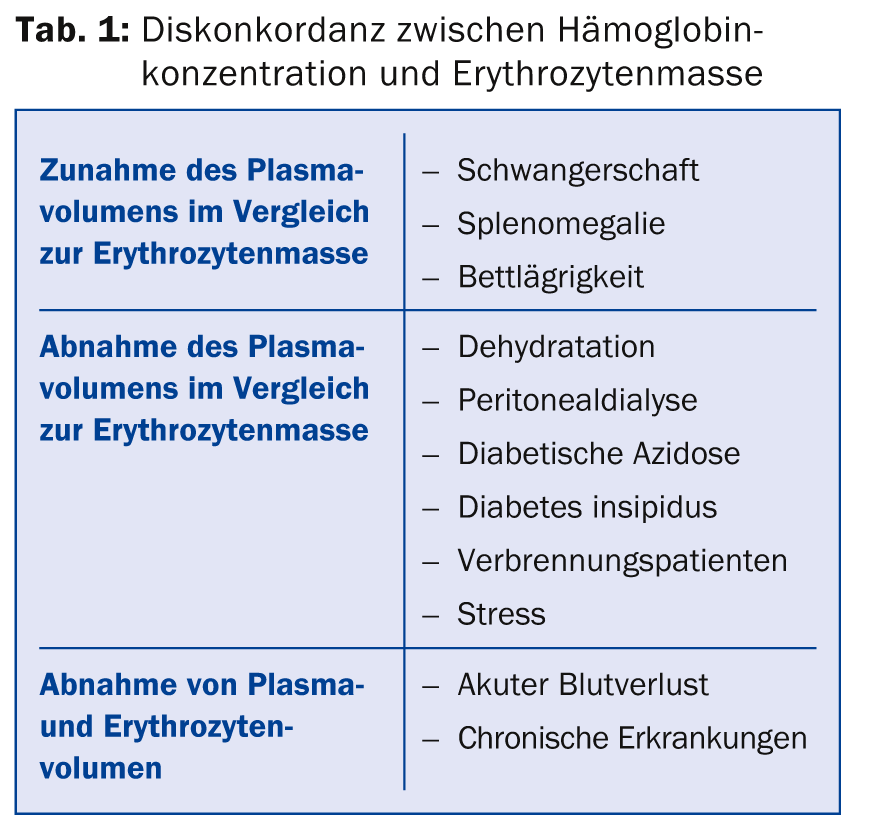
Les diagnostics différentiels de l’anémie sont très variés. En principe, on distingue la production inadéquate d’érythrocytes (par exemple en cas de carence en fer ou de perturbation de l’érythropoïèse normale en cas de malignité), l’augmentation de la dégradation (par exemple en cas de prothèses valvulaires, d’anémies hémolytiques auto-immunes, de défauts membranaires, etc.), la perte d’érythrocytes (hémorragie aiguë ou chronique) et la “pseudo-anémie” (par exemple pendant la grossesse). Pour l’investigation initiale d’une anémie, quelques tests de laboratoire suffisent généralement (tableau 2). Ils permettent de poser le diagnostic dans environ deux tiers des anémies.

Le métabolisme du fer est très complexe. Cependant, dans 99% des cas, le dosage de la ferritine est suffisant pour évaluer une anémie ferriprive, un bilan ferrique complet est généralement inutile. En cas de carence en fer, il convient de recommander aux patients une alimentation riche en fer (viande, jaune d’œuf, céréales avec cosses, soja, noix, pain complet). Une substitution orale de fer par 200 mg/j de sulfate de fer (pendant 3 à 6 mois) n’a de sens que si le fer peut être absorbé – c’est pourquoi, en cas de maladie cœliaque par exemple, la substitution de fer doit se faire par voie IV. Or, il n’est pas rare que les comprimés de fer entraînent des troubles gastro-intestinaux.
La substitution intraveineuse de fer peut aujourd’hui être effectuée de manière très sûre ; les nouvelles préparations contenant du fer-carboxymaltose (Ferinject®) ou de l’acide acétylsalicylique (AAA) peuvent être administrées en toute sécurité. Le fer-saccharose (Venofer®) ne contient plus de dextran et ne provoque plus d’anaphylaxie sévère. Une indication claire est néanmoins impérative pour l’administration de fer par voie intraveineuse. Il s’agit notamment d’une intolérance documentée à l’administration de fer par voie orale, d’une malabsorption ou d’une malcompliance non influençable. Une légère thrombocytose (jusqu’à 700 G/l) est fréquente en cas de carence en fer, mais elle disparaît généralement après la substitution.
Nouveaux anticoagulants oraux
Depuis quelques années, de nouveaux anticoagulants oraux sont disponibles : l’antagoniste direct de la thrombine dabigatran (Pradaxa®) et les antagonistes directs du facteur Xa rivaroxaban (Xarelto®), apixaban (Eliquis®) et – non disponible en Suisse – edoxaban (Lixiana®). Le Dr Jan-Dirk Studt, médecin-chef de la clinique d’hématologie de l’hôpital universitaire de Zurich, a présenté les possibilités d’utilisation ainsi que les avantages et les inconvénients.
Tous les nouveaux anticoagulants oraux (NOAK) sont autorisés en Suisse pour la prophylaxie de l’embolie en cas de fibrillation auriculaire. Le rivaroxaban et l’apixaban sont en outre autorisés pour la prophylaxie de la thromboembolie veineuse (TEV) en cas de chirurgie orthopédique majeure de la hanche et du genou, et le rivaroxaban peut être utilisé en complément du traitement aigu de la TEV et de la prophylaxie secondaire (sans administration préalable d’héparine de bas poids moléculaire).
Chez les patients atteints de fibrillation auriculaire, les études actuelles montrent que les AINS sont légèrement plus efficaces et plus sûrs que les antagonistes de la vitamine K ; chez les patients atteints de TEV, les deux classes sont actuellement considérées comme à peu près équivalentes. Le tableau 3 présente les indications de conversion. En principe, les NOAK présentent une sécurité et une efficacité équivalentes à celles des “anciens” anticoagulants oraux, et un avantage important est la rapidité d’action.

Le Dr Studt a fourni des informations sur l’utilisation des NOAK dans des situations cliniques particulières :
- Interventions et interventions : Pour la plupart des interventions, il est nécessaire d’arrêter les NOAK au moins 24 heures avant l’intervention, voire 48 heures ou plus avant pour les interventions à haut risque (par ex. les interventions sur le SNC). En cas d’insuffisance rénale, un délai plus long est nécessaire.
- Annulation des effets : aucun antidote spécifique n’est encore disponible, c’est pourquoi la demi-vie relativement courte des nouvelles substances est un avantage. Pour le dabigatran, une dialyse est tout au plus indiquée. Pour le rivaroxaban et l’apixaban, une dialyse n’est pas prometteuse en raison de la forte liaison aux protéines.
- Saignements : En cas de saignement léger, un traitement symptomatique est indiqué (traitement local, éventuellement report de la dose suivante). En cas d’hémorragie modérée à sévère, la prise est interrompue et le patient est admis à l’hôpital. L’administration de protamine ou de vitamine K est inefficace. En cas de besoin, du concentré de complexe prothrombinique ou du concentré de complexe prothrombinique activé peut être administré.
- Valves cardiaques mécaniques : Chez les patients porteurs de prothèses valvulaires mécaniques, les antagonistes de la vitamine K (AVK) restent le traitement de référence. Les résultats des études comparant le dabigatran aux AVK ont été défavorables au dabigatran. Actuellement, tous les AINS sont contre-indiqués chez les patients porteurs de prothèses valvulaires mécaniques.
- Grossesse et allaitement : les données sur l’utilisation des AINS pendant la grossesse et l’allaitement sont très limitées, de sorte que tous les AINS sont actuellement contre-indiqués chez les femmes enceintes et allaitantes. L’héparine de bas poids moléculaire reste le traitement de référence.
- Insuffisance rénale : aucun des AINS ne doit être prescrit chez les patients souffrant d’insuffisance rénale sévère (clairance de la créatinine <30 ml/min.) ou nécessitant une dialyse. En cas d’insuffisance rénale légère, les doses peuvent éventuellement être adaptées.
- La quantification de l’effet des NOAK est intéressante dans certaines situations cliniques, par exemple avant une intervention – en particulier non planifiée -, en cas de traumatisme, d’hémorragie, d’insuffisance rénale, de patients très légers ou très lourds, de surdosage présumé ou d’apparition de thromboses sous traitement adéquat. Il n’existe pas de plage cible comme pour les AVK ou l’héparine, et des tests de quantification spécifiques sont disponibles pour chaque agent.
Leucémie lymphatique chronique
Le professeur Markus G. Manz, directeur de la clinique d’hématologie de l’hôpital universitaire de Zurich, a fait un exposé sur la leucémie lymphoïde chronique (LLC). Cette leucémie, la plus fréquente de toutes, survient principalement chez les personnes âgées (âge médian au moment du premier diagnostic : 70 ans). En raison du vieillissement de la population, l’incidence de la LLC va encore augmenter à l’avenir. 7% des donneurs de sang sains de plus de 45 ans présentent une lymphocytose monoclonale à cellules B (LMB) dans le sang périphérique, mais en présence d’une LMB, la transition vers une LLC ne se produit que dans environ 1 à 2% des cas par an.
La dynamique de la LLC varie considérablement d’un patient à l’autre : la maladie peut progresser rapidement, mais elle peut aussi être asymptomatique (découverte fortuite). Les symptômes typiques sont une baisse de performance due à l’anémie, des infections, des stigmates de saignement, des symptômes B (fièvre, sueurs nocturnes, perte de poids), un gonflement des ganglions lymphatiques ainsi qu’un gonflement du foie et/ou de la rate. Le diagnostic se fait à partir du sang périphérique (lymphocytes B monoclonaux >5000/µl) ; une ponction de moelle osseuse n’est généralement pas nécessaire, mais peut être utile dans certains cas, notamment avant le début du traitement. Un examen cytogénétique doit toujours être effectué afin de diagnostiquer les aberrations chromosomiques qui sont de mauvais pronostic.
La LLC est classée selon Binet (tableau 4) ou Rai, ce qui est important pour estimer le pronostic. En 1974, seuls 5% des patients atteints de LLC survivaient au diagnostic pendant plus de cinq ans – cette situation a considérablement évolué depuis que différentes options thérapeutiques sont disponibles. Cependant, la LLC ne peut pas être guérie par des thérapies systémiques. En cas de LLC asymptomatique, le patient n’est pas traité, car il n’existe actuellement aucune preuve qu’un traitement au stade asymptomatique soit bénéfique. Une indication de traitement existe généralement au stade Binet C ou en présence de symptômes pénibles tels que le gonflement des ganglions lymphatiques, le gonflement du foie et de la rate, les symptômes B, l’anémie, etc.

Le traitement standard consiste aujourd’hui en une chimiothérapie à base de fludarabine, de cyclophosphamide et de rituximab (FCR). On s’écarte toutefois de ce schéma en fonction de l’âge et de l’état général du patient, des comorbidités (notamment l’insuffisance rénale) et des aberrations chromosomiques. L’association de bendamustine et de rituximab s’est révélée moins toxique, mais aussi légèrement moins efficace que le schéma FCR. C’est pourquoi cette combinaison est plutôt utilisée chez les patients âgés de plus de 65 ans. Chez les patients atteints de LLC réfractaire ou récidivante, une allogreffe de cellules souches est également possible.
Cette année, plusieurs nouveaux médicaments pour le traitement de la LLC ont été mis sur le marché : en juillet 2014, l’Agence européenne des médicaments (EMA) a recommandé l’approbation des inhibiteurs de tyrosine kinase ibrutinib et idelalisib (Zydelig®) et de l’anticorps monoclonal anti-CD20 obinutuzumab (Gazyvaro®) pour l’indication LLC. L’ibrutinib peut prolonger considérablement la durée de survie, mais des résistances se développent également.
L’orateur a attiré l’attention sur le fait que le coût élevé des nouveaux médicaments pour le traitement des leucémies chroniques représente un défi pour la société : “Le traitement d’une hypertension par l’énalapril coûte environ 500 francs par an, le traitement d’une LMC par l’imatinib 40 000 francs. Comme les gens sont de plus en plus âgés et les leucémies chroniques de plus en plus fréquentes, la question se pose de savoir qui va supporter les coûts de ces traitements coûteux”.
Source : Medidays, 3 septembre 2014, Hôpital universitaire de Zurich
PRATIQUE DU MÉDECIN DE FAMILLE 2014 ; 9(11) : 52-56











