Les kératoses actiniques sont un marqueur des dommages chroniques causés par le soleil et de la carcinogenèse de la peau. La protection solaire, surtout chez les jeunes, constitue la principale mesure de prévention primaire contre les kératoses actiniques en cas d’exposition chronique aux UV. Un traitement précoce des kératoses actiniques est indiqué. De nombreuses options de traitement sont disponibles.
Les kératoses actiniques ou solaires (KA) sont des carcinomes épidermoïdes in situ de la peau et font partie des dermatoses les plus fréquentes dans la pratique quotidienne. Comme son nom l’indique, le soleil, ou plutôt la lumière du soleil, est un élément essentiel de la vie. les rayons UV, en particulier les UV-B, sont responsables de leur apparition. L’exposition aux UV, principalement chronique, entraîne des dommages permanents et accrus de l’ADN et du génome de la peau (en particulier la mutation du gène suppresseur de tumeur p53), qui se traduisent par une prolifération plus ou moins importante de kératinocytes dyskératosiques transformés, riches en mitoses.
On sait depuis longtemps que les personnes exposées aux UV dans le cadre de leur travail (“outdoor worker”) sont significativement plus susceptibles de présenter des AK que les personnes travaillant principalement dans des bureaux. Outre l’intensité du rayonnement UV, le type de peau de la personne exposée aux UV contribue également au risque de développer une AK. On observe donc des prévalences beaucoup plus élevées dans les régions où l’exposition aux UV est élevée et où la population a la peau claire. Sous nos latitudes, les AK représentent 11 à 25% des personnes de plus de 40 ans, contre environ 60% en Australie. Une étude menée à Hambourg en 2013 a pu montrer que la prévalence globale était de 2,7%, les hommes étant plus touchés (3,9%) que les femmes (1,5%).
Mais la prévalence augmente également avec l’âge, comme l’ont montré des études : Chez les hommes de plus de 60 ans, 20% sont déjà touchés et chez les hommes de plus de 70 ans, ce chiffre atteint 52%. De plus, au cours des 10 dernières années, on a constaté une nette augmentation générale des AK. Outre les facteurs étiologiques, tels que l’exposition chronique aux UV, les changements démographiques, avec une proportion plus élevée de personnes âgées, pourraient en être la cause.
Il ne faut pas oublier que l’immunosuppression médicamenteuse, par exemple à la suite d’une transplantation d’organe, est un autre facteur de risque important : dans une étude, 29% des 452 transplantés rénaux présentaient des AC au moment du premier examen.
Comme les AK peuvent se transformer en carcinomes épidermoïdes de la peau (CEP), la question est généralement de savoir avec quelle probabilité et dans quel délai. Une revue systématique de la littérature publiée en 2013, qui a analysé 24 études, a conclu qu’en raison du nombre limité de données disponibles et des limites méthodologiques, il n’était actuellement pas possible de fournir des estimations fiables sur la fréquence de l’évolution de l’AK vers le cancer invasif et que des études supplémentaires étaient nécessaires.
Résultat clinique
Les AK se présentent sous forme de macules, de papules ou de plaques rugueuses et squameuses, de couleur rougeâtre ou rougeâtre-brunâtre, en particulier sur les zones cutanées exposées aux UV, comme le capillitium, l’hélix de l’oreille, l’arête du nez, les extrémités de l’avant-bras ou le dos de la main (Fig. 1). Il est rare que les lésions soient isolées, mais plutôt que toute une région soit touchée. On parle dans ce contexte de carcinogénèse de terrain.

Diagnostic
L’inspection et la palpation permettent de poser le diagnostic de suspicion d’AK. Les AK se caractérisent toutefois par un érythème variable avec une kératose d’étendue variable. La classification clinique des AK n’est pas corrélée à la sévérité histologique. Le caractère invasif ne peut donc pas être évalué avec certitude sur le plan clinique.
La dermatoscopie est une méthode appropriée pour différencier d’autres maladies et tumeurs lorsque les résultats ne sont pas clairs. De nombreuses études ont démontré que les AK, les AK pigmentés, la maladie de Bowen et les PEK présentent des motifs typiques, en particulier des vaisseaux, à la dermoscopie : Les AK présentent principalement un pseudo-réseau rouge et des squames légèrement jaunâtres et brunâtres, tandis que les carcinomes invasifs présentent des vaisseaux en épingle à cheveux et irréguliers, des follicules pileux targoïdes, des masses centrales de kératine et des ulcérations. Les AK et les PEK peuvent ainsi également être bien différenciés des carcinomes basocellulaires. En outre, la dermatoscopie est également utile pour différencier le lentigo malin, le lentigo sénile et la CA pigmentée. En outre, le degré d’invasivité est corrélé aux atypies vasculaires, de sorte que la dermoscopie peut également être utilisée pour évaluer une invasivité. D’autres techniques d’imagerie non invasives sont la microscopie confocale à laser et la tomographie par cohérence optique, mais la plupart d’entre elles ne sont disponibles que dans les cliniques.
Si les résultats cliniques sont typiques, les AC ne nécessitent pas de diagnostic histologique. En revanche, les lésions dont l’aspect clinique n’est pas clair, qui présentent des signes d’évolution vers un CPE ou qui ont été diagnostiquées avec un CPE doivent être traitées avec précaution. dont le comportement biologique ne peut pas être évalué, une biopsie doit être effectuée. Les AK qui ne répondent pas à un traitement adéquat doivent également être biopsiés.
Thérapie
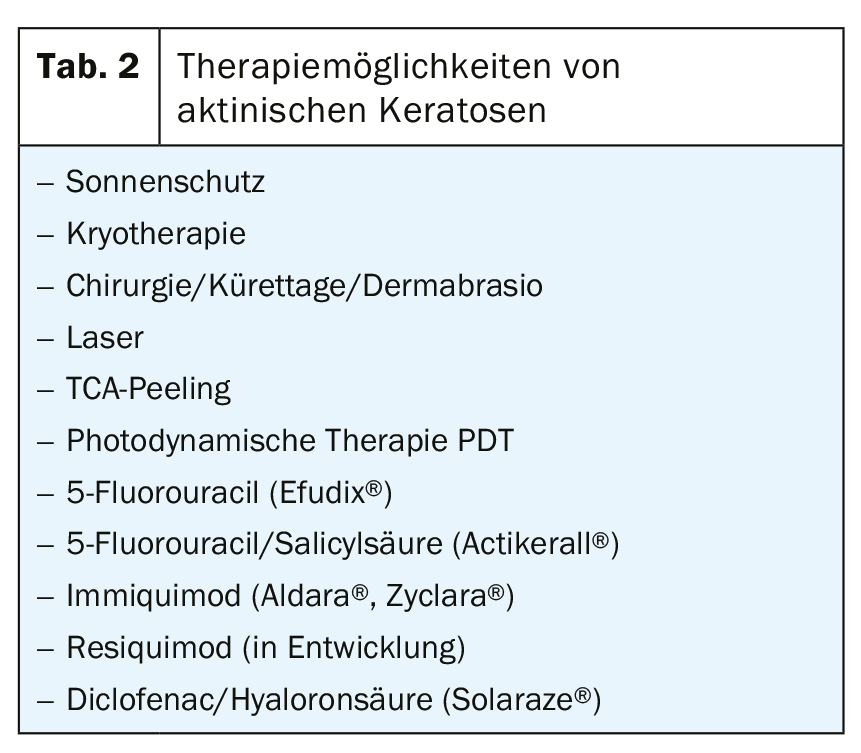
Il existe actuellement une multitude d’options thérapeutiques pour traiter l’AK, ce qui ne facilite pas forcément le choix d’un traitement particulier dans la pratique quotidienne. En outre, le choix d’un traitement approprié dépend de facteurs spécifiques au patient, à la lésion et au traitement. Les facteurs liés aux patients incluent l’âge, les comorbidités, l’immunosuppression, la comédication, les souhaits et les préférences du patient ainsi que l’adhésion au traitement. Les aspects lésionnels comprennent le nombre d’AC, leur localisation, leur nature clinique et la taille du champ affecté. En outre, comme nous l’avons mentionné au début, la pathogenèse de l’AK repose sur une lésion de l’ADN dans la peau, ce qui prédispose aux récidives tôt ou tard.
En principe, toutes les options de traitement existantes sont basées sur la destruction de la zone affectée et la réépithélialisation qui s’ensuit.
Cryothérapie
La cryothérapie à l’azote liquide (-196°C) est la méthode de traitement physique destructrice de l’AK la plus courante dans la vie quotidienne. La fréquence, la durée, l’intensité et la température spécifique dans la zone de traitement ne sont pas standardisées. Les quelques études existantes montrent des taux de guérison des lésions de 41,9% à 88%, des taux de guérison des patients de 25% à 90,3% et des taux de récidive de 1,2% à 12% au cours de la première année. Dans l’ensemble, il s’agit plus d’une méthode basée sur l’éminence que sur l’évidence, mais elle est peu coûteuse, demande peu de temps et est bien tolérée par le patient sans anesthésie locale. La durée de la congélation est corrélée à l’efficacité, mais aussi aux effets secondaires possibles (hypo/hyperpigmentation, cicatrices).
D’autres méthodes ablatives, que nous ne ferons que mentionner ici dans un souci d’exhaustivité, mais qui se sont révélées tout au plus équivalentes à la cryothérapie dans les études, sont les méthodes chirurgicales (curetage, excision à plat, excision, dermabrasion), le peeling TCA et le laser (ablatif, non ablatif).
Thérapie photodynamique PDT
La PDT est basée sur la destruction sélective des cellules tumorales cutanées dans l’épiderme et le derme au moyen d’une substance photosensibilisante (acide 5-aminolévulinique ALA, méthyl-5-amino-4-oxopentanoate MAL [Metvix®]) et d’une irradiation par une lumière rouge à haute énergie. Les études montrent des taux de cicatrisation des lésions compris entre 58% et 94,3% et des taux de cicatrisation des patients compris entre 31,8% et 91%, les résultats esthétiques étant principalement qualifiés d'”excellents” ou de “bons”. Les inconvénients sont toutefois le temps nécessaire (il faut attendre 3 heures entre l’application de la crème et l’irradiation), la douleur et des réactions locales plus importantes (érythème, œdème, pustules, érosions).
Pour simplifier la procédure de traitement, un patch contenant de l’ALA (Ameluz®, Alacare®) est également disponible en alternative.
Une nouvelle variante de la PDT traditionnelle est la PDT dite de jour, qui peut être réalisée de fin avril à fin septembre. Après curetage des croûtes et des hyperkératoses et application d’un écran solaire SPF 20, le MAL est appliqué sans occlusion sur les kératoses actiniques et le patient est invité à rester à l’extérieur pendant 90 à 120 minutes (selon l’exposition au soleil) entre 11 et 16 heures, après environ une demi-heure. Le MAL doit ensuite être rincé. Dans l’ensemble des études, ce type de PDT semble être légèrement inférieur ou équivalent à la méthode traditionnelle, avec une douleur nettement réduite.
5-fluorouracile topique (Efudix®)
Le 5-fluorouracile est un analogue de la pyrimidine qui est incorporé dans l’ARN et l’ADN en tant qu’antimétabolite, inhibant ainsi la synthèse de cet acide nucléique. En outre, la thymidylsynthétase est inhibée. 5-Fluorouracil 5% doit être appliqué deux fois par jour pendant 2 à 4 semaines, mais d’autres types de dosage sont également utilisés, par exemple un jour sur deux pendant 3 semaines, jusqu’à l’auto-traitement par le patient lui-même. Habituellement, des réactions inflammatoires plus ou moins prononcées se produisent, pouvant aller jusqu’à des érosions, des bulles ou des nécroses, ce qui peut finalement être une limite au traitement. Les taux de guérison liés aux lésions varient entre 47% et 94%, ceux liés aux patients entre 38% et 96%. Le fluorouracile topique à faible dose (0,5%) associé à l’acide salicylique à 10% (Actikerall®), appliqué une fois par jour, entraîne généralement moins de réactions inflammatoires cutanées. Taux de guérison lié aux lésions : 39,4% à 98,7%, lié au patient : 55,4%.
Imiquimod
L’imiquimod est un agoniste spécifique du TLR-7 et provoque la libération d’une série de cytokines (IFN-alpha, IL-1, IL-6, IL-12 et TNF-alpha), ce qui entraîne une augmentation de l’immunité cellulaire avec des propriétés antivirales et antitumorales. La crème à 5% (Aldara®) est appliquée trois fois par semaine pendant 4 semaines. Selon les études, le taux de guérison lié aux lésions varie de 45,1% à 93,6% et celui lié au patient de 24% à 85%. La crème à 3,75% (Zyclara®) est utilisée en traitement intermittent : 1 fois par jour pendant 2 semaines, 2 semaines de pause, 1 fois par jour pendant 2 semaines, avec des taux de guérison des lésions compris entre 34% et 81,8%.
Diclofénac dans un gel d’acide hyaluronique (Solaraze®)
Le diclofénac, en tant qu’inhibiteur de la COX1 et de la COX2, freine la prolifération et la néoangiogenèse dans la carcinogenèse et favorise l’apoptose. Le gel est appliqué deux fois par jour pendant 60 à 90 jours. La synthèse des études montre un taux de guérison des lésions compris entre 51,8% et 81%, et entre 27% et 50% pour les patients, avec des réactions indésirables (prurit, érythème, hypesthésies et paraesthésies, réactions photoallergiques) nettement moins fréquentes qu’avec l’imiquimod ou le 5-fluorouracile.
Ingénolmebutate (Picato®)
Le gel à application topique dérivé d’une euphorbe, qui induit un effondrement du potentiel de la membrane mitochondriale avec nécrose cellulaire consécutive, se traduisant cliniquement par une dermatite toxique plus ou moins sévère, a été retiré du marché en janvier 2020 en raison d’un risque potentiel d’augmentation du développement de cancers cutanés dans les zones traitées.
Résumé
En résumé, la protection solaire, surtout chez les jeunes et en cas d’exposition chronique aux UV, est la mesure la plus importante dans la prévention primaire de l’AK. Cependant, une fois que les dommages causés par le soleil sont installés et “gravés” dans le génome de la peau, la détection et le traitement précoces sont une priorité absolue. Il existe une multitude d’options et de modalités thérapeutiques dans le traitement de l’AK. Chaque méthode présente certains avantages, mais aussi des inconvénients. La synthèse des études montre que l’efficacité des options de traitement présentées varie entre 50% et 90%, la PDT étant légèrement meilleure que Solaraze®, ce qui reflète également l’expérience clinique. L’objectif est de mettre en place un régime de traitement adapté à chaque patient, en passant d’une méthode à l’autre ou en combinant plusieurs méthodes au fil du temps. De plus, tous les patients ne réagissent pas de la même manière à une méthode de traitement donnée. Il arrive parfois que le traitement provoque des effets secondaires inflammatoires locaux plus prononcés, alors que chez d’autres patients, on a l’impression qu’il ne se passe rien au début, mais que les lésions AK finissent par guérir complètement. En ce sens, l’entretien d’information et l’orientation du patient ont des fonctions tout à fait essentielles. Le patient doit d’une part être informé des dommages chroniques causés par la lumière à la peau, du début de la carcinogenèse et des examens de contrôle réguliers qui seront donc probablement nécessaires tout au long de sa vie, et d’autre part être informé des différentes possibilités de traitement. Cela suppose toutefois que le dermatologue traitant soit familiarisé avec le “jeu sur le clavier” des possibilités de traitement AK.
Messages Take-Home
- La protection solaire, surtout chez les jeunes, est la principale mesure de prévention primaire contre l’AK en cas d’exposition chronique aux UV.
- Les AK sont un marqueur de dommages solaires chroniques et de carcinogenèse de la peau.
- Le traitement précoce des AK est indiqué.
- Il existe de nombreuses options de traitement AK.
- L’information et le concept de traitement individuel sont des principes fondamentaux de la thérapie AK.
Littérature :
- Ligne directrice S3 Kératose actinique et carcinome épidermoïde de la peau, ligne directrice AWMF de la Société allemande de dermatologie mars 2020.
- Kornek T, Augustin M : Prévention du cancer de la peau. J Dtsch Dermatol Ges 2013 ; 11(4) : 283-296.
- Green AC. : Épidémiologie des kératoses actiniques. Curr Probl Dermatol 2015 ; 46 : 1-7.
- Memon AA, et al : Prevalence of solardamage and actinic keratosis in a Merseyside population. Br J Dermatol 2000 ; 142(6) : 1154-1159.
- Schmitt J, et al : L’exposition professionnelle à la lumière ultraviolette augmente le risque de développer un carcinome épidermoïde cutané : une revue systématique et une méta-analyse. Br J Dermatol 2011 ; 164(2) : 291-307.
- Werner RN, et al : The natural history of actinic keratosis : a systematic review. Br J Dermatol 2013 ; 169(3) : 502-518.
- Huerta-Brogeras M, et al : Validation of dermoscopy as a real-time noninvasive diagnostic imaging techniquefor actinic keratosis. Arch Dermatol 2012 ; 148(10) : 1159-1164.
- Zalaudek I, et al : Dermatoscopy of facial actinic keratosis, intraepidermal carcinoma and invasive squamous cell carcinoma : A progression model. J Am Acad Dermatol 2011.
- Akay BN, et al : Dermatoscopy of flat pigmented facial lesions : diagnostic challenge between pigmented actinic keratosis and lentigo maligna. Br J Dermatol 2010 ; 163(6) : 1212-1217.
- Lallas A, et al : Les caractéristiques cliniques et dermoscopiques du carcinome épidermoïde cutané invasif dépendent du degré de différenciation histopathologique. Br J Dermatol 2015 ; 172(5) : 1308-1315.
DERMATOLOGIE PRATIQUE 2020 ; 30(4) : 6-9