La maladie de Hodgkin fait partie des lymphomes malins et se manifeste par des gonflements indolores des ganglions lymphatiques, très souvent localisés initialement dans le cou ou derrière le sternum. Même à des stades avancés, il est encore possible de traiter efficacement.
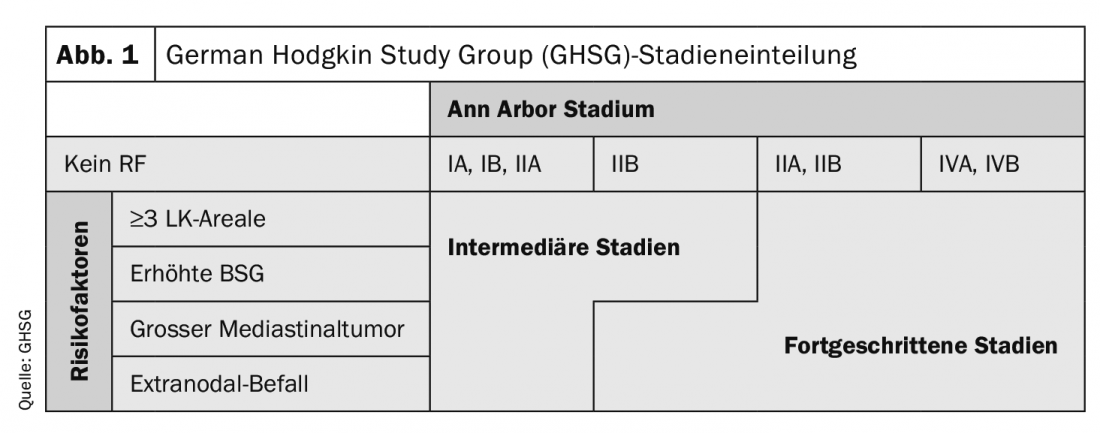
Outre les stades d’Ann-Arbor, les patients atteints de lymphome de Hodgkin (LH) sont également classés en stades précoces, intermédiaires et avancés en fonction de leurs facteurs de risque (Fig. 1). Le type et l’intensité du traitement dépendent en conséquence du stade présent. Pour le staging initial, il est désormais possible d’utiliser la TEP, qui présente un avantage très net en termes de sensibilité de détection des atteintes de la moelle osseuse par rapport à la tomographie assistée par ordinateur avec contraste.
Stratégie CMT à un stade précoce
Le traitement standard du LH aux stades précoces est la stratégie “combined modality treatment” (CMT). La chimiothérapie est administrée en 2-4 cycles et la dose de radiation varie entre 20 Gy et 30 Gy en fonction du stade exact. Actuellement, la thérapie “involved-site” (IS-RT) est recommandée, bien qu’il n’existe pas encore de données issues d’études prospectives. Les champs sont ici nettement plus circonscrits. En règle générale (>90%), le HL se manifeste de manière supradiaphragmatique et les champs d’irradiation incluent donc souvent le cœur, les gros vaisseaux, la thyroïde ou les tissus pulmonaires et mammaires. “En raison des effets secondaires potentiels à long terme de la radiothérapie, y compris les maladies cardiovasculaires (maladie coronarienne et infarctus du myocarde, insuffisance cardiaque) et oncologiques (carcinome mammaire, cancer du poumon), cette modalité thérapeutique est remise en question, en particulier par les hématologues”, a déclaré Borchmann. D’autre part, la radiothérapie de consolidation permet, par exemple, de réduire la chimiothérapie à seulement 2 cycles ABVD pour les stades précoces, ce qui signifie qu’un minimum d’intensité des deux modalités est nécessaire pour un contrôle optimal du lymphome. Les données à long terme des études du GHSG publiées en 2017 dans les stades précoces avec un suivi d’environ 10 ans n’ont pas montré d’augmentation significative de l’incidence des néoplasies secondaires, de sorte qu’avec les preuves disponibles, il n’y a aucune raison de s’écarter du concept de “modalité combinée”.
Une autre option consiste à améliorer le schéma ABVD en ajoutant de nouvelles substances. “Dans ce domaine, le brentuximab vedotin a été la substance la plus prometteuse ces dernières années, avec un bon rapport bénéfice/risque en monothérapie”, a rapporté l’expert. La bléomycine étant incluse dans le schéma ABVD plutôt pour des raisons historiques et présentant une faible efficacité associée à une toxicité pertinente, cette substance a été remplacée par le brentuximab vedotin (BV+AVD). L’étude a porté sur 170 patients d’un âge moyen de 29 ans. Le critère d’évaluation principal était le taux de patients PET-2 négatifs, qui est de 75% avec l’ABVD seul et devrait être de 85% avec le nouveau schéma, en excluant un taux de PET-2 négatifs de <75%. Après 2 cycles de traitement, 93/113 patients (82,3%, 95%CI 75,3-88,0) et 43/57 (75,4%, 95%CI 64,3-84,5) ont obtenu une TEP négative, sur la base d’une vérification centrale dans le bras expérimental et le bras standard. Avec une limite inférieure de l’intervalle de confiance à 95% supérieure à 75% (en réalité 75,4%) dans le bras expérimental, l’objectif principal peut être considéré comme atteint. Cependant, au cours des deux premiers cycles, des événements de grade 3 ou 4 ont été documentés chez 74% des patients dans le bras BV-AVD et chez 56% dans le bras ABVD. Les auteurs concluent que le taux de PET-2 négatifs avec BV-AVD est dans la fourchette cible, mais que cela s’accompagne d’une toxicité nettement plus élevée avec le traitement BV-AVD par rapport à l’ABVD dès les deux premiers cycles de traitement.
Les anticorps anti-PD1 sont-ils également appropriés en première ligne ?
Le nivolumab, anticorps anti-PD1, est autorisé dans le traitement du lymphome hodgkinien classique (LHC) récidivant ou réfractaire et présente un taux de réponse global (ROR) élevé et un profil de sécurité favorable. Afin d’évaluer l’efficacité du nivolumab en association avec la doxorubicine, la vinblastine et la dacarbazine (AVD) en tant que traitement de première ligne du LH classique intermédiaire (LHc), une étude prospective randomisée de phase II a été menée. Le traitement comprenait des patients atteints de LHC à un stade intermédiaire et naïfs de tout traitement. Les patients du bras A ont reçu 240 mg de nivolumab et d’AVD à des doses standard les jours 1 et 15 de chaque cycle de 28 jours pour un total de quatre cycles (4× NivoAVD). Dans le bras B, le même traitement a été administré de manière séquentielle, en commençant par 4× nivolumab à 2 semaines d’intervalle, suivi de 2× nivoAVD et 2× AVD. Les deux groupes ont reçu 30 Gy de radiothérapie involved-site (IS-RT). Le critère d’évaluation principal était le taux de RC basé sur le PET/CT à la fin du traitement de protocole, y compris la RC IS.
Les résultats ont montré que des événements indésirables (EI) ont été enregistrés chez 98% des patients. Les effets indésirables de grade 3 ou 4 sont survenus dans 73% et 78% des cas, respectivement, et des EI graves ont été observés chez 38% et 28% des patients, respectivement. Après la fin du traitement systémique, l’ORR était de 100% (54/54) et de 98% (50/51) avec un taux de RC de 81% et 86% respectivement. “L’étude montre un taux de RC inattendu après le nivolumab en monothérapie en première ligne du LHC à des stades intermédiaires”, a déclaré Borchmann. ” Le taux de RC élevé et très rapidement atteint après le traitement combiné par nivolumab et AVD suggère une synergie entre les différents principes thérapeutiques “. Les auteurs de l’étude estiment qu’aux stades intermédiaires, le traitement simultané ou séquentiel par nivolumab et AVD est possible avec une toxicité acceptable.
Traiter efficacement les stades avancés
L’atteinte disséminée des ganglions lymphatiques ou l’atteinte d’un organe, c’est-à-dire le stade III ou IV selon Ann-Arbor, sont considérés comme un stade avancé du lymphome hodgkinien. La norme internationale est de six à huit cycles d’ABVD, suivis d’une radiothérapie de consolidation sur les tumeurs initiales en masse ou résiduelles de plus de 1,5 cm de diamètre, bien qu’ici aussi, en l’absence de preuves issues d’études prospectives, une radiothérapie guidée par TEP soit souvent utilisée dans la pratique clinique. “Cependant, depuis la publication du GHSG-HD15, la norme dans le GHSG était de six cycles de BEACOPPescalés suivis d’une radiothérapie pour les patients présentant des tumeurs résiduelles TEP positives de plus de 2,5 cm”, a indiqué l’expert. Cette approche permet d’atteindre une survie globale de 95% à cinq ans, ce qui n’avait jamais été décrit auparavant dans aucune autre étude au monde. Mais il y a aussi des critiques : le schéma BEACOPPescalated conduit à un surtraitement de tous les patients qui auraient pu être guéris avec un traitement moins intensif comme l’ABVD. Il s’agit d’environ 2/3 des patients. “Cependant, une méta-analyse vient de confirmer à nouveau qu’une différence importante de PFS se traduit par une différence de survie dès 4-5 ans, qui s’accroît à son tour avec le temps de suivi. Le bénéfice en termes de survie (10%) de 6 cycles de BEACOPPescalated à 5 ans par rapport aux ABVD, constaté dans la méta-analyse en réseau, est non seulement étayé par les meilleures preuves possibles, mais aussi très pertinent sur le plan clinique”, a conclu l’orateur.
Source : “CLL et lymphome hodgkinien”, présentation lors du OnkoUpdate 2020, 29-30 janvier 2020 Berlin (D)
InFo ONKOLOGIE & HÄMATOLOGIE 2020 ; 8(1) : 26-27 (publié le 25.2.20, ahead of print)