Plusieurs études passionnantes sur le carcinome des cellules rénales ont été présentées lors de la réunion annuelle de l’ASCO de cette année. Pour les tumeurs localisées en particulier, la pratique clinique pourrait changer dans un avenir proche. En effet, pour la première fois, les inhibiteurs de points de contrôle semblent être une option efficace pour le traitement adjuvant. Et il y a aussi de nouvelles découvertes dans le traitement de première et deuxième ligne du carcinome avancé des cellules rénales.
Depuis des années, la recherche s’intéresse aux traitements adjuvants potentiels du carcinome rénal, mais sans succès jusqu’à présent. Malheureusement, l’utilisation d’inhibiteurs de tyrosine kinase n’a pas permis de progresser. Il existe ainsi un certain nombre d’études qui n’ont montré aucun avantage de survie, ou seulement un avantage minime, d’un traitement adjuvant par sunitinib, sorafenib, pazopanib et axitinib – avec une toxicité importante [1–5]. Lors de la réunion annuelle de l’ASCO, une étude a pu être présentée pour la première fois avec Keynote-564, dans laquelle un traitement adjuvant après néphrectomie s’est avéré prometteur. Cela pourrait bientôt changer durablement la pratique clinique. En effet, actuellement, après une néphrectomie, seul le suivi de la tumeur est recommandé, indépendamment de la taille et du grade de la tumeur. On sait toutefois depuis un certain temps que ces facteurs déterminent en grande partie le pronostic [6]. Il semble donc évident que les patients appartenant au groupe à haut risque – par exemple ceux présentant des tumeurs sarcomatoïdes dédifférenciées ou de grande taille – pourraient bénéficier d’un traitement adjuvant après néphrectomie.
Traitement adjuvant : les inhibiteurs de points de contrôle en ligne de mire
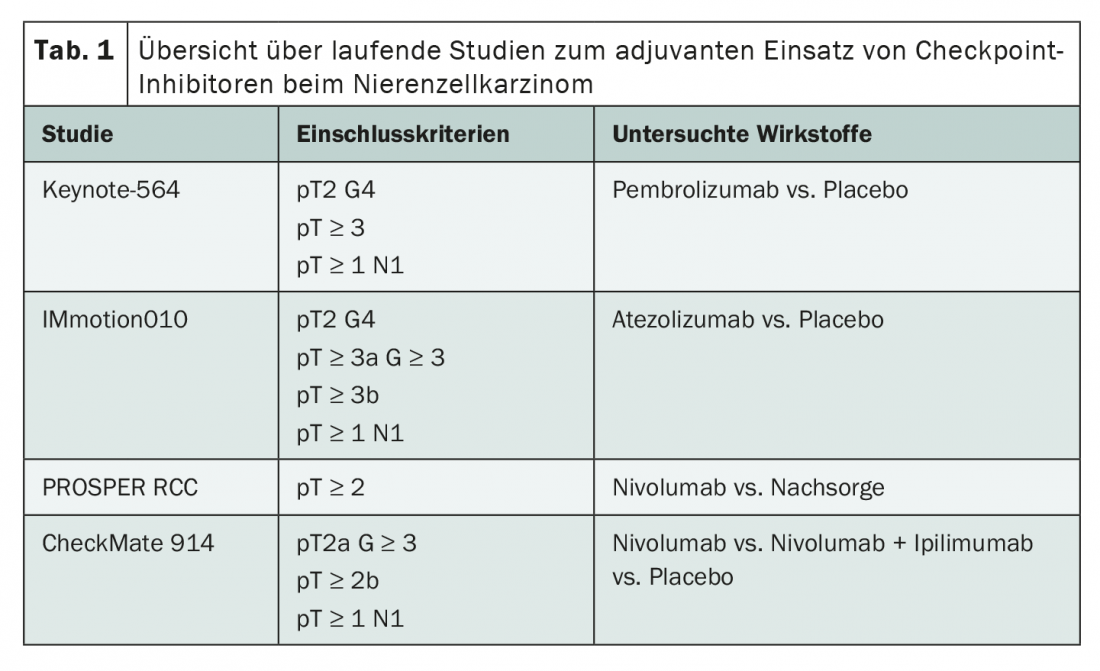
Alors qu’au cours de la dernière décennie, ce sont surtout les inhibiteurs de tyrosine kinase qui ont été étudiés dans le cadre d’un traitement adjuvant, l’accent est désormais mis sur l’immunothérapie au moyen d’inhibiteurs de points de contrôle. Quatre études sont actuellement en cours pour évaluer l’utilisation du pembrolizumab, de l’atezolizumab et du nivolumab en monothérapie ou en combinaison avec l’ipilimumab (tab. 1). Bien que les critères d’inclusion diffèrent quelque peu d’une étude à l’autre, l’accent est toujours mis sur les patients des groupes à risque intermédiaire et élevé. L’une des particularités de l’étude Keynote 564 et de l’étude IMmotion010 est que les patients ayant subi avec succès une chirurgie métastatique au cours de la première année suivant le diagnostic primaire ont également pu être inclus.
Les premiers résultats de Keynote-564 ont été présentés à la réunion annuelle de l’ASCO [7]. Dans l’étude de phase III, les patients inclus ont reçu soit le pembrolizumab soit un placebo pendant un an après la néphrectomie. Le suivi médian était de 24,1 mois. Tant la survie sans maladie (DFS) que la survie globale (OS) ont montré des avantages statistiquement significatifs du traitement adjuvant par pembrolizumab – malgré une période de suivi encore relativement courte. Ainsi, le taux de DFS à 24 mois était de 77,3%, contre 68,1% dans le bras contrôle (hazard ratio 0,68, p=0,001). Le taux de SG à 24 mois était de 96,6% dans le groupe d’intervention et de 93,5% sous placebo (hazard ratio 0,54, p=0,0164). Ces effets étaient présents dans tous les sous-groupes et d’une ampleur similaire. Les patients qui avaient préalablement subi une résection métastatique réussie semblaient particulièrement bénéficier de l’immunothérapie adjuvante. En ce qui concerne la tolérance, il n’y a pas eu de surprises. Comme on pouvait s’y attendre dans les études en monothérapie, environ 20% des patients ont présenté des effets secondaires graves correspondant au spectre d’effets secondaires connus du pembrolizumab. Il faut attendre des données plus mûres de l’étude Keynote 564 et les premières conclusions des autres études d’immunothérapie pour pouvoir évaluer les effets réels du traitement. Cependant, après de nombreuses années d’échec, il pourrait s’agir d’une option de traitement adjuvant du carcinome rénal, en particulier pour les patients à haut risque.
Carcinome avancé des cellules rénales : le traitement de première ligne évolue
Quelques découvertes ont également été présentées à l’ASCO Annual Meeting dans le domaine du traitement de première ligne du carcinome avancé des cellules rénales. Le traitement est en train d’évoluer avec l’introduction de différentes combinaisons d’immunothérapies et d’inhibiteurs de tyrosine kinase. Actuellement, différents traitements sont recommandés en fonction du profil de risque (tab. 2) [8]. De plus, le cabozantinib, un inhibiteur de tyrosine kinase (ITK) de troisième génération, a récemment été approuvé en première ligne de traitement en association avec le nivolumab, mais cette option n’est pas encore couverte par la ligne directrice. Il existe également une bonne base de données pour le traitement par lenvatinib + pembrolizumab, mais l’autorisation de mise sur le marché n’a pas encore été accordée [9,10]. Actuellement, le lenvatinib n’est autorisé en Suisse qu’en deuxième ligne de traitement après un inhibiteur du VEGF [11].
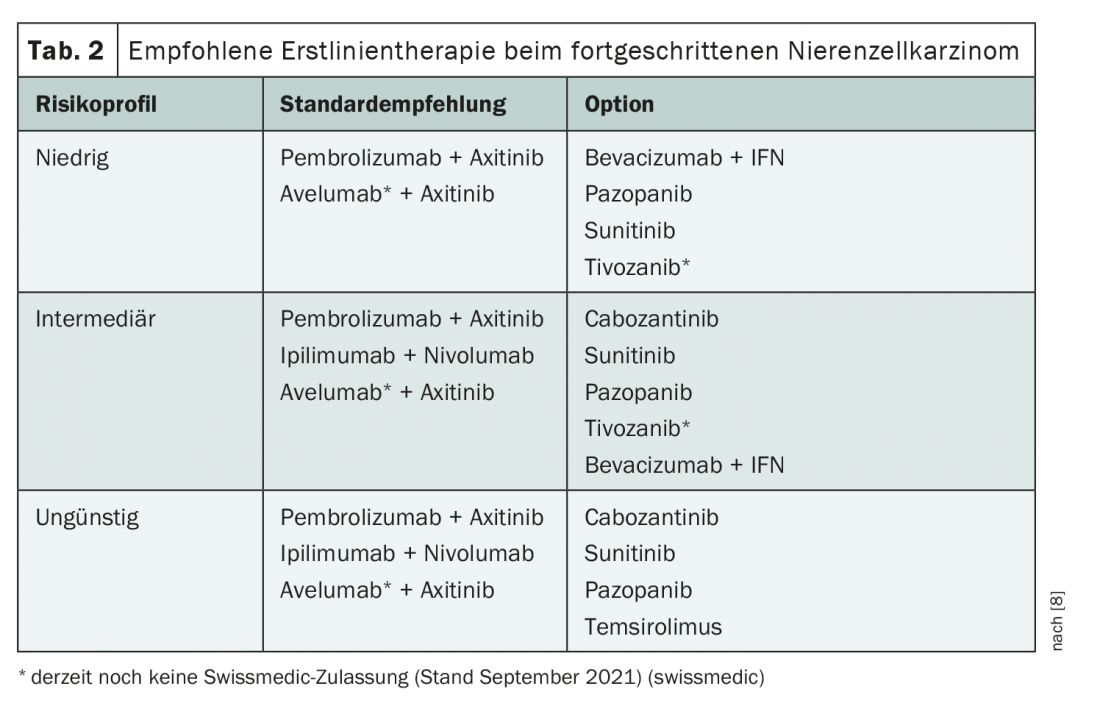
Parmi les différentes options, la question centrale est actuellement de savoir si les combinaisons d’immunothérapies TKI (IO) peuvent rivaliser à plus long terme avec la combinaison IO-IO nivolumab/ipilimumab, pour laquelle il existe déjà une longue période de suivi. Jusqu’à présent, les données pour les combinaisons nivolumab/ipilimumab, axitinib/pembrolizumab, cabozantinib/nivolumab et aussi pour la combinaison lenvatinib/pembrolizumab, qui n’a pas encore été approuvée, montrent des résultats similaires en termes de survie avec un hazard ratio d’environ 0,66 par rapport à la monothérapie par sunitinib [9,12–16]. Cependant, il n’y a pas de suivi à plus long terme pour les combinaisons IO-TKI. Une telle étude a été présentée pour axitinib/pembrolizumab lors de la réunion annuelle de l’ASCO de cette année [15]. Des taux d’OS et de PFS similaires à ceux des études sur l’association nivolumab/ipilimumab IO-IO ont été observés aux différents moments. A 36 mois, le taux de PFS sous chacun des deux traitements était d’environ 30% [14,15]. Il s’agit certainement d’une bonne nouvelle, mais il faut attendre des données supplémentaires sur la durée de la réponse. En fin de compte, le suivi de l’association TKI-IO axitinib/pembrolizumab montre des données cohérentes jusqu’à présent, sans nouvelles préoccupations en matière de sécurité.
De plus, des données sur les nouvelles combinaisons TKI-IO lanvatinib/pembrolizumab et cabozantinib/nivolumab ont été présentées à la réunion annuelle de l’ASCO. Alors que ces derniers sont nettement supérieurs au traitement par sunitinib seul chez les patients à risque intermédiaire et élevé, on observe jusqu’à présent une prolongation significative de la PFS chez les patients présentant un profil de risque favorable, mais sans effet sur l’OS [10,17]. Cela pourrait être dû à la période de suivi relativement courte, mais indique que le bénéfice de la double stratégie est potentiellement plus important dans le groupe intermédiaire et à haut risque que dans la population à faible risque. La question de savoir si les combinaisons d’ITK de troisième génération remplaceront à l’avenir d’autres combinaisons d’ITK-IO, par exemple celles avec l’axitinib, reste ouverte pour le moment.
Du nouveau sur la deuxième ligne
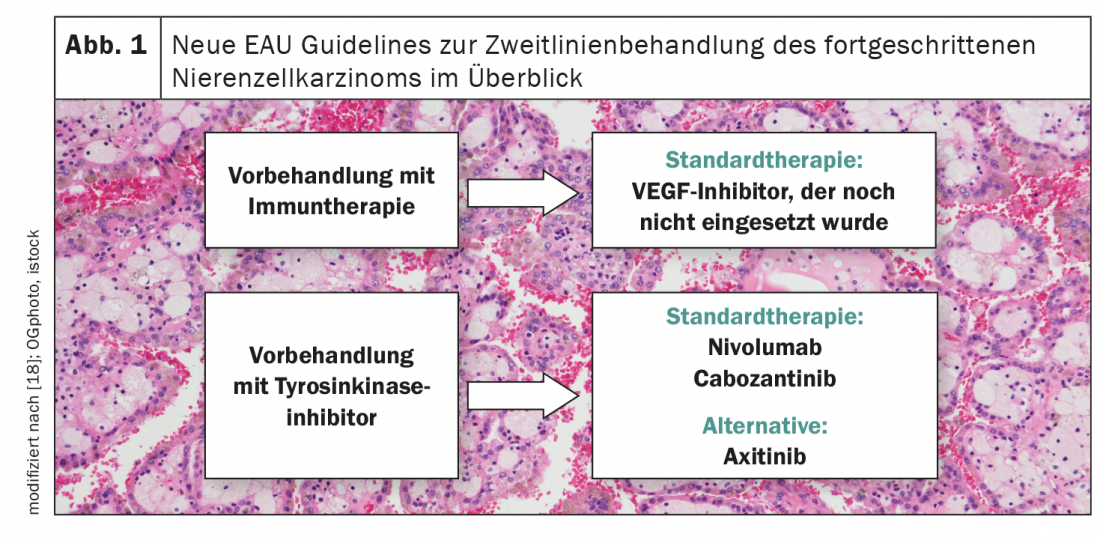
Après l’échec du traitement de première ligne, il n’existe toujours pas de recommandations solides pour le carcinome des cellules rénales, en particulier lorsque des immunothérapies ont été utilisées en première ligne de traitement (Fig. 1) [18]. Jusqu’à présent, il existe trois études prospectives dans ce cadre – toutes avec un seul bras. Alors qu’une SSP médiane de 8,8 mois a été observée avec le traitement par axitinib, elle était de 7,4 mois avec le traitement par pazopanib et de 6,8 mois avec le sunitinib [19-21]. L’étude CANTATA, présentée à l’ASCO Annual Meeting, a maintenant évalué l’efficacité du cabozantinib/télaglénastat en deuxième ligne et a comparé cette combinaison thérapeutique à l’administration de cabozantinib/placebo [22]. Si l’ajout du télaglénastat n’a pas montré d’avantage, le cabozantinib s’est révélé être un candidat prometteur pour le traitement de deuxième ligne du carcinome avancé des cellules rénales. Ainsi, dans le bras contrôle, la PFS médiane était de 9,3 mois avec un taux de réponse objective d’environ 30%.
Congrès : ASCO Annual Meeting
Littérature :
- Ravaud A, et al : Sunitinib adjuvant dans le carcinome à cellules rénales à haut risque après néphrectomie. N Engl J Med. 2016 ; 375(23) : 2246-2254.
- Eisen TQG, et al : Primary Efficacy analysis results from the SORCE trial (RE05) : Adjuvant sorafenib for renal cell carcinoma at intermediate or high risk of relapse : an international, randomised double-blind phase III trial led by the MRC CTU at UCL. Congrès ESMO 2019, Proffered Paper 2 – Tumeurs génito-urinaires, non-prostate, Abstract #2483.
- Motzer RJ, et al : Essai randomisé de phase III de pazopanib adjuvant versus placebo après néphrectomie chez des patients atteints de carcinome rénal localisé ou localement avancé. J Clin Oncol. 2017 ; 35(35) : 3916-3923.
- Haas NB, et al : Adjuvant sunitinib ou sorafenib pour le carcinome rénal non métastatique à haut risque (ECOG-ACRIN E2805) : un essai de phase 3 en double aveugle, contrôlé par placebo et randomisé. Lancet . 2016 ; 387(10032) : 2008-2016.
- Gross-Goupil M, et al : Axitinib vs placebo chez les patients à haut risque de carcinome rénal cellulaire récurrent (RCC) : Résultats de l’essai ATLAS. Congrès ESMO 2018, session de documents proposés – Tumeurs génito-urinaires, hors prostate, Abstract #1286.
- Gettman MT, et al : Stadification pathologique du carcinome cellulaire rénal : importance de la classification des tumeurs avec le système de classification TNM 1997. Cancer . 2001 ; 91(2) : 354-361.
- Choueiri TK, et al : Pembrolizumab versus placebo comme traitement adjuvant post-néphrectomie pour les patients atteints de carcinome cellulaire rénal : étude randomisée, en double aveugle, phase III KEYNOTE-564. ASCO Annual Meeting 2021, Abstract #LBA5.
- AWMF : S3-Leitlinie Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms, Langversion 2.0, Stand August 2020.
- Motzer R, et al : Lenvatinib plus pembrolizumab ou évérolimus pour le carcinome avancé des cellules rénales. N Engl J Med. 2021 ; 384(14) : 1289-1300.
- Grünwald V, et al : Analyse de l’étude CLEAR chez des patients (pts) atteints de carcinome rénal avancé (RCC) : Depth of response and efficacy for selected subgroups in the lenvatinib (LEN) + pembrolizumab (PEMBRO) and sunitinib (SUN) treatment arms. ASCO Annual Meeting 2021, Abstract #4560.
- www.swissmedicinfo.ch (dernier accès le 15.09.2021)
- Albiges L, et al : Nivolumab plus ipilimumab versus sunitinib pour le traitement de première ligne du carcinome rénal avancé : suivi étendu à 4 ans de la phase III CheckMate 214 trial. ESMO Open. 2020 ; 5(6) : e001079.
- Choueiri TK, et al : Nivolumab + cabozantinib vs sunitinib en traitement de première ligne du carcinome rénal avancé : premiers résultats de l’essai randomisé de phase III CheckMate 9ER. Annals of Oncology. 2020 ; 31 : S1142-1215.
- Motzer RJ, et al : Survival outcomes and independent response assessment with nivolumab plus ipilimumab versus sunitinib in patients with advanced renal cell carcinoma : 42-month follow-up of a randomized phase 3 clinical trial. J Immunother Cancer. 2020 ; 8(2).
- Rini BI, et al : Pembrolizumab (pembro) plus axitinib (axi) versus sunitinib en tant que traitement de première ligne du carcinome rénal à cellules claires avancé (ccRCC) : Results from 42-month follow-up of KEYNOTE-426. ASCO Annual Meeting 2021, Abstract #4500.
- Plimack ER, et al : Pembrolizumab plus axitinib versus sunitinib en tant que traitement de première ligne du carcinome rénal avancé (RCC) : Updated analysis of KEYNOTE-426. Journal of Clinical Oncology. 2020 ; 38(15_suppl).
- Apolo AB, et al : Nivolumab plus cabozantinib (N+C) versus sunitinib (S) pour le carcinome rénal avancé (aRCC) : résultats en fonction des caractéristiques de la maladie de base dans l’essai CheckMate 9ER de phase 3. ASCO Annual Meeting 2021, Abstract #4553.
- Ljungberg B, et al. : EAU Guidelines : Renal Cell Carcinoma 2021. https://uroweb.org/guideline/renal-cell-carcinoma/ (dernier accès le 15.09.2021)
- Ornstein MC, et al : Régime axitinib individualisé pour les patients atteints de carcinome rénal métastatique après traitement par inhibiteurs de points de contrôle : étude multicentrique, à un seul bras, de phase 2. Lancet Oncol. 2019 ; 20(10) : 1386-1394.
- Powles TB, et al : A phase II study of patients with advanced or metastatic renal cell carcinoma (mRCC) receiving pazopanib after previous checkpoint inhibitor treatment. Annales d’Oncologie. 2020 ; 31 : S564.
- Grande E, et al. : INMUNOSUN-SOGUG trial : A prospective phase II study to assess the efficacy and safety of sunitinib as second-line (2L) treatment in patients (pts) with metastatic renal cell cancer (RCC) that received immunotherapy-based combination upfront. Journal of Clinical Oncology. 2020 ; 38(15_suppl).
- Tannir NM, et al : CANTATA : Analyse primaire d’un essai global, randomisé, contrôlé par placebo (Pbo), en double aveugle de telaglenastat (CB-839) + cabozantinib versus Pbo + cabozantinib chez des patients atteints de carcinome rénal avancé/métastatique (mRCC) (pts) qui ont progressé sous inhibiteur de point de contrôle immunitaire (ICI) ou sous traitement anti-angiogénique. ASCO Annual Meeting 2021, Abstract #4501.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(4) : 33-34