Lors du congrès de l’EHA à Milan, le myélome multiple a été au centre de plusieurs événements. Quels sont les résultats actuels des inhibiteurs du protéasome et des médicaments immunomodulateurs et quelles sont leurs promesses pour l’avenir ? Comment améliorer la situation thérapeutique des patients âgés ? Trois experts ont donné des informations à ce sujet.
(ag) Le professeur Meletios Dimopoulos, Athènes, s’est exprimé sur l’utilisation du pomalidomide dans le myélome multiple avancé récidivant et réfractaire (rrMM) : “Sur la base des preuves actuellement disponibles, le pomalidomide et la dexaméthasone à faible dose sont bien tolérés dans le rrMM et constituent une option thérapeutique efficace pour les patients qui ont épuisé le traitement par lénalidomide et bortézomib”. La dose de départ optimale est de 4 mg/tgl. Pomalidomide aux jours 1 à 21 de chaque cycle de 28 jours, indépendamment des comorbidités. Selon le Pr Dimopoulos, il n’est pas nécessaire d’augmenter la posologie de 4 mg/jour. à adapter en cas d’altération légère à modérée de la fonction rénale (ClCr ≥45 ml/min). Cependant, un suivi étroit des effets secondaires doit être mis en place. La dexaméthasone est administrée à raison d’une dose de 40 mg par semaine. Pour les patients de plus de 75 ans, il faut réduire à 20 mg.
“Le traitement doit être poursuivi jusqu’à ce qu’une progression ou des toxicités inacceptables apparaissent. Une modification de la posologie est possible chez les patients présentant une neutropénie, une thrombocytopénie, et d’autres effets indésirables de grade 3 – 4. Une prophylaxie doit être envisagée pour prévenir les infections et les thromboembolies veineuses (TEV)”, ajoute-t-il. L’une d’entre elles comprend par exemple l’administration d’un facteur de stimulation des colonies de granulocytes (G-CSF) au cours des cycles 1 à 3 pour éviter les neutropénies, des antibiotiques (cycles 1 à 3) pour réduire le risque d’infection et une thromboprophylaxie (aspirine et héparine fractionnée de bas poids moléculaire en cas de risque élevé) pour minimiser le risque de TEV chez tous les patients.
Paysage thérapeutique 2014
Le professeur Paul G. Richardson, MD, Boston, a résumé la situation concernant les nouvelles substances actives comme suit :
Les inhibiteurs du protéasome (IP) et les médicaments immunomodulateurs (IMiD) montrent des améliorations significatives de la survie sans progression et de la survie globale [1]. Comme on comprend de mieux en mieux leur mode d’action, de nouvelles possibilités de combinaisons thérapeutiques apparaissent. La diminution de la durée de réponse et la baisse des taux de survie lorsque l’on additionne les régimes thérapeutiques de sauvetage réussis constituent un problème sérieux [2]. Les inhibiteurs du protéasome de nouvelle génération, tels que le carfilzomib, font actuellement l’objet d’études de phase III en association avec le lénalidomide et la dexaméthasone.
- La fonction immunitaire au moment de la ligne de base semble être un facteur clé de succès. Il est possible de les cibler (avec le blocage de PD1/PDL1).
- Les anticorps monoclonaux montrent une activité dans les formes de maladies à haut risque et représentent de nouvelles voies d’action (comme d’autres médicaments d’immunothérapie). Le daratumumab, un anticorps monoclonal humain anti-CD38, a démontré dans des études in vitro une destruction efficace des cellules tumorales exprimant le CD38. Une efficacité clinique est donc supposée. L’effet synergique d’une combinaison de daratumumab, de lénalidomide et de dexaméthasone est actuellement à l’étude. Les résultats [3] ont été présentés à l’ASCO 2014, ils sont prometteurs en termes de profil de sécurité et d’activité.
- De nombreux autres soi-disant “inhibiteurs de petites molécules” donnent de l’espoir. Une étude sur le panobinostat, inhibiteur de l’histone déacétylase (HDAC), a également été présentée par le professeur Richardson à l’ASCO cette année : Elle a montré que l’association panobinostat plus bortezomib plus dexaméthasone améliorait de manière très significative la survie sans progression par rapport aux deux autres agents seuls (à savoir de 3,9 mois en médiane). Les taux de réponse complète ont également presque doublé par rapport au bras contrôle [4].
Le facteur “âge
Le professeur Thierry Facon, de Lille, a parlé des options thérapeutiques pour les patients atteints de MM récemment diagnostiqués et qui ne sont pas éligibles à une greffe de cellules souches : “Le myélome multiple est avant tout une maladie de personnes âgées. Toutefois, un âge plus avancé exclut presque toujours la transplantation.
Quelles sont donc les options pour cette population ? Dans l’étude FIRST [5], nous avons montré que le traitement oral continu par lénalidomide + dexaméthasone à faible dose était significativement supérieur à la triple combinaison melphalan + prednisone + thalidomide et lénalidomide + dexaméthasone pendant 18 cycles”. La survie sans progression a été de 25,5, 21,2 et 20,7 mois respectivement. Nous avons également constaté un bénéfice de cette option thérapeutique dans l’analyse intérimaire de la survie globale. On devrait donc envisager ici le régime continu comme nouveau standard”.
Les facteurs associés à une survie plus courte lors d’un traitement par melphalan + prednisone + thalidomide et/ou bortezomib comprennent, selon une méta-étude [6] :
- Âge (>75 ans)
- Insuffisance rénale
- effets secondaires cardiaques/infectieux graves
- Interruption de la thérapie
Une étude également présentée au congrès 2014 de l’EHA a constaté une augmentation significative du risque de toxicité et un mauvais résultat (survie globale) pour les patients fragiles (c’est-à-dire âgés, comorbides, en mauvais état cognitif et fonctionnel) [7].
Défis pour l’avenir
Selon le professeur Facon, de grands progrès ont donc été réalisés ces dernières années chez les patients atteints de MM et candidats à une transplantation de cellules souches.
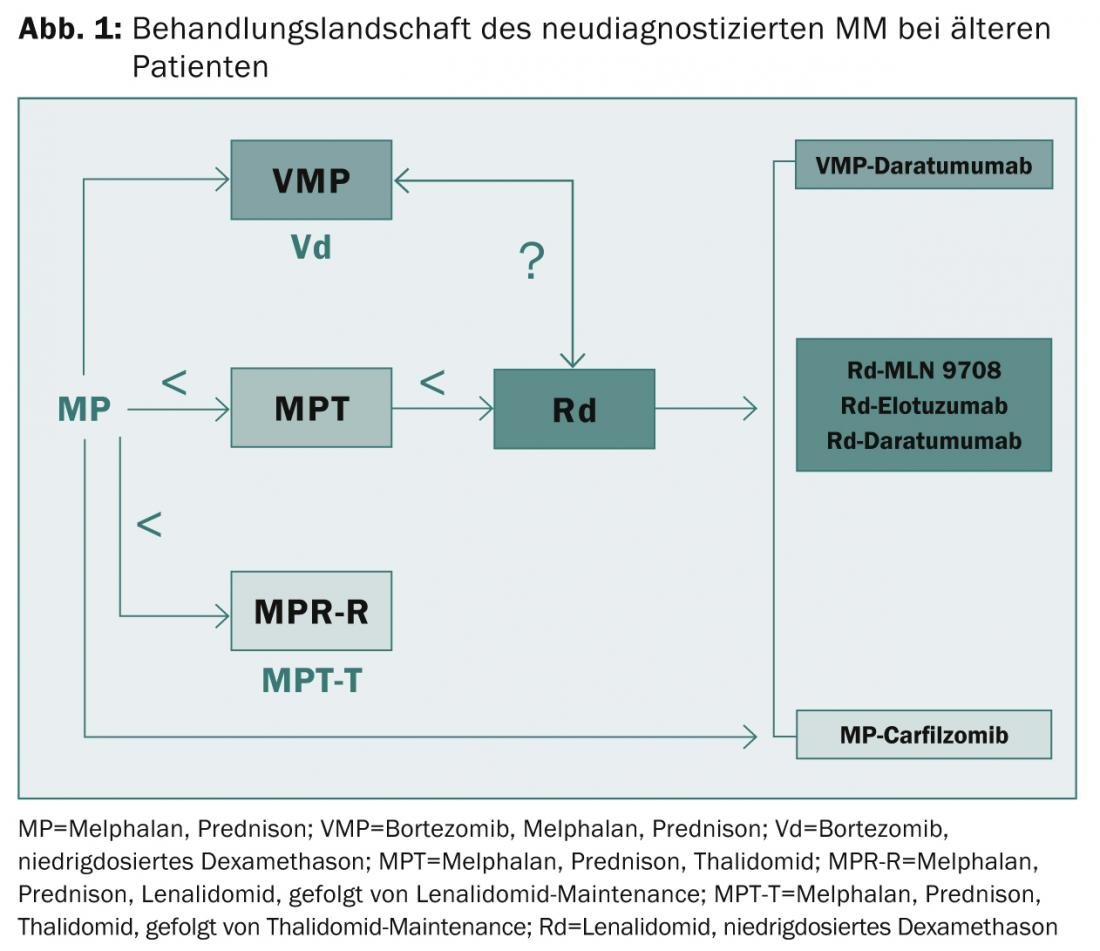
n’entrent pas en ligne de compte. La survie médiane sans progression a été prolongée d’environ 10-15 à 25-30 mois et la survie globale d’environ 30 à 60 mois. “Néanmoins, les patients à haut risque continuent de souffrir d’un très mauvais résultat, même avec les nouvelles molécules de première génération”, a résumé l’expert. “Le besoin d’options thérapeutiques innovantes et d’une évaluation des risques appropriée reste donc important. Les patients fragiles représentent un défi permanent. Dans ce contexte, il peut être utile d’évaluer précisément les fonctions organiques, les comorbidités, les fragilités et les handicaps”, a déclaré le professeur Facon. “Les IP, les IMiD et les anticorps monoclonaux de deuxième et troisième génération joueront un rôle crucial dans la résolution de ces problèmes à l’avenir (Fig. 1)“.
Source : Congrès EHA 2014, 12-15 juin 2014, Milan
Littérature :
- Kumar SK, et al : Blood 2008 Mar 1 ; 111(5) : 2516-2520.
- Kumar SK, et al : Mayo Clin Proc 2004 Jul ; 79(7) : 867-874.
- Plesner T, et al : J Clin Oncol 2014 ; 32 : 5s (suppl ; abstr 8533).
- Richardson PG, et al : J Clin Oncol 2014 ; 32 : 5s (suppl ; abstr 8510).
- Facon T, et al : EHA 2014 #Abstract S643.
- Bringhen S, et al : Haematologica 2013 Jun ; 98(6) : 980-987.
- Mina R, et al : EHA 2014 #Abstract P354.
InFo Oncologie & Hématologie 2014 ; 2(6) : 31-32