L’un des avantages de l’IRM à très haut champ (7T) est une représentation à haute résolution grâce à un rapport signal/bruit plus élevé. C’est particulièrement intéressant pour l’IRM fonctionnelle et la spectroscopie. Cependant, l’IRM 7T reste l’exception en matière d’application clinique et les preuves d’efficacité se limitent jusqu’à présent à des pathologies isolées.
Depuis l’introduction de l’IRM au début des années 1980, cette technologie a pris une place prépondérante dans le diagnostic du système nerveux central (SNC), la recherche neuroscientifique et les applications cliniques des maladies neurologiques. Comme la résolution des structures tissulaires dépend fortement du signal qui peut être reçu et de l’intensité du champ, des champs de plus en plus intenses ont été développés au fil des années pour les applications humaines. Aujourd’hui, le système 3 Tesla (T) est le standard haut de gamme dans la routine clinique, bien que les nouveaux tomographes RM de 1,5 T continuent à avoir leur place en raison des évolutions des bobines et des séquences. Des intensités de champ plus élevées, comme 7T, permettent d’obtenir des améliorations supplémentaires du rapport signal sur bruit (SNR) et donc de la résolution d’image. Il est en outre possible de générer de nouveaux contrastes de tissus. D’autre part, plus l’intensité du champ est élevée, plus les problèmes d’artefacts, notamment de déphasage et de “ghosting”, augmentent. Cet article donne un aperçu de l’état actuel de l’imagerie IRM 7T sous l’angle de son utilisation clinique potentielle, en mettant en balance les avantages et les contraintes.
Avantages et défis
Aujourd’hui, plusieurs IRM 7T sont disponibles pour la recherche mais aussi pour des applications cliniques. Les prédictions étaient que le RSB plus élevé permettrait de visualiser de très petites structures anatomiques, ainsi que des examens fonctionnels et métaboliques, et donc une analyse plus poussée, en particulier dans les pathologies neurologiques, avec une précision jamais atteinte auparavant. Certaines pathologies neurologiques pour lesquelles un gain d’informations était attendu étaient l’épilepsie, les tumeurs cérébrales, la sclérose en plaques et la maladie d’Alzheimer. Cependant, l’augmentation de l’intensité du champ due à de nouveaux contrastes et à des artefacts amplifiés constitue également un défi, de sorte que le matériel et le logiciel ont également dû être développés. Le développement de nouvelles technologies de bobines a permis de réaliser des progrès dans ce domaine [12].
Au début, il n’était pas clair si les intensités de champ plus élevées (en plus des restrictions liées à l’imagerie) pouvaient également entraîner des réactions physiologiques accrues chez les sujets. Entre-temps, certaines études ont montré qu’il n’y avait pas d’augmentation des sensations ou des effets secondaires, à l’exception d’une augmentation passagère des vertiges lors de l’entrée dans l’aimant [22]. Il n’y a donc en principe aucune restriction à attendre de cet aspect dans l’utilisation de l’IRM 7T. Il reste cependant des coûts d’examen élevés ainsi que des temps d’examen encore un peu plus longs par rapport aux autres appareils.
Maladies neurologiques avec bénéfice possible en 7T
Les régions du cerveau proches des structures osseuses remplies d’air de la base du crâne représentent un défi en raison des artefacts de déphasage accrus, en particulier à 7T. Cette région, y compris l’hippocampe, représente pourtant une structure importante, entre autres, dans l’élucidation d’épilepsies jusqu’ici cryptogéniques. Les séquences optimisées pondérées par le proton (PD), T2 et T2*, ainsi que T1 MPRAGE avec une résolution isotrope de 0,5 mm, ont surmonté ces limitations dues à l’augmentation des artefacts et ont permis d’obtenir des images à très haute résolution in vivo avec un temps de mesure raisonnable [21]. Cela a permis d’obtenir des représentations anatomiques précises et individuelles in vivo, avec une meilleure détectabilité de très petites pathologies dans l’épilepsie ou même la démence d’Alzheimer, qui n’étaient pas visualisables jusqu’à 3T [4]. Dans d’autres régions du cerveau, la résolution “in-plane” nettement accrue grâce au RSB plus élevé peut également contribuer à améliorer la représentation des pathologies corticales. Dans certains cas, cela peut conduire à une modification du concept thérapeutique, lorsqu’une épilepsie auparavant “cryptogénique” devient une épilepsie avec un foyer détectable [25].
Une meilleure représentation de certaines propriétés tissulaires typiques (par ex. imagerie du fer) a également été obtenue à 7T pour certaines maladies dégénératives. Celle-ci a désormais une place dans l’analyse multimodale de l’imagerie de la maladie d’Alzheimer, de la maladie de Parkinson et de la sclérose en plaques. Par exemple, dans la maladie de Parkinson, on observe une augmentation des dépôts de fer dans certaines structures cérébrales (ganglions de la base) et ceux-ci sont associés à une évolution progressive de la maladie, une atrophie optique et cérébelleuse, une dystonie et une spasticité. Dans la maladie de Parkinson, l’imagerie pondérée en fonction de la susceptibilité (SWI) à 7T a également été utilisée ces dernières années et des modifications de la sous-structure de la substance noire ont été décrites. Une augmentation de la susceptibilité de la pars compacta a été observée par rapport aux contrôles. Cependant, il n’y a pas seulement des différences dans la teneur en fer, mais aussi dans la représentation de la sous-structure, comme le nigrosome 1 [2]. Bien qu’il soit désormais possible de visualiser certaines modifications à 3T avec des séquences et du matériel optimisés [3], la résolution à 7T reste avantageuse pour des questions spécifiques. Les différenciations entre les différentes évolutions de la maladie et les sous-groupes ainsi que les maladies prodromiques (entre autres les troubles du sommeil) peuvent être effectuées de manière plus fiable avec 7T qu’avec 3T [5]. Des dépôts de fer réduits peuvent également être détectés dans d’autres maladies en 7T, par exemple dans le syndrome des jambes sans repos dans le thalamus et le noyau denté, ce qui semble donner à cette maladie des similitudes avec les mouvements périodiques du tronc, ce qui n’était pas connu auparavant [13].
Pour une autre maladie dégénérative, la maladie d’Alzheimer, une meilleure représentation des sous-structures telles que les plaques corticales a été démontrée. En outre, l’amélioration de la résolution de l’hippocampe mentionnée ci-dessus a également été un avantage dans l’attribution du diagnostic. Presque toutes les sous-unités de l’hippocampe ainsi que le cortex entorhinal montrent une réduction de volume sur les images à haute résolution 7T, même par rapport aux patients atteints de “Mild Cognitive Impairment” (MCI) [27].
De nos jours, les diagnostics avancés en IRM ne se limitent pas aux images purement structurelles, mais incluent souvent des séquences métaboliques et fonctionnelles. La spectroscopie RM est une séquence qui profite beaucoup de l’intensité ultra élevée du champ. Les applications cliniques, en plus de la différenciation traditionnelle déjà bien établie à 3T dans les tumeurs cérébrales ou les maladies métaboliques, sont dans l’application 7T pour la détection de changements même plus subtils des métabolites, par exemple dans la sclérose latérale amyotrophique. L’IRM 7T est particulièrement avantageuse pour les métabolites de petite taille et plutôt peu stables [19], cela concerne également l’imagerie de groupes de patients atteints de maladies métaboliques, chez lesquels des métabolites moins proéminents peuvent être détectés avec certitude.
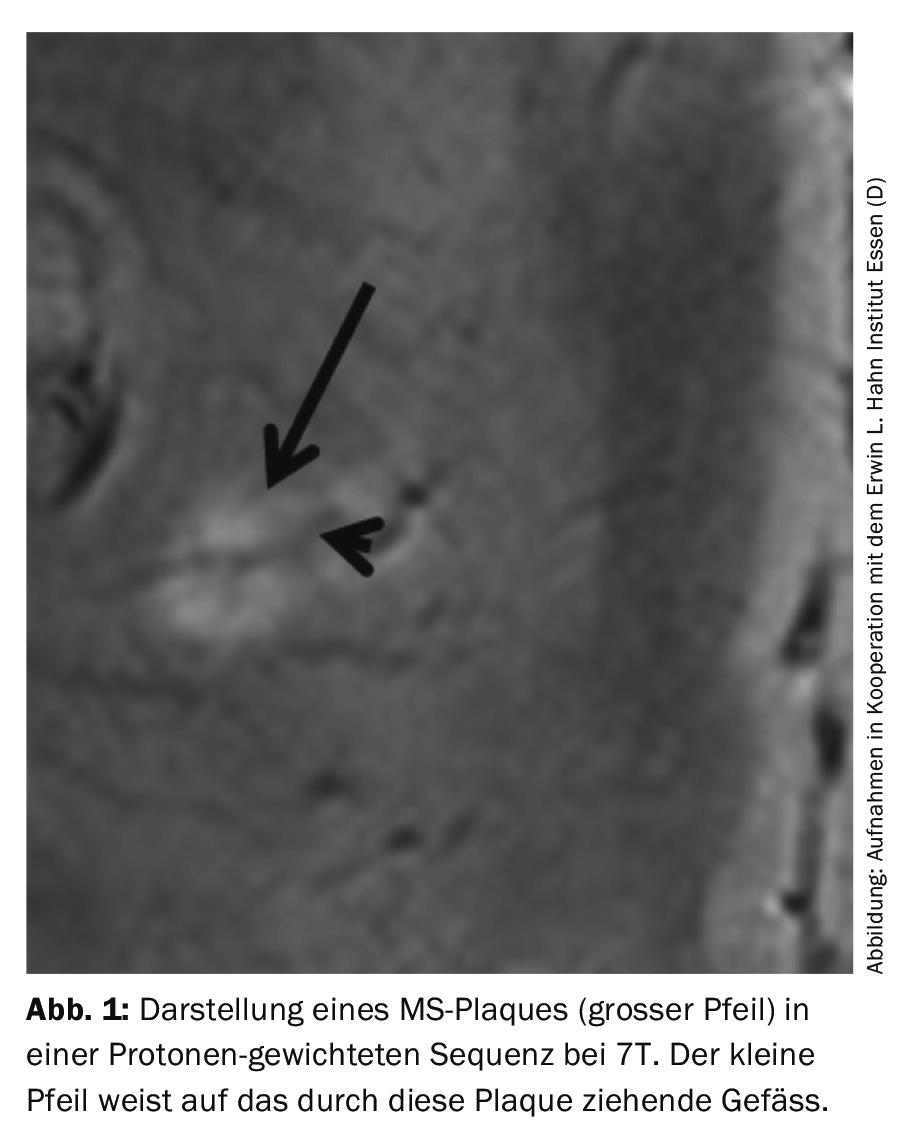
L’IRM est aujourd’hui l’étalon-or pour le diagnostic de la sclérose en plaques (SEP). Néanmoins, on trouve toujours des patients présentant ce que l’on appelle le “syndrome cliniquement isolé” (CIS) avec une absence de corrélation à 1,5 et 3T. Le RSB encore plus élevé à 7T permet également de détecter de très petites lésions, par exemple intra-corticales, dans cette maladie [8,11]. De plus, la structure typique des lésions de SEP au niveau cérébral a pu être représentée pour la première fois avec une résolution presque histologique in vivo (Fig. 1) et une différenciation entre la SEP et la neuromyélite optique a pu être obtenue [18]. Un développement supplémentaire des représentations en contraste de phase a également permis d’améliorer la différenciation des lésions aiguës et chroniques ; de plus, des méthodes quantitatives (par exemple la cartographie R2*) ou de nouvelles séquences comme la séquence “Double Inversion Recovery” (DIR) ont été établies [9]. A l’heure où l’on se demande si l’agent de contraste IRM peut vraiment continuer à être considéré comme sûr, une telle alternative pourrait revêtir une plus grande importance dans les études de suivi. Dans le groupe des patients atteints de CIS, un protocole 7T optimisé, qui inclut également les cartographies SWI, permet de détecter, outre les petites représentations de plaque, un dépôt de fer déjà subtilement augmenté.
Pathologies vasculaires et imagerie à haute résolution
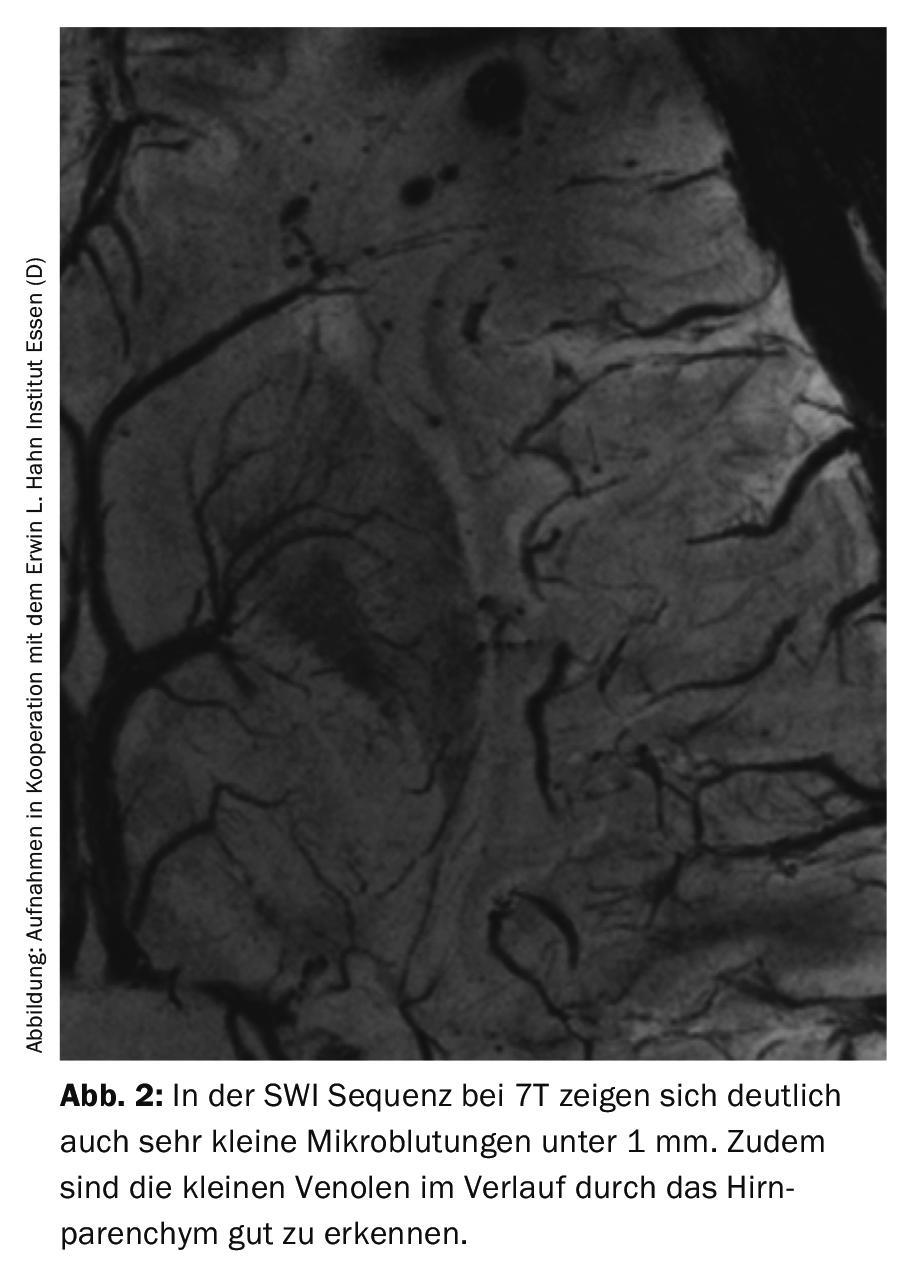
En raison de la résolution plus élevée et de la sensibilité accrue aux artefacts, une séquence en particulier profite de la représentation de très petits dépôts d’hémosidérine, à savoir la SWI à 7T. [20] (Fig.2). Outre la question des microhémorragies dans les maladies vasculaires, l’affichage à haute résolution dans les séquences T2 et FLAIR peut également être utile, par exemple pour détecter les microinfarctus qui peuvent survenir en cas d’hémorragie intracérébrale et qui sont apparemment plus fréquents que ce que l’on pensait jusqu’à présent, car ils n’étaient souvent pas vus avant 3T. [24].
En outre, la représentation des vaisseaux intracérébraux bénéficie également de la haute résolution à 7T avec une précision jamais atteinte auparavant. Il permet ainsi de visualiser très facilement les artères lenticulostriées. Une observation intéressante à cet égard a été que ces artères diffèrent nettement chez les hypertendus par rapport aux sujets témoins – une autre observation qui n’avait pas été possible auparavant et qui peut contribuer à la compréhension de l’origine des lésions microangiopathiques [10]. De plus, il est désormais possible de visualiser les parois des vaisseaux intracrâniens en haute résolution [26]. De nouveaux contrastes ont également été intéressants, comme la possibilité de générer des images vasculaires intracrâniennes avec l’écho de gradient rapide préparé par magnétisation (MPRAGE) sans produit de contraste au lieu de l’ARM en temps réel (TOF MRA) [15]. Une application clinique possible de l’ARM TOF optimisée est la visualisation fiable des anévrismes intracrâniens, même en dessous de 3 mm. Dans ce cas (si l’IRM 7T continue à se répandre), il serait utile de pouvoir diagnostiquer les patients de manière fiable et sûre, même sans angiographie invasive [17].
L’amélioration de la visualisation des micro-hémorragies avec une sensibilité accrue dans le SWI à 7T n’est pas seulement utile dans la recherche d’angiopathies amyloïdes. Les vascularisations tumorales accrues, les micrométastases dans les mélanomes et les petites lésions axonales après un traumatisme ou les microhémorragies consécutives à une irradiation peuvent également être visualisées avec une plus grande sensibilité [1,16]. L’imagerie des cavernomes peut ici être utile à la fois dans la détectabilité d’autres cavernomes très petits (par exemple dans le cas d’une “Anomalie Veineuse de Développement” découverte par hasard [DVA]), mais aussi dans une meilleure résolution des structures internes d’un cavernome.
IRM fonctionnelle clinique (IRMf)
L’IRMf 3T est actuellement la norme dans les études expérimentales, mais aussi de plus en plus dans les applications cliniques. Cette méthode, grâce à un RSB déjà plus élevé que celui de 1,5 T, est une très bonne méthode pour améliorer le signal, par ailleurs très faible, en IRMf et obtenir ainsi des résultats plus valides avec des artefacts de susceptibilité acceptables. Toutefois, l’application clinique reste limitée par le signal encore faible et par la nécessité d’obtenir des résultats fiables au niveau du sujet unique (le patient individuel). Ce problème peut être surmonté, du moins en partie, par des intensités de champ encore plus élevées (bien qu’avec l’inconvénient d’une plus grande sensibilité aux artefacts). Après que les premières études ont montré les avantages de l’IRMf 7T dans l’application au cerveau entier [6], d’autres optimisations ont été réalisées, permettant même de remplacer la mesure habituelle en bloc par une mesure à événement unique. D’autres études ont suivi, qui ont permis de confirmer et de développer les avantages de l’IRM 7T, notamment dans le cadre d’applications cliniques.
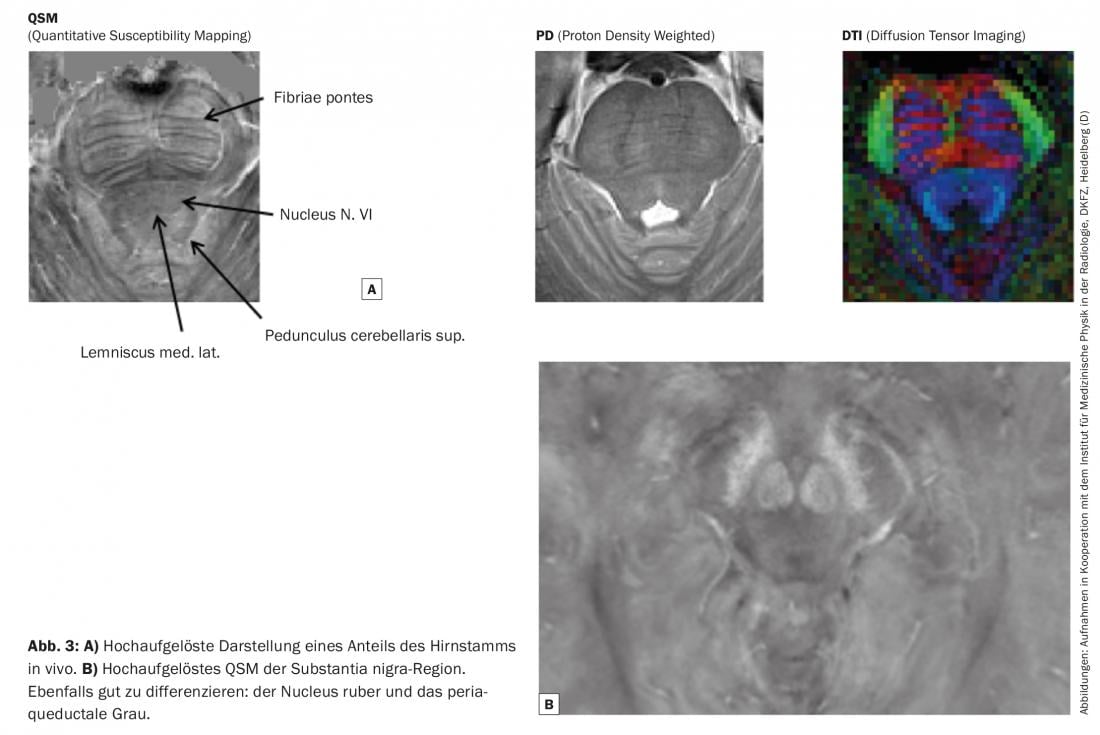
En particulier, des techniques ont été développées pour réduire les artefacts dans l’imagerie à très haut champ, qui sont très accentués dans l’imagerie échoplanaire [14]. L’ultra-haut champ permet également de cartographier les régions motrices avec une résolution beaucoup plus élevée, ce qui peut présenter des avantages dans le cadre d’une évaluation pré-chirurgicale. De plus, des structures cérébrales profondes qui étaient plus difficiles à activer à des intensités de champ plus faibles ont pu être activées de manière fiable à 7T : par exemple, le noyau denté dans une tâche de génération de verbe [23]. L’optimisation de la représentation de la fonction et de la sous-structure du tronc cérébral fait également partie de ce champ d’application. De nombreuses unités fonctionnelles centrales, qui jouent un rôle important dans les maladies douloureuses par exemple, y sont étroitement regroupées. Avec un RSB plus élevé, il est désormais possible de visualiser également ces sous-structures [7] (Fig. 3). Il reste cependant à démontrer dans un avenir proche les bénéfices cliniques réels.
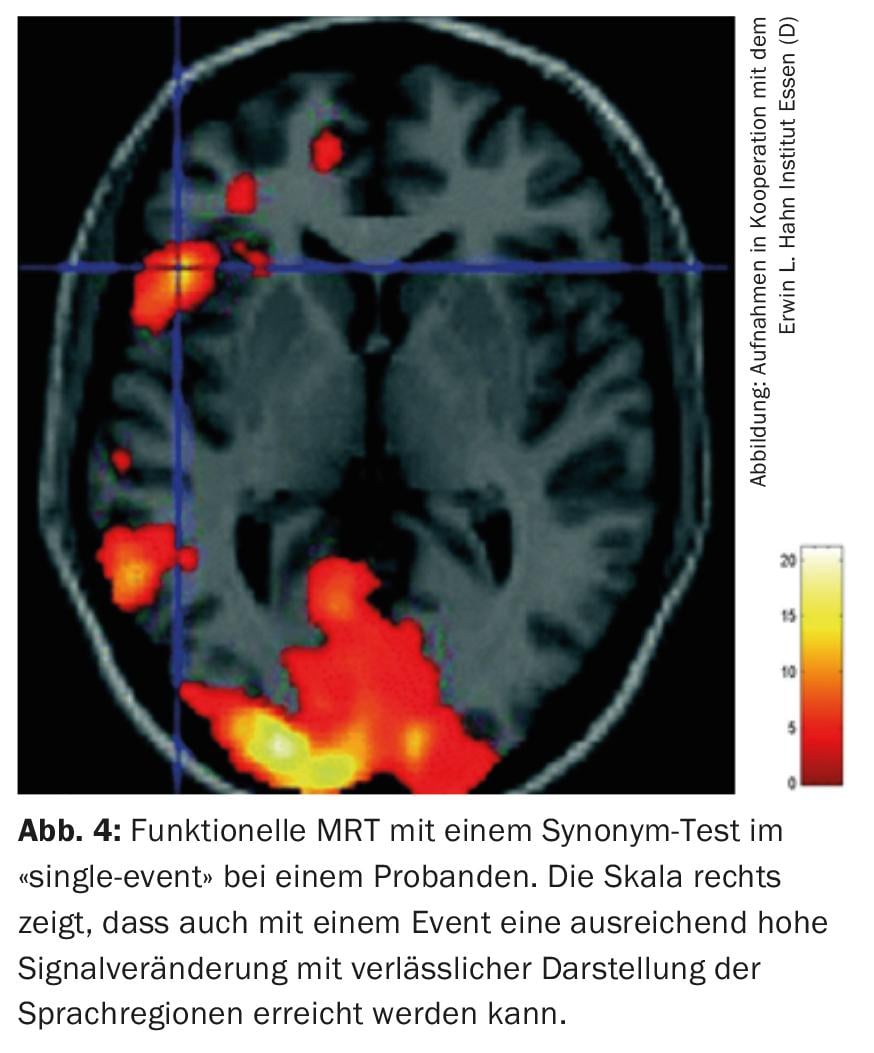
Outre les avantages évidents de l’IRM à très haut champ, notamment dans les applications fonctionnelles en sciences cognitives, les applications cliniques bénéficient donc également de l’intensité plus élevée du champ. Grâce à la possibilité d’effectuer des mesures à événement unique, il est possible d’effectuer des mesures IRMf pré-chirurgicales chez des patients dont la fonction à examiner (motricité ou langage) est déjà partiellement limitée (fig. 4). Une seule mesure est généralement encore réalisable, mais plusieurs mesures “on-off” représentent souvent une surcharge.
Conclusion
Dans l’ensemble, l’IRM 7T reste une exception dans les applications cliniques. Même si de nombreuses limitations dues aux artefacts et aux modifications de l’image ont été améliorées par de nouveaux développements, l’utilité clinique n’a été prouvée avec certitude que pour certaines maladies et se limite généralement à quelques sous-groupes (certainement en raison des coûts encore élevés et donc de la faible diffusion de l’IRM 7T). Toutefois, dans ces groupes sélectionnés, les nouvelles informations fournies par les images 7T peuvent tout à fait conduire à des modifications des concepts thérapeutiques. Cependant, les bénéfices sont plus fréquents pour certaines maladies du système nerveux central, grâce à de nouvelles perspectives in vivo sur les mécanismes pathologiques sous-jacents.
Messages Take-Home
- L’imagerie par résonance magnétique (IRM) est l’une des méthodes les plus importantes dans le diagnostic et le traitement de nombreuses maladies. La norme clinique élevée est aujourd’hui une intensité de champ de 3 teslas (T).
- L’IRM à très haut champ (7T dans la plupart des cas) offre déjà des perspectives cliniques, comme nous l’avons vu dans cet article, mais présente encore quelques problèmes et limites à l’heure actuelle.
- Grâce à l’augmentation significative du rapport signal sur bruit (SNR), les avantages de la représentation à haute résolution, presque histologique, de certaines structures et pathologies cérébrales sont évidents.
- L’IRM fonctionnelle (IRMf) et les examens métaboliques (spectroscopie RM) en bénéficient particulièrement.
Littérature :
- Bian W, et al : Susceptibility-weighted MR imaging of radiation therapy-induced cerebral microbleeds in patients with glioma : a comparison between 3T and 7T. Neuroradiologie 2014 ; 56(2) : 91-96.
- Blazejewska AI, et al. : Visualisation du nigrosome 1 et de sa perte dans la MP : corrélation pathoanatomique et IRM 7T in vivo. Neurology 2013 ; 81(6) : 534-540.
- De Marzi R, et al : Perte de l’hyperintensité nigrale dorsolatérale sur l’imagerie de susceptibilité pondérée à 3,0 tesla dans le trouble idiopathique du comportement du sommeil à mouvement oculaire rapide. Ann Neurol 2016 ; 79(6) : 1026-1030.
- Derix J, et al. : Visualisation de la frontière amygdalo-hippocampique et de sa variabilité structurelle par imagerie par résonance magnétique 7T et 3T. Hum Brain Mapp 2014 ; 35(9) : 4316-4129.
- Frosini D, et al : Seven tesla MRI of the substantia nigra in patients with rapid eye movement sleep behavior disorder. Parkinsonism Relat Disord 2017 ; 43 : 105-109.
- Gizewski ER, et al : fMRI at 7T : whole-brain coverage and signal advantages even infratentorially ? Neuroimage 2007 ; 37(3) : 761-768.
- Gizewski ER, et al : Anatomie en haute résolution de la tige cérébrale humaine en utilisant l’IRM 7-T : amélioration de la détection des structures internes et des nerfs ? Neuroradiologie 2014 ; 56(3) : 177-186.
- Harrison DM, et al : Les lésions thalamiques dans la sclérose en plaques par IRM 7T : implications cliniques et relation avec la pathologie corticale. Mult Scler 2015 ; 21(9):1139-1150.
- Inglese M, et al. : Applications cliniques de l’imagerie par résonance magnétique à très haut champ dans la sclérose en plaques. Expert Rev Neurother 2018 ; 18(3) : 221-230.
- Kang CK, et al : Hypertension correlates with lenticulostriate arteries visualized by 7T magnetic resonance angiography. Hypertension 2009 ; 54(5) : 1050-1056.
- Kollia K, et al : Première étude clinique sur l’imagerie IRM à très haut champ chez les patients atteints de sclérose en plaques : comparaison entre 1,5T et 7T. AJNR Am J Neuroradiol 2009 ; 30(4) : 699-702.
- Kraff O, Quick HH : 7T : Physics, safety, and potential clinical applications. J Magn Reson Imaging 2017 ; 46(6) : 1573-1589.
- Li X, et al : Déficience du cerveau en fer dans le syndrome idiopathique des jambes sans repos mesurée par susceptibilité magnétique quantitative à 7 Tesla. Sleep Med 2016 ; 22 : 75-82.
- Lima Cardoso P, et al : The clinical relevance of distortion correction in presurgical fMRI at 7T. Neuroimage 2018 ; 168 : 490-498.
- Maderwald S, et al. : To TOF or not to TOF : strategies for non-contrast-enhanced intracranial MRA at 7T. MAGMA 2008 ; 21(1-2) : 159-167.
- Moenninghoff C, et al : Lésion axonale diffuse à l’IRM à champ ultra-élevé. PLoS One 2015 ; 10(3) : e0122329.
- Monninghoff C, et al : Evaluation of intracranial aneurysms with 7T versus 1.5 T time-of-flight MR angiography – initial experience. Rofo 2009 ; 181(1) : 16-23.
- Sinnecker T, et al : MRI phase changes in multiple sclerosis vs neuromyelitis optica lesions at 7T. Neurol Neuroimmunol Neuroinflamm 2016 ; 3(4) : e259.
- Terpstra M, et al : Test-retest reproducibility of neurochemical profiles with short-echo, single-voxel MR spectroscopy at 3T and 7T. Magn Reson Med 2016 ; 76(4) : 1083-1091.
- Theysohn JM, et al : 7Tesla MRI of microbleeds and white matter lesions as seen in vascular dementia. J Magn Reson Imaging 2011 ; 33(4) : 782-791.
- Theysohn JM, et al. : L’hippocampe humain à 7T–in vivo MRI. Hippocampus 2009 ; 19(1) : 1-7.
- Theysohn JM, et al : Acceptation subjective de l’IRM 7Tesla pour l’imagerie humaine. MAGMA 2008 ; 21(1-2) : 63-72.
- Thurling M, et al. : Activation du noyau denté dans une tâche de génération de verbes : une étude IRM 7T. Neuroimage 2011 ; 57(3) : 1184-1191.
- van Veluw SJ, et al : Micro-infarctus corticaux sur l’IRM 7T chez les patients souffrant d’hémorragie intracérébrale spontanée. J Cereb Blood Flow Metab 2014 ; 34(7) : 1104-1106.
- Veersema TJ, et al : Seven tesla MRI improves detection of focal cortical dysplasia in patients with refractory focal epilepsy. Epilepsia Open 2017 ; 2(2) : 162-171.
- Viessmann O, et al. : T2-Weighted intracranial vessel wall imaging at 7Tesla using a DANTE-prepared variable flip angle turbo spin echo readout (DANTE-SPACE). Magn Reson Med 2017 ; 77(2) : 655-663.
- Wisse LE, et al : Utrecht Vascular Cognitive Impairment Study. Volumes du sous-champ hippocampique à 7T dans la maladie d’Alzheimer précoce et le vieillissement normal. Neurobiol Aging 2014 ; 35(9) : 2039-2045.
InFo NEUROLOGIE & PSYCHIATRIE 2018 ; 16(6) : 28-33