En octobre, le congrès annuel des sociétés allemande, autrichienne et suisse d’hématologie et d’oncologie médicale s’est tenu à Bâle. Un symposium scientifique a été consacré à la prise en charge du myélome multiple en fonction du risque et de l’âge. Les patients atteints de myélome âgés de plus de 75 ans peuvent bénéficier d’un traitement adapté et moins toxique, car les effets secondaires sont moins nombreux et le traitement doit être interrompu moins souvent en raison d’effets indésirables.
Le diagnostic et le traitement du myélome multiple (MM) ont beaucoup évolué ces dernières années. L’évaluation du risque individuel du patient est de plus en plus importante. C’est pourquoi le Dr Marc Raab, de l’hôpital universitaire de Heidelberg (D), a posé la question suivante dans son exposé : quelle est la bonne thérapie : adaptée au risque, axée sur la MRD ou encore “one size fits all” ?
Les comorbidités influencent le choix des thérapeutiques
Le traitement de plus en plus personnalisé du MM repose sur la compréhension de la manière dont les facteurs spécifiques au patient, à la maladie et au traitement influencent les taux de survie et la qualité de vie. L’âge a longtemps été considéré comme le paramètre principal et unique pour l’évaluation de la capacité de transplantation. Cependant, on sait aujourd’hui que l’âge seul (jusqu’à 75 ans environ) n’est pas une raison suffisante pour ne pas procéder à une greffe de cellules souches. Les comorbidités, la cytogénétique et la connaissance des toxicités spécifiques aux principes actifs sont également importantes pour évaluer la capacité du patient à suivre un traitement.
L’insuffisance rénale est une comorbidité importante et est associée négativement au pronostic. 30% des patients atteints de MM en sont affectés au cours de la maladie, 10% nécessitant même une hémodialyse. Le bortézomib est le traitement de choix pour ces patients.
Les toxicités ont également un impact sur le choix de l’agent ; la prudence est de mise, par exemple, lors de l’utilisation d’anthracyclines ou de carfilzomib chez les patients souffrant d’une maladie cardiaque ou d’agents provoquant une neuropathie chez les patients atteints de diabète sucré.
Ces dernières années, on en a appris davantage sur l’hétérogénéité génétique et clinique de la maladie du MM. Les directives actuelles reconnaissent la valeur d’une approche adaptée au risque, basée entre autres sur les analyses FISH. Les différents sous-types de MM répondent plus ou moins bien à différentes classes de médicaments. Les patients avec del(17p) et/ou t(4;14) et/ou +1q21 ont un pronostic plutôt défavorable. Les patients présentant un MM t(4;14) répondent bien au bortézomib et chez les patients présentant une délétion 17p, la chimiothérapie conventionnelle n’a qu’un effet limité.
Quel est le rôle de la “maladie résiduelle minimale” (MRD) ?
Le traitement de première ligne permet d’obtenir une rémission chez presque tous les patients. Un problème subsiste toutefois, celui de la “maladie résiduelle minimale” (MRD). Il existe différentes méthodes pour les diagnostiquer, qui ont toutes des avantages et des inconvénients. La cytométrie en flux est la mieux documentée et la plus rapide (le résultat est disponible le lendemain), le diagnostic génétique est plus long. La MRD a une grande importance pronostique, c’est pourquoi un objectif thérapeutique important est de faire en sorte que le plus grand nombre possible de patients soient exempts de MRD. Toutefois, de nombreuses questions restent en suspens concernant les MRD :
- Quelle technique utiliser pour la diagnostiquer (fiabilité, disponibilité) ?
- Quand le diagnostic doit-il être effectué ?
- Quelles sont les conséquences de quel statut MRD ?
L’intervenant a estimé que l’évaluation de la MRD n’était pas encore adaptée à la pratique clinique quotidienne, mais qu’elle devait être effectuée dans le cadre d’études cliniques. Celles-ci pourraient répondre à un certain nombre de questions, par exemple si, en raison de la MRD, le traitement d’entretien doit être adapté ou si la MRD pourrait également jouer un rôle dans l’autorisation de nouveaux médicaments.
Transplantation de cellules souches en cas de récidive de MM
Nicolaus Kröger, de l’hôpital universitaire de Hambourg-Eppendorf (Allemagne), a commencé par définir la transplantation de cellules souches de sauvetage (STX) : une STX autologue ou allogénique chez les patients en échec de traitement antérieur. Cela inclut les patients qui ont déjà subi une STX, mais aussi les patients qui n’ont jamais subi de STX. Les salvage-STX sont de plus en plus fréquents en Europe depuis 2006. Le conditionnement est presque toujours effectué avec du melphalan.
Des études rétrospectives montrent que, dans le cas de la STX autologue de sauvetage, les facteurs suivants influencent favorablement le résultat : une rémission plus longue après la première STX, un âge plus jeune du patient, un faible taux de bêta2-microglobuline et moins de traitements de sauvetage avant la STX de sauvetage.
Dans une étude prospective de Cook et al. les patients présentant une récidive de MM ont été traités soit par un STX de sauvetage autologue, soit par cyclophosphamide de manière conventionnelle [1]. La survie globale était identique dans les deux groupes, mais le temps jusqu’à la progression (PFS) était significativement plus long dans le groupe de patients avec STX (19 vs. 11 mois).
Les guidelines actuelles (2015) sur le Salvage-STX incluent notamment les principes suivants [2] :
- Chez les patients éligibles à une transplantation et présentant une récidive après un traitement primaire qui n’a pas consisté en une STX autologue, la STX autologue doit être considérée comme la norme dans le cadre d’un traitement de sauvetage.
- Une STX autologue de sauvetage est un traitement approprié pour les patients en récidive dont la rémission a duré plus de 18 mois après la première STX autologue.
- Une STX de sauvetage autologue peut être utilisée comme thérapie de pontage jusqu’à une STX allogénique.
Actuellement, la STX salvatrice autologue précoce en cas de récidive est étudiée dans le cadre de l’étude prospective GMMG. Les stratégies visant à aborder la MRD après la transplantation constituent un autre domaine de recherche. Il existe pour cela différentes stratégies, par exemple l’immunothérapie ou la vaccination. Il existe encore peu de données comparant la STX autologue à la STX de sauvetage allogénique. Elles sont plutôt en faveur de la STX autologue, mais il s’agit de données rétrospectives de patients sélectionnés. La conclusion du conférencier :
- Les STX autologues et allogéniques en tant que traitement de sauvetage chez les patients atteints d’une récidive de MM sont des options de traitement efficaces et sont de plus en plus utilisées.
- Une rémission prolongée après la première STX est un facteur pronostique positif pour la deuxième STX.
- Le traitement d’entretien après la STX doit faire l’objet d’une étude plus approfondie.
- Avec la STX allogénique, le risque de récidive du MM est plus faible, mais la mortalité indépendante de la récidive est plus élevée qu’avec la STX autologue.
- De nouveaux régimes thérapeutiques à toxicité atténuée sont actuellement à l’étude.
Patients âgés atteints de MM : déterminer la fragilité
Le MM est une maladie qui touche principalement les personnes âgées : Plus de 60% des diagnostics et environ 75% des décès dus au MM concernent des personnes de plus de 65 ans, comme l’a expliqué le PD Dr. med. Katja Christina Weisel, de l’hôpital universitaire de Tübingen (D), dans son exposé. Ces dernières années, le pronostic du MM s’est nettement amélioré grâce à de nouvelles options thérapeutiques. Dans une cohorte de patients diagnostiqués entre 2001 et 2005, la survie médiane était de 4,6 ans, et dans la cohorte diagnostiquée entre 2006 et 2010, elle était déjà de 6,1 ans. Les patients de plus de 70 ans bénéficient moins de ces progrès que les plus jeunes, mais plusieurs études ont montré que les nouvelles substances améliorent aussi significativement la survie des patients atteints de MM de plus de 75 ans. Les toxicités sont particulièrement importantes dans ce groupe de patients, car les toxicités hématologiques de grade 3-4 et les interruptions de traitement en raison d’effets secondaires réduisent le taux de survie. Chez les patients âgés, les thérapies devraient donc être bien tolérées.
Les patients âgés constituent toutefois un groupe très hétérogène : certains sont encore très en forme, d’autres sont fragiles (frail). Chez les personnes fragiles, la résistance aux facteurs de stress – comme un cancer et son traitement – est réduite. Mais comment évaluer la fragilité d’un patient ? Dans une étude récemment publiée, Palumbo et al. a présenté un outil d’évaluation capable de calculer la probabilité de toxicité et de survie chez les patients âgés chez qui un MM vient d’être diagnostiqué, en se basant sur des facteurs tels que l’âge, le statut fonctionnel et les comorbidités [3]. Depuis le 1er octobre 2015, cet outil de calcul est disponible en ligne sur www.myelomafrailtyscorecalcu lator.net.
Double régime chez les patients de plus de 75 ans
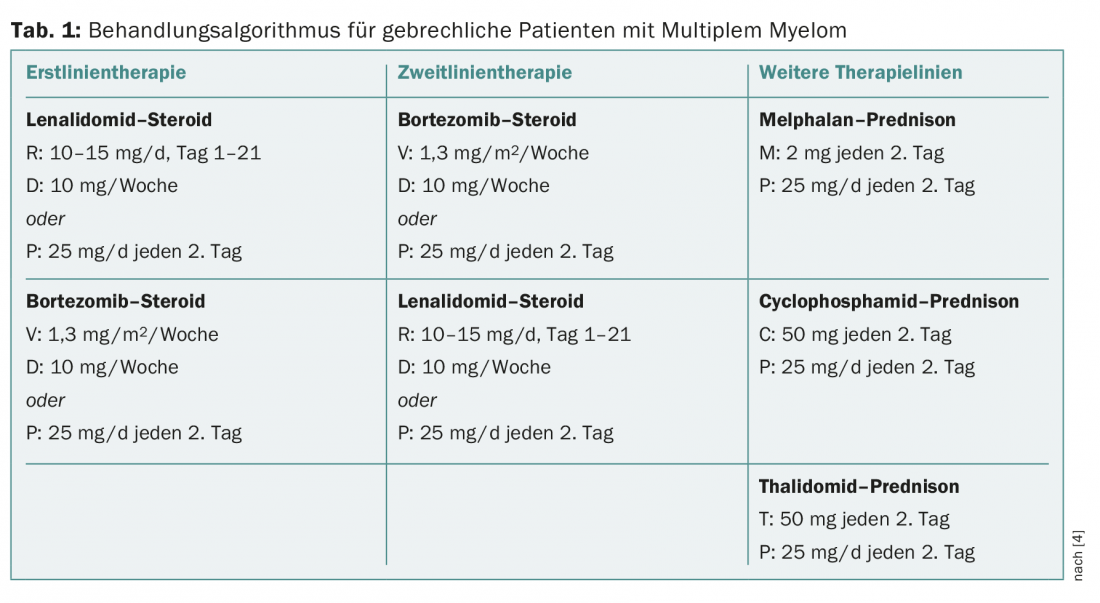
Le traitement standard d’un MM nouvellement diagnostiqué consiste généralement en une trithérapie. Cependant, chez les patients de plus de 75 ans, ces régimes entraînent un taux élevé d’effets secondaires. Des études récentes montrent qu’un double régime réduit le taux d’effets secondaires et améliore le taux de survie chez les patients de plus de 75 ans. Chez les patients fragiles, il est recommandé de n’administrer le bortézomib qu’une fois par semaine : Le taux de survie ne diminue pas, il y a significativement moins de polyneuropathies et les interruptions de traitement sont moins fréquentes. L’essai FIRST a montré qu’il était également possible de réduire de moitié la dose de dexaméthasone chez les patients de plus de 75 ans, sans que cela ne diminue les chances de survie. L’intervenante a formulé les recommandations suivantes pour le traitement des patients atteints de MM âgés de plus de 75 ans (tableau 1) :
- Dosez la lénalidomide plus prudemment ;
- Dose complète de bortézomib, mais ne l’administrer qu’une fois par semaine ;
- Réduire de moitié la dose de dexaméthasone.
Source : Réunion annuelle des sociétés allemande, autrichienne et suisse d’hématologie et d’oncologie médicale, du 9 au 13 octobre 2015, Bâle.
Littérature :
- Cook G, et al : High-dose chemotherapy plus autologous stem-cell transplantation as consolidation therapy in patients with relapsed multiple myeloma after previous autologous stem-cell transplantation (NCRI Myeloma X Relapse [Intensive trial]) : a randomised, open-label, phase 3 trial. Lancet Oncol 2014 Jul ; 15(8) : 874-885.
- Giralt S, et al : American Society of Blood and Marrow Transplantation, European Society of Blood and Marrow Transplantation, Blood and Marrow Transplant Clinical Trials Network, and International Myeloma Working Group Consensus Conference on Salvage Hematopoietic Cell Transplantation in Patients with Relapsed Multiple Myeloma. Biol Blood Marrow Transplant 2015 Sep 30. pii : S1083-8791(15)00641-2. doi : 10.1016/j.bbmt.2015.09.016.
- Palumbo A, et al : Geriatric assessment predicts survival and toxicities in elderly myeloma patients : an International Myeloma Working Group report. Blood 2015 ; 125(13) : 2068-2074.
- Larocca A, Palumbo A : Comment je traite les patients atteints de myélome fragile. Blood 2015 Aug 31. pii : blood-2015-05-612960.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(11-12) : 28-31