Le traitement conservateur du sein est la norme dans le traitement chirurgical du cancer du sein et devrait être proposé à tous les groupes d’âge. La maîtrise de l’oncoplastie est une base importante pour répondre à la fois aux exigences oncologiques et plastiques. Pour chaque patiente atteinte d’un cancer du sein, un concept thérapeutique interdisciplinaire est une condition préalable à un traitement individuel et optimal. La chirurgie radicale de l’axillaire peut être évitée dans la plupart des cas.
A la fin du 19e siècle, les médecins étaient convaincus qu’une chirurgie étendue était le meilleur traitement du cancer du sein. Ainsi, William Stewart Halsted a mis au point la mastectomie radicale avec ablation du sein et des muscles pectoraux, y compris les ganglions lymphatiques axillaires. Ce n’est qu’en 1977, lorsque les premiers résultats de l’étude NSABP-B-04 ont montré que la mastectomie dite modifiée (ablation sans muscle, MRM) combinée à la radiothérapie était équivalente à la mastectomie radicale en termes de survie sans maladie et de survie globale, que les mentalités ont commencé à changer. L’étude NSABP-B-06 qui a suivi a permis une grande percée dans la conservation du sein avec la radiothérapie après chirurgie conservatrice du sein, qui est équivalente à la mastectomie. Avec 70 à 75% des cancers du sein opérés par conservation du sein, ce traitement est aujourd’hui la norme. Depuis l’avènement de l’analyse génétique et de la recherche de mutations BRCA 1/2 qui en découle, il semble que la tendance soit de nouveau à la mastectomie, surtout aux États-Unis. En sénologie et en chirurgie mammaire, la question de la mastectomie prophylactique ou de la mastectomie en cas de mutations non BRCA est de plus en plus souvent posée.
La sécurité oncologique rencontre l’esthétique
Une thérapie conservatrice du sein pose des exigences techniques très différentes de celles de la mastectomie. La prise en compte de ce que l’on appelle l’oncoplastie permet de combiner une ablation oncologiquement sûre de la tumeur avec une conservation intéressante de la forme du sein. Dans le cas d’une thérapie conservatrice, il en résulte presque toujours une réduction du volume des seins. Cela doit se faire si possible sans formation de grosses bosses, de déformation du mamelon ou de cicatrices dans le décolleté. Le rapport sein/tumeur est aussi varié que les exigences de chaque patiente et nécessite de vastes connaissances oncoplastiques et beaucoup d’empathie de la part du chirurgien du sein.
La distance requise par rapport au bord de la résection a été constamment revue à la baisse ces dernières années, de sorte qu’aujourd’hui, seule une rangée de cellules est requise entre le bord de la résection marqué à l’encre (“encre = bord”) et la tumeur (“no ink on tumor”). Ce principe est indépendant du sous-type moléculaire ou de la présence d’un composant intraductal.
Toutefois, en présence d’un carcinome in situ ducal (DCIS) seul, une distance de 2 mm par rapport à la marge de résection est requise, mais il manque de grandes études prospectives. Si l’on fait la synthèse, il semble étrange qu’une chirurgie plus radicale soit toujours demandée pour le stade préliminaire.
Techniques chirurgicales et radiothérapie
Les techniques chirurgicales suivantes sont couramment utilisées en oncoplastie :
- Technique du Round-Block avec accès péri-aréolaire (ill. 1)
- B-Plastique
- Lambeau de déplacement dermoglandulaire
- Plastie en T inversée et chirurgie adaptée à la tumeur
- Plastie de réduction
- Technique Lejour modifiée
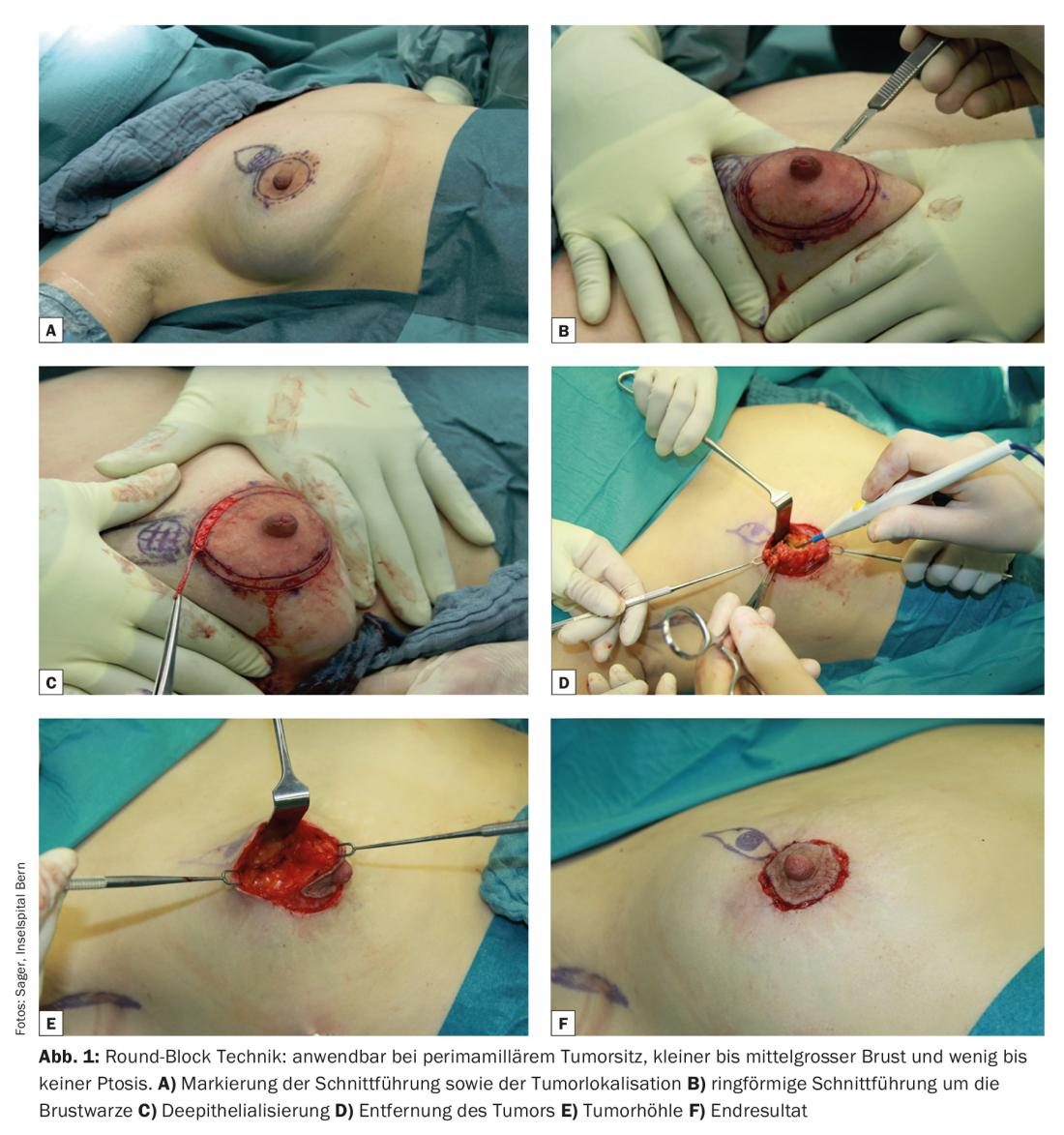
Toutes ces techniques et leurs combinaisons impliquent un recouvrement des défauts avec le propre tissu mammaire. Si l’on s’attend à une asymétrie plus importante, il est possible d’ajuster l’autre côté du sein. En cas d’hyperplasie mammaire notamment, cela représente non seulement un effet cosmétique, mais permet également un suivi simplifié grâce à la réduction du tissu glandulaire. Depuis quelques années, un tel rapprochement est également pris en charge par l’assurance maladie.
Le traitement conservateur du sein implique toujours une irradiation de la glande mammaire. Cela doit toujours être explicitement discuté avec la patiente. Les patientes plus âgées ont souvent du mal à accepter l’idée d’une radiothérapie de plusieurs semaines et souhaitent souvent une ablation pour cette raison. L’irradiation partielle du sein (curiethérapie HD) offre la possibilité de renoncer à des semaines d’irradiation. De ce fait, les patientes âgées décident de plus en plus souvent de conserver leurs seins. Les applicateurs, qui servent de guide pour les sources de rayonnement vers la tumeur, peuvent être utilisés en peropératoire après le traitement conservateur du sein. L’irradiation partielle du sein peut avoir lieu immédiatement après l’opération. Le séjour n’est ainsi prolongé que de quelques jours, et le cœur, les poumons et la peau sont en outre moins sollicités.
Un nouveau sein ou une mastectomie d’économie de peau et de mamelons avec reconstruction
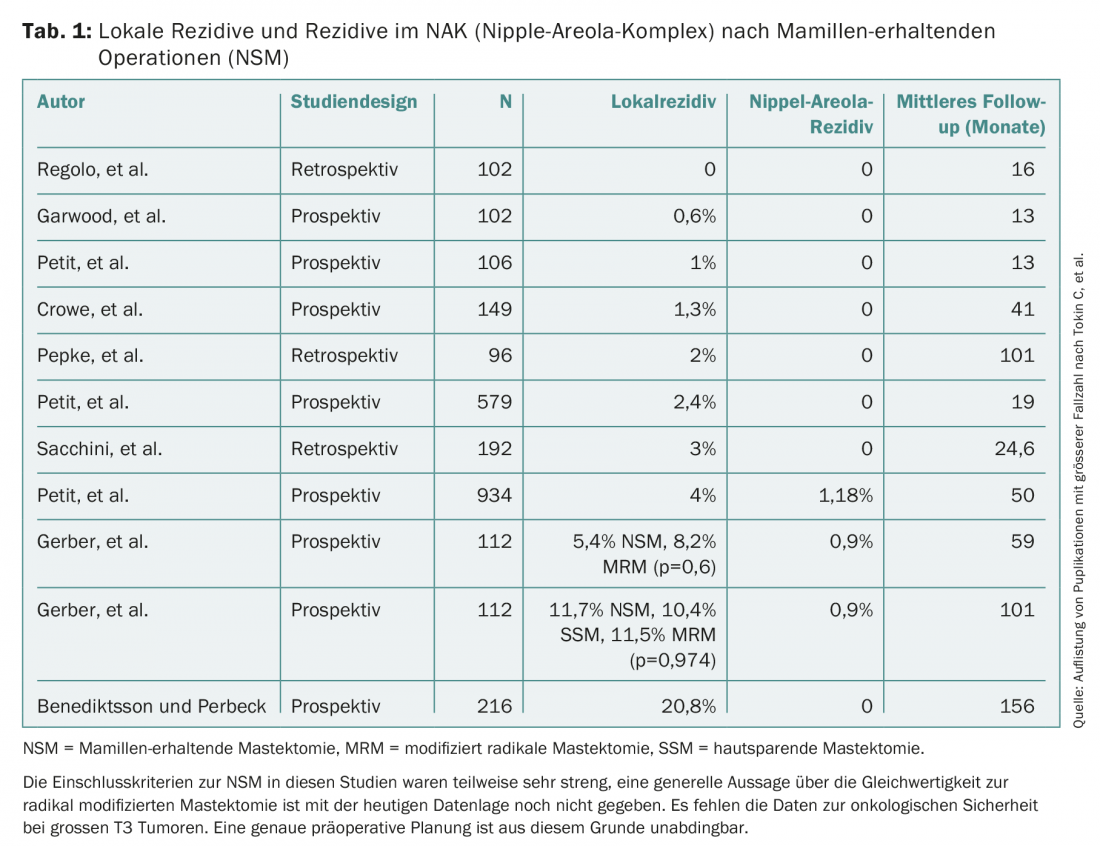
En cas de tumeur multicentrique de grande taille et de rapport sein/tumeur défavorable, la possibilité d’une mastectomie épargnant la peau ou le mamelon (SSM/NSM) est discutée avec la structure. Dans ce cas, le corps glandulaire complet est retiré et remplacé soit par un implant, soit par du tissu autologue. La sécurité oncologique dépend beaucoup de la résection la plus complète possible du tissu glandulaire. Cela impose certaines exigences au chirurgien. Si la résection est trop radicale, la circulation sanguine de la peau en pâtit et des nécroses peuvent se produire. Si trop de tissu glandulaire est laissé en place, le taux de récidive est trop élevé (tab. 1). Dans la plupart des cas, le mamelon devrait pouvoir être conservé. Il convient de tenir compte des points suivants : La tumeur doit être située à environ 2 cm du mamelon. Une coupe rapide rétromamelonnaire est réalisée en peropératoire pour confirmer l’absence de tumeur dans cette zone. Aucun tissu glandulaire ne doit subsister dans la zone rétromamelonnaire. Le volume est alors restauré soit de manière autologue par plastie de lambeau, soit de manière hétérologue avec un implant en silicone. Une matrice (Strattice® ou TiLoop®) est souvent utilisée pour le recouvrement caudal de l’implant. Cela sert à fixer le muscle en cas d’insertion rétromusculaire.
Pour de nombreuses femmes, la prise de décision est très difficile lorsqu’un cancer du sein vient d’être diagnostiqué. Un suivi étroit dans un cadre interdisciplinaire est indispensable pour que le traitement des patientes soit efficace et satisfaisant. Toutes les patientes atteintes d’une tumeur doivent être présentées et évaluées lors d’un conseil préopératoire interdisciplinaire. Il convient de noter qu’une reconstruction, quelle qu’elle soit, ne peut jamais remplacer le sein naturel. Il est donc d’autant plus important de préparer suffisamment les patientes à leur “nouveau sein”.
L’opération de l’aisselle est-elle encore justifiée ?
Grâce à l’amélioration du diagnostic préopératoire et aux échographes à très haute résolution, l’évaluation de l’axillaire est devenue très précise. La dissection axillaire en soi n’est plus pratiquée depuis longtemps. Aujourd’hui, l’excision ciblée de la sentine (ablation du ganglion sentinelle) est la norme en cas d’axillaire cliniquement négatif. Mais cette norme établie est également ébranlée. Les études INSEMA et SOUND examinent actuellement si la biopsie du ganglion sentinelle peut même être évitée en cas de ganglion axillaire cliniquement négatif. Les premiers résultats sont attendus dans 3 à 5 ans.
Il est d’ores et déjà prévu de renoncer à la dissection axillaire lorsque la tumeur est petite et qu’il n’existe qu’une micrométastase (étude IBCSG-23-01). La méta-analyse de Sanghani et al. de trois grandes études évaluant la dissection de la charge axiale par rapport à l’absence de dissection de la charge axiale n’a montré aucun avantage en termes de survie globale, de récidive axillaire ou de récidive locorégionale. Depuis la publication de l’étude Z0011, il est possible, dans certaines conditions, de renoncer à une dissection axillaire en présence d’une seule macrométastase dans le ganglion sentinelle et d’une axillaire préalablement cliniquement normale. Le lymphœdème tant redouté, qui réduit considérablement la qualité de vie des patientes, peut ainsi être évité.
Conclusion
La sécurité oncologique et l’esthétique sont très compatibles dans la chirurgie mammaire. Pour ce faire, le chirurgien du sein doit maîtriser une large palette d’interventions oncoplastiques et reconstructives. La planification de ces interventions mammaires doit se faire de manière interdisciplinaire au sein d’un comité préopératoire. C’est la seule façon d’obtenir une qualité élevée.
Messages Take-Home
- Le traitement conservateur du sein est la norme dans le traitement chirurgical du cancer du sein et devrait être proposé à tous les groupes d’âge.
- La maîtrise de l’oncoplastie est une base importante pour répondre à la fois aux exigences oncologiques et plastiques.
- Pour chaque patiente atteinte d’un cancer du sein, un concept thérapeutique interdisciplinaire est une condition préalable à un traitement individuel et optimal.
- Une chirurgie axillaire radicale peut être évitée dans la plupart des cas.
Littérature complémentaire :
- Halsted WS : A clinical and histological study of certain adenocarcinomata of the breast : and a brief consideration of the supraclavicular operation and of the results of operations for cancer of the breast from 1889 to 1898 at the Johns Hopkins Hospital. Ann Surg 1898 ; 28 : 557-576.
- Fisher B, et al : Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med 2002 ; 347 : 1233-1241.
- Veronesi U, et al : Suivi à vingt ans d’une étude randomisée comparant la chirurgie conservatrice du sein à la mastectomie radicale pour le cancer du sein précoce. N Engl J Med 2002 ; 347 : 1227-1232.
- Hughes KS, et al : Lumpectomie plus tamoxifène avec ou sans irradiation chez les femmes de 70 ans ou plus atteintes d’un cancer du sein précoce. J Clin Oncol 2010 ; 28 : 15s.
- Berry MG, et al : Oncoplastic breast surgery : A review and systematic approach. J Plast Reconstr Aesthet Surg 2010 ; 63(8) : 1233-1243.
- Krag DN, et al : Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer : overall survival findings from the NSABP B-32 randomized phase 3 trial. Lancet Oncol 2010 ; 11 : 927-933.
- Veronesi U, et al : Sentinel lymph node biopsy in breast cancer : ten-year results of a randomized controlled study. Ann Surg 2010 ; 251 : 595-600.
- Giuliano AE, et al : Dissection axillaire vs pas de dissection axillaire chez les femmes atteintes d’un cancer du sein invasif et de métastases du ganglion sentinelle : un essai clinique randomisé. JAMA 2011 ; 305 : 569-75.
- Canavese G, et al : A risk score model predictive of the presence of additional disease in the axilla in early-breast cancer patients with one or two metastatic sentinel lymph nodes. Eur J Surg Oncol 2014 ; pii : S0748-7983(14)00350.
- Cunnick GH, Mokbel K. : Mastectomie avec épargne de la peau. Am J Surg 2004 ; 188(1) : 78-84.
- Cense HA, et al : Nipple sparing mastectomy in breast cancer : a viable option ? Eur J Surg Oncol 2001 ; 27 : 521-526.
- Clemens MW, Kronowitz SJ. : Matrice dermique acellulaire dans la reconstruction mammaire par expandeur tissulaire irradié/implant : examen fondé sur des preuves. Plast Reconstr Surg 2012 Nov ; 130(5 Suppl 2) : 27S-34S.
- Berry MG. : Oncoplastic breast surgery : A review and systematic approach. J Plast Reconstr Aesthet Surg 2010 ; 63(8) : 1233-43.
- Rezai M,Veronesi U. : Principes oncoplastiques en chirurgie mammaire. Breast Care 2007 ; 2 : 277-278.
- Sanghani M, Balk EM, Cady B : Impact de la dissection du ganglion lymphatique axillaire sur le résultat du cancer du sein chez les patientes cliniquement négatives pour le ganglion : une revue systématique et une méta-analyse. Cancer 2009 ; 115(8) : 1613-1620.
- Tokin C, et al : Oncologic safety of skin-sparing and nipple-sparing mastectomy : a discussion and review of the literature. Int J Surg Oncol 2012 ; 2012 : 921821.
InFo ONKOLOGIE & HÄMATOLOGIE 2017 ; 5(4) : 22-25











