L’autorisation de mise sur le marché de certaines immunothérapies contre la SEP en Suisse diffère parfois considérablement de celle des pays voisins. C’est pourquoi un groupe de neurologues, avec la participation de la Société suisse de la sclérose en plaques ainsi que de la SNG, a établi des recommandations dans le sens d’un consensus thérapeutique.
Selon la Société internationale de la sclérose en plaques, la sclérose en plaques touche environ 10 000 patients en Suisse [1], mais on peut supposer, par analogie avec les données d’autres pays, que le nombre de personnes atteintes est également plus élevé en Suisse [2]. L’incidence de la maladie est en augmentation [3]. En tant que maladie inflammatoire chronique démyélinisante du SNC, la SEP évolue majoritairement par poussées [4], mais les nouvelles options thérapeutiques ont récemment attiré l’attention sur les 10 à 15% d’évolutions progressives primaires (“primary progressive MS”, PPMS). Aucun traitement à visée curative n’est connu à ce jour. Le paysage des thérapies de modification de l’évolution s’est toutefois considérablement élargi ces dernières années, de sorte qu’il existe désormais une douzaine de thérapies de modification de l’évolution, notamment pour réduire le taux de poussées ou la progression du handicap et l’activité détectable par IRM. En raison de la diversité des mécanismes d’action, des modes d’application et des profils bénéfice/risque, une thérapie de plus en plus individualisée est possible. Il est ainsi possible de réagir de manière ciblée aux situations de vie actuelles et aux objectifs visés, comme la capacité de marche, les aspects professionnels ou une grossesse [5].
Cette complexité croissante nécessite des directives dans lesquelles les indications, les avantages potentiels ainsi que les aspects de sécurité et les profils d’effets secondaires sont discutés. La plupart de ces directives s’appliquent de manière générale. Il s’agit par exemple de la recommandation de commencer une immunothérapie le plus rapidement possible après le diagnostic [5].
Cependant, plusieurs aspects, tels que des évaluations différentes du rapport bénéfice/risque, des procédures d’autorisation différentes ou des priorités politiques, juridiques et spécifiques à chaque pays, conduisent souvent à des autorisations divergentes de certains traitements dans des pays parfois voisins [6].
Ainsi, pour les immunothérapies de la SEP en Suisse, il existe parfois des différences notables par rapport à l’espace européen (European Medicines Agency, EMA) en ce qui concerne l’autorisation de mise sur le marché (p. ex. traitement de première ou de deuxième ligne, groupes de patients) et les conditions de sécurité.
En outre, en Suisse, pour qu’un médicament soit inscrit sur la liste des spécialités (LS), l’Office fédéral de la santé publique (OFSP) doit procéder à une évaluation du rapport coût-efficacité, institutionnellement distincte de l’autorisation de mise sur le marché. La LS énumère les préparations remboursées par l’assurance obligatoire des soins ainsi que les limitations potentielles.
Comparées à celles des pays voisins, ces conditions particulières entraînent des différences considérables dans l’utilisation de certaines préparations. Ces différentes autorisations et limitations donnent lieu à des approches spécifiques en Suisse, ce qui nécessite des considérations propres à chaque pays.
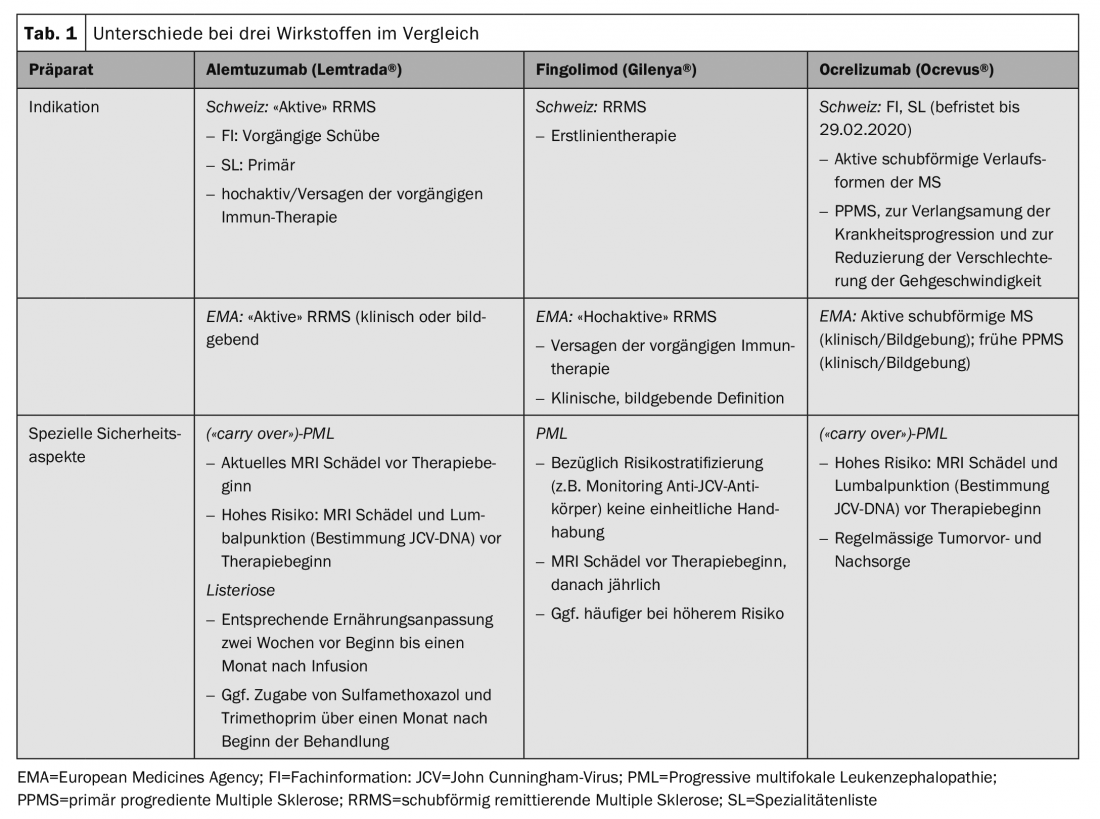
Ces aspects spécifiques à la Suisse, ainsi que des recommandations pratiques, ont été résumés par un groupe de neurologues spécialisés dans le traitement de la SEP et ont fait l’objet d’un consensus avec le comité scientifique de la Société suisse de la sclérose en plaques et la Société suisse de neurologie (SSN) [7]. Des différences pratiques existent notamment pour les substances alemtuzumab (Lemtrada®), fingolimod (Gilenya®) et ocrelizumab (Ocrevus®), ainsi que pour la transplantation autologue de cellules souches hématopoïétiques (aHSCT) (tableau 1).
Indication
L’utilisation de certaines préparations requiert un certain degré d’activité de la maladie, la notion de SEP “active”, voire “très active”, n’étant généralement pas clairement définie et faisant l’objet d’interprétations différentes dans les textes d’autorisation de mise sur le marché. L’évaluation du médecin traitant joue donc un rôle décisif, ce qui a des implications pour une éventuelle demande de garantie de paiement.
Selon l’information professionnelle (IP) en Suisse, l’alemtuzumab peut être utilisé en cas de SEP rémittente active (RRMS). Celle-ci est définie cliniquement en termes d’au moins deux poussées au cours des deux années précédant le début du traitement (avec au moins une poussée au cours de l’année immédiatement précédente). La LS restreint encore l’indication et exige soit l’échec d’un traitement préalable, soit, en l’absence de traitement préalable, une SEP “primaire hautement active”, là encore sans définition claire du terme. Selon la LS, une garantie de prise en charge des coûts est exigée pour les patients non prétraités présentant une forme évolutive hautement active, ce qui – en raison de l’absence de définition – nécessite une évaluation de la situation individuelle, qui est donc laissée à l’appréciation du médecin traitant. Il nous semble important de souligner que les aspects formels ne doivent pas entraîner de retard important, en particulier pour ce groupe de patients pour lesquels la mise en place d’un traitement efficace en temps utile est particulièrement pertinente.
Les limitations de l’IF ou de la SL correspondent en partie aux critères d’inclusion des études pertinentes pour l’autorisation [8,9]. Il est toutefois en corrélation avec la pratique clinique courante que le traitement préalable ne se limite pas à l’acétate de glatiramère ou à l’interféron-β, comme dans le cadre de l’étude pivot, mais devrait également s’appliquer aux autres immunothérapies autorisées.
Contrairement à cette indication relativement stricte en Suisse, il existe une autorisation plus générale dans l’espace EMA, où les résultats cliniques et d’imagerie peuvent être utilisés pour confirmer l’activité de la maladie. Cela pose à son tour des exigences plus élevées en termes d’évaluation individuelle des bénéfices et des risques par le médecin prescripteur.
Il existe également une différence plus importante en termes d’autorisation de mise sur le marché pour le fingolimod. Il est autorisé en Suisse en tant que traitement de première ligne, mais seulement en deuxième ligne dans l’espace EMA. Cela peut s’expliquer par une interprétation différente du rapport bénéfice/risque, et surtout par une interprétation différente de la population étudiée dans les études d’enregistrement. Dans les études FREEDOMS, 57% des patients étaient naïfs de traitement, contre 44% dans l’étude TRANSFORMS [10,11]. Les aspects divergents de cette préparation concernent également la sécurité. Une pause thérapeutique n’est prescrite en Suisse que si le taux de lymphocytes est inférieur à 100/μl, alors que la limite est fixée à 200/μl dans l’espace EMA.
Contrairement à l’autorisation européenne, qui se base sur la population étudiée dans les études d’homologation, l’indication de l’ocrelizumab en Suisse est formulée de manière nettement plus générale, tant par Swissmedic que dans la LS. Une forme active et rémittente est requise, mais elle n’est pas précisée ou limitée. Pour le traitement de la SEP primaire progressive (PPMS), le traitement a été inclus sans restriction dans la LS, ce qui est compréhensible en raison de l’absence d’alternatives immunothérapeutiques. Dans ce cas, l’objectif d’un traitement par Ocrevus® est de ralentir la progression de la maladie, non seulement en ce qui concerne la marche, mais aussi le maintien d’autres fonctions résiduelles importantes, comme par exemple la fonction des bras/mains ou la motricité fine, dans le sens d’une évaluation individuelle du rapport bénéfice/risque. Dans cette situation en particulier, il est essentiel d’enregistrer de manière détaillée et aussi quantifiée que possible la progression de la maladie avant et sous traitement (“Expanded Disability Status Scale”, EDSS ; “Multiple Sclerosis Functional Composite”, MSFC).
Ce sont surtout les jeunes patients dont l’évolution de la maladie est plus courte et dont l’activité de la maladie est détectable par imagerie (lésions prenant le contraste) qui semblent bénéficier du traitement. Inversement, il n’est pas automatique que les patients sans activité de la maladie à l’imagerie ne soient pas éligibles pour le traitement.
Il existe également des différences de traitement pour la transplantation autologue de cellules souches hématopoïétiques (aHSCT), qui est autorisée de manière isolée dans l’espace EMA ou qui peut être utilisée selon l’avis des experts et qui a été autorisée en Suisse le 01.07.2018 par l’OFSP sous des conditions strictes de remboursement par l’AOS. Les patients traités doivent par exemple être enregistrés dans un registre. En raison du large éventail d’alternatives thérapeutiques pour les formes rémittentes, des effets secondaires potentiellement graves de ce traitement invasif et de l’absence d’études contrôlées et randomisées, cette thérapie reste controversée. Actuellement, il est recommandé de ne l’utiliser que dans des cas soigneusement sélectionnés et dans des centres universitaires hautement spécialisés. Les critères pour lesquels un traitement approprié pourrait être discuté sont, entre autres, un degré d’invalidité aussi faible à modéré que possible (jusqu’à EDSS 6,5), un âge plus jeune des patients (<50 ans), une durée plus courte de la maladie (<10 ans) et l’échec d’une immunothérapie hautement active préalable.
Aspects spécifiques de la sécurité
Les aspects généraux de la sécurité, tels que les contrôles en laboratoire, ne font pas l’objet de cet article ni de la recommandation de consensus et figurent dans les informations professionnelles correspondantes.
En principe, les traitements doivent être administrés par des neurologues expérimentés dans le domaine de la SEP, dans des centres qui assurent un suivi et une évaluation sûrs des patients et qui peuvent détecter et traiter les effets secondaires à un stade précoce.
Dans ce contexte, il convient de mentionner tout particulièrement les examens d’imagerie et les contrôles de l’évolution. L’imagerie par résonance magnétique (IRM) occupe une place de plus en plus importante non seulement dans le domaine du diagnostic, mais aussi dans le cadre des examens de sécurité. Indépendamment de l’immunothérapie établie, les contrôles de l’évolution devraient pour cette raison être effectués avec des protocoles standardisés et évalués par des neuroradiologues ayant l’expérience nécessaire [12].
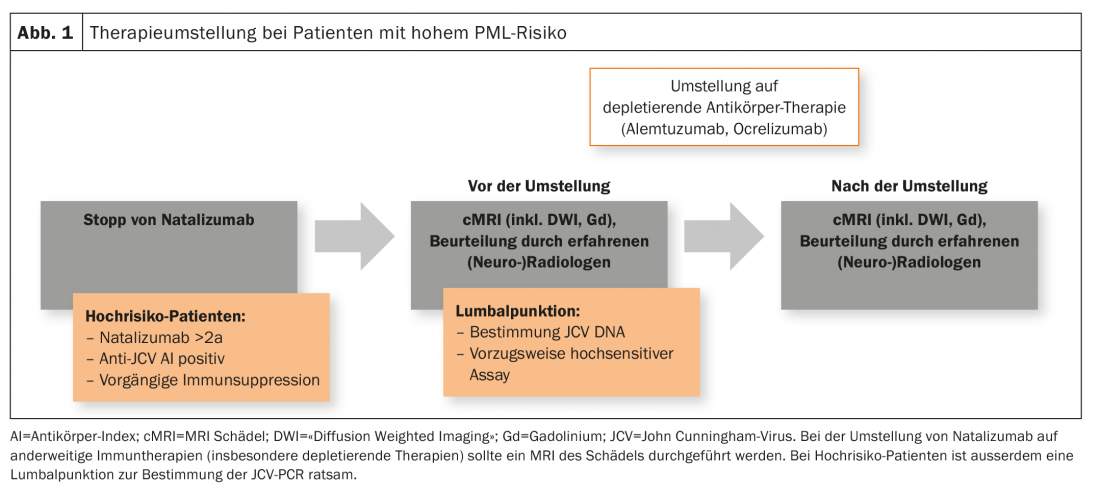
Des cas de leuco-encéphalopathies multifocales progressives (LEMP), une infection virale opportuniste du SNC, ont été décrits sous plusieurs immunothérapies. Ainsi, parmi les substances dont il est question ici, plusieurs cas ont été décrits sous fingolimod, ce qui correspond à un risque général de 1/15’000 patients, ainsi que plusieurs cas de “carry over” sous ocrelizumab et alemtuzumab après un traitement préalable par natalizumab ou fingolimod [13].
Les patients à haut risque (durée du traitement par natalizumab ≥2 ans, anticorps anti-JCV positifs, immunosuppression préalable) doivent bénéficier d’une IRM cérébrale récente dans le cadre d’un changement de traitement. En outre, une ponction lombaire avec détermination de l’ADN du JCV (de préférence dans un test hautement sensible) est également conseillée. Cela vaut en particulier pour le passage du natalizumab à des traitements déplétifs comme l’alemtuzumab ou l’ocrelizumab, mais est également effectué dans certains centres lors du passage du ou au fingolimod (fig. 1). Il n’y a toutefois pas de consensus à ce sujet en Suisse.
Rapport d’évaluation publique suisse
Dans le cadre de la révision de la loi sur les produits thérapeutiques (LPTh, art. 67), Swissmedic publie des informations supplémentaires d’intérêt général dans le domaine des produits thérapeutiques. Par exemple, pour les médicaments à usage humain, un rapport d’évaluation publique (“Swiss Public Assessment Report”, SwissPAR) est établi après une décision d’autorisation de mise sur le marché, qu’elle soit positive ou négative, afin d’améliorer la transparence de la procédure d’autorisation. Ceci est d’autant plus important que d’autres pays (par exemple les pays en développement) s’inspirent de l’autorisation suisse [6,7].
Littérature :
- MS International Federation : Atlas of MS. www.msif.org/about-us/who-we-are-and-what-we-do/advocacy/atlas, dernier appel 28.02.19.
- Dippel FW, et al : Les données de l’assurance maladie confirment la prévalence élevée de la sclérose en plaques. Akt Neurol 2015 ; 42(4) : 191-196.
- Koch-Henriksen N, et al : Incidence de la SEP a augmenté de manière significative au cours des six dernières décennies au Danemark, en particulier avec une apparition tardive et chez les femmes. Neurology 2018 ; 90(22) : 1954-1963.
- Noseworthy JH, et al : Sclérose en plaques. N Engl J Med 2000 ; 343(13) : 938-952.
- Montalban X, et al : ECTRIMS/EAN Guideline on the pharmacological treatment of people with multiple sclerosis. Mul Scler 2018 ; 24(2) : 96-120.
- Dalla Torre Di Sanguinetto S, et al. : A Comparative Review of Marketing Authorization Decisions in Switzerland, the EU, and the USA. Ther Innov Regul Sci 2019 ; 53(1) : 86-94.
- Achtnichts L, et al : Specific aspects of Immunotherapy for Multiple Sclerosis in Switzerland : a structured Commentary. Clinical and Translational Neuroscience [in press].
- Cohen JA, et al : Alemtuzumab vs. interféron bêta 1a comme traitement de première ligne pour les patients atteints de sclérose en plaques en rechute : un essai randomisé contrôlé de phase 3. Lancet 2012 ; 380(9856) : 1819-1828.
- Coles AJ, et al : Alemtuzumab pour les patients atteints de sclérose en plaques en rechute après traitement modificateur de la maladie : un essai randomisé contrôlé de phase 3. Lancet 2012 ; 380(9856) : 1829-1839.
- Kappos L, et al : Un essai contrôlé par placebo du fingolimod oral dans la sclérose en plaques en phase de rémission. N Enl J Med 2010 ; 362 : 387-401.
- Cohen JA, et al : fingolimod oral ou interféron intramusculaire pour la sclérose en plaques en rechute. N Enl J Med 2010 ; 362(5) : 402-415.
- Traboulsee A, et al : Recommandations révisées du groupe de travail du Consortium des centres de la SEP pour un protocole d’IRM standardisé et des directives cliniques pour le diagnostic et le suivi de la sclérose en plaques. Am J Neuroradiol 2016 ; 37(3) : 394-401.
- Berger JR, et al : Leucoencéphalopathie multifocale progressive après traitement par fingolimod. Neurology 2018 ; 90(20) : 1815-1821.
InFo NEUROLOGIE & PSYCHIATRIE 2019 ; 17(2) : 28-30











