L’approvazione di alcune immunoterapie per la SM in Svizzera differisce in parte considerevolmente da quella dei Paesi vicini. Un gruppo di neurologi, con la partecipazione dell’Associazione Svizzera di Sclerosi Multipla e dell’SNS, ha quindi elaborato delle raccomandazioni nel senso di un consenso terapeutico.
Secondo l’Associazione Internazionale Sclerosi Multipla, la sclerosi multipla colpisce circa 10.000 pazienti in Svizzera [1], anche se si può ipotizzare, analogamente ai dati di altri Paesi, che anche in Svizzera ci sia un numero maggiore di persone colpite [2]. L’incidenza della malattia è in aumento [3]. Essendo una malattia demielinizzante infiammatoria cronica del SNC, la maggior parte della SM è recidivante [4]. Tuttavia, grazie alle nuove opzioni terapeutiche, il 10-15% della SM primariamente progressiva (SMPP) è diventato di recente oggetto di interesse. Ad oggi, non è nota alcuna terapia con un approccio curativo. Tuttavia, il panorama delle terapie modificanti il decorso si è notevolmente ampliato negli ultimi anni, tanto che oggi sono disponibili circa una dozzina di terapie modificanti il decorso per ridurre il tasso di ricaduta o la progressione della disabilità, tra le altre cose, e l’attività che può essere rilevata dalla risonanza magnetica. A causa dei diversi meccanismi d’azione, delle modalità di applicazione e dei profili beneficio-rischio, sta diventando possibile una terapia sempre più personalizzata. In questo modo, è possibile reagire in modo specifico alle situazioni di vita attuali e agli obiettivi desiderati, come la capacità di camminare, gli aspetti professionali o la gravidanza [5].
Questa crescente complessità richiede linee guida in cui vengano discussi l’indicazione, il potenziale beneficio, nonché gli aspetti di sicurezza e i profili di effetti collaterali. La maggior parte di queste linee guida sono generalmente valide. Questo include, ad esempio, la raccomandazione di iniziare l’immunoterapia il prima possibile dopo la diagnosi [5].
Tuttavia, diversi aspetti, come le diverse valutazioni del rapporto beneficio/rischio, le diverse procedure di approvazione o le diverse priorità politiche, legali e specifiche del Paese, spesso portano ad approvazioni divergenti di singole terapie in Paesi in parte confinanti [6].
Ad esempio, ci sono differenze talvolta significative in termini di approvazione (ad esempio, prima o seconda linea di terapia, gruppi di pazienti) e requisiti di sicurezza per le immunoterapie per la SM in Svizzera rispetto all’area europea (Agenzia Europea dei Medicinali, EMA).
Inoltre, in Svizzera, per l’inclusione di un farmaco nell’elenco delle specialità (SL), istituzionalmente separato dall’autorizzazione all’immissione in commercio, è necessaria una valutazione costi-benefici da parte dell’Ufficio federale della sanità pubblica (UFSP). La SL elenca i preparati che vengono rimborsati dall’assicurazione sanitaria obbligatoria e le potenziali limitazioni.
Rispetto ai Paesi limitrofi, queste condizioni particolari comportano notevoli differenze nell’uso di alcuni preparati. Gli approcci specifici in Svizzera si basano su queste diverse approvazioni e limitazioni, per cui sono necessarie considerazioni specifiche per ogni Paese.
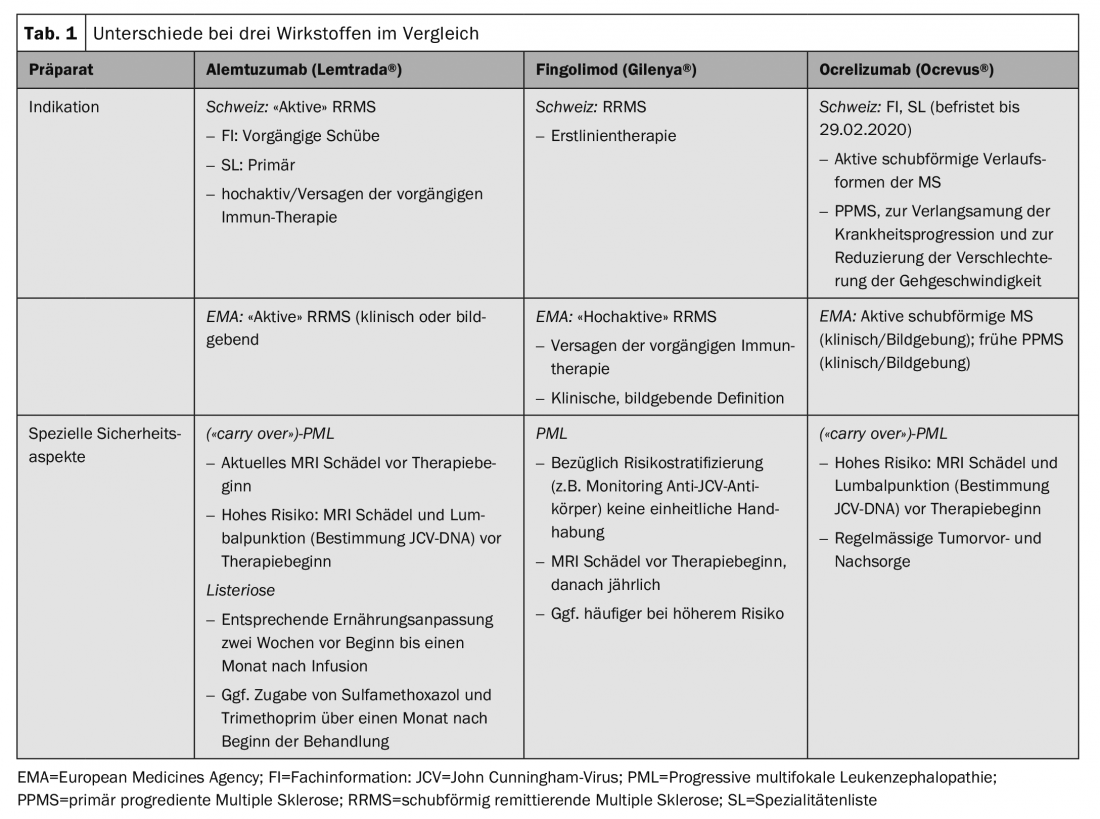
Questi aspetti specifici in Svizzera, insieme a raccomandazioni pratiche per l’azione, sono stati riassunti da un gruppo di neurologi con particolare attenzione alla terapia della SM e coordinati nel senso di un consenso con il comitato consultivo scientifico della Società Svizzera di Sclerosi Multipla e della Società Neurologica Svizzera (SNS) [7]. Le differenze pratiche esistono in particolare per le sostanze alemtuzumab (Lemtrada®), fingolimod (Gilenya®) e ocrelizumab (Ocrevus®), nonché per il trapianto autologo di cellule staminali ematopoietiche (aHSCT) (Tab. 1).
Indicazione
L’uso di alcuni preparati richiede un certo grado di attività della malattia, per cui il termine SM “attiva” o addirittura “altamente attiva” non è generalmente definito in modo chiaro e viene interpretato in modo diverso nei testi di autorizzazione all’immissione in commercio. Pertanto, la valutazione del medico curante gioca un ruolo decisivo, che a sua volta ha implicazioni per quanto riguarda una possibile richiesta di garanzia dei costi.
Secondo l’RCP svizzero, alemtuzumab può essere utilizzato nella SM recidivante-remittente (RRMS) attiva. Questo è definito clinicamente in termini di almeno due ricadute nei due anni precedenti l’inizio della terapia (con almeno una ricaduta nell’anno immediatamente precedente). La SL limita ulteriormente l’indicazione e richiede un fallimento della terapia precedente o, in assenza di terapia precedente, una SM “primaria altamente attiva”, ancora una volta senza una chiara definizione dei termini. Secondo la SL, è necessaria un’approvazione dei costi per i pazienti non pretrattati con una forma di progressione altamente attiva, che – a causa della mancanza di una definizione – richiede una valutazione della situazione individuale, che è quindi a discrezione del medico curante. Soprattutto per questo gruppo di pazienti, per i quali l’avvio tempestivo di una terapia efficace è di particolare rilevanza, ci sembra importante sottolineare che gli aspetti formali non devono comportare un ritardo significativo.
Le limitazioni dell’IF e della SL corrispondono in parte ai criteri di inclusione degli studi rilevanti per l’approvazione [8,9]. Tuttavia, è in linea con l’attuale pratica clinica che la pre-terapia non si limita al glatiramer acetato o all’interferone-β – come nel caso dello studio pivotal – ma deve essere applicata anche alle altre immunoterapie approvate.
A differenza di questa indicazione relativamente rigida in Svizzera, nell’area EMA esiste un’autorizzazione più generale, in base alla quale si possono utilizzare sia i risultati clinici che quelli di imaging per confermare l’attività della malattia. Questo, a sua volta, pone maggiori requisiti alla valutazione individuale del rischio-beneficio da parte del medico prescrittore.
Una maggiore differenza in termini di approvazione esiste anche per fingolimod. È approvato come trattamento di prima linea in Svizzera, ma solo come trattamento di seconda linea nella regione EMA. Questo può essere spiegato da una diversa interpretazione del rapporto beneficio/rischio, o soprattutto da una diversa interpretazione della popolazione degli studi di approvazione. Negli studi FREEDOMS, il 57% dei pazienti era naïve al trattamento, nello studio TRANSFORMS il 44% [10,11]. Con questa preparazione si riscontrano anche aspetti divergenti per quanto riguarda la sicurezza. In Svizzera, l’interruzione della terapia viene prescritta solo quando il valore dei linfociti è inferiore a 100/μl, mentre il limite nell’area EMA è di 200/μl.
A differenza dell’approvazione europea, che si basa sulla popolazione degli studi di registrazione, l’indicazione di ocrelizumab in Svizzera è formulata in modo molto più generale sia da Swissmedic che nella SL. È richiesta una forma attiva e recidivante di progressione, ma questo non viene ulteriormente spiegato o limitato. Per il trattamento della SM primariamente progressiva (SMPP), la terapia è stata inclusa nella SL senza restrizioni, il che è comprensibile per la mancanza di alternative immunoterapiche. In questo caso, l’obiettivo della terapia con Ocrevus® è quello di rallentare la progressione della malattia, che non deve riferirsi solo alla capacità di camminare, ma anche alla conservazione di altre funzioni residue rilevanti, come la funzione delle braccia/mani o la motricità fine, nel senso di una valutazione individuale del rischio-beneficio. In questa situazione in particolare, è essenziale una valutazione dettagliata e, se possibile, quantificata della progressione della malattia prima e durante la terapia (“Expanded Disability Status Scale”, EDSS; “Multiple Sclerosis Functional Composite”, MSFC).
Soprattutto i pazienti più giovani, con un decorso più breve della malattia e un’attività patologica rilevabile con l’imaging (lesioni che assorbono il contrasto) sembrano trarre beneficio dalla terapia. Al contrario, però, non è automaticamente vero che i pazienti che non presentano attività di malattia non sono idonei alla terapia.
Esistono anche diversi approcci per il trapianto autologo di cellule staminali ematopoietiche (aHSCT), che è stato approvato in alcuni casi nella regione EMA o può essere utilizzato secondo il parere di esperti ed è stato approvato in Svizzera dall’UFSP il 01.07.2018 per il rimborso da parte dell’OKP a condizioni rigorose. I pazienti trattati, ad esempio, devono essere registrati in un registro. A causa delle ampie alternative terapeutiche per le forme recidivanti della malattia, degli effetti collaterali potenzialmente gravi di questo trattamento invasivo e della mancanza di studi controllati e randomizzati, la terapia continua ad essere controversa. Attualmente, si raccomanda di utilizzarli solo in casi accuratamente selezionati e presso centri accademici altamente specializzati. I criteri per i quali potrebbe essere discussa una terapia corrispondente includono il grado di disabilità da minimo a moderato (fino a EDSS 6,5), un’età del paziente più giovane (<50 anni), una durata della malattia più breve (<10 anni) e il fallimento di una precedente immunoterapia altamente attiva.
Aspetti speciali di sicurezza
Gli aspetti generali della sicurezza, come i controlli di laboratorio, non sono oggetto di questo articolo e della raccomandazione di consenso e possono essere consultati nelle rispettive informazioni tecniche.
In linea di principio, le terapie dovrebbero essere eseguite da neurologi esperti nella SM, in centri che garantiscano un monitoraggio e una valutazione sicuri dei pazienti e che siano in grado di rilevare e trattare gli effetti collaterali in una fase precoce.
In questo contesto, occorre menzionare in modo particolare gli esami di diagnostica per immagini e i controlli dei progressi. La tomografia a risonanza magnetica sta diventando sempre più importante non solo nel campo della diagnostica, ma anche nel contesto delle indagini sulla sicurezza. Per questo motivo, indipendentemente dall’immunoterapia stabilita, il follow-up deve utilizzare protocolli standardizzati ed essere valutato da neuroradiologi con esperienza adeguata [12].
Sono stati descritti casi di leucoencefalopatia multifocale progressiva (PML), un’infezione virale opportunistica del SNC, con diversi agenti immunoterapeutici. Pertanto, delle sostanze qui discusse, sono stati descritti diversi casi con fingolimod, corrispondenti a un rischio generale di 1/15.000 pazienti, nonché diversi casi di “carry over” con ocrelizumab e alemtuzumab dopo una precedente terapia con natalizumab o fingolimod [13].
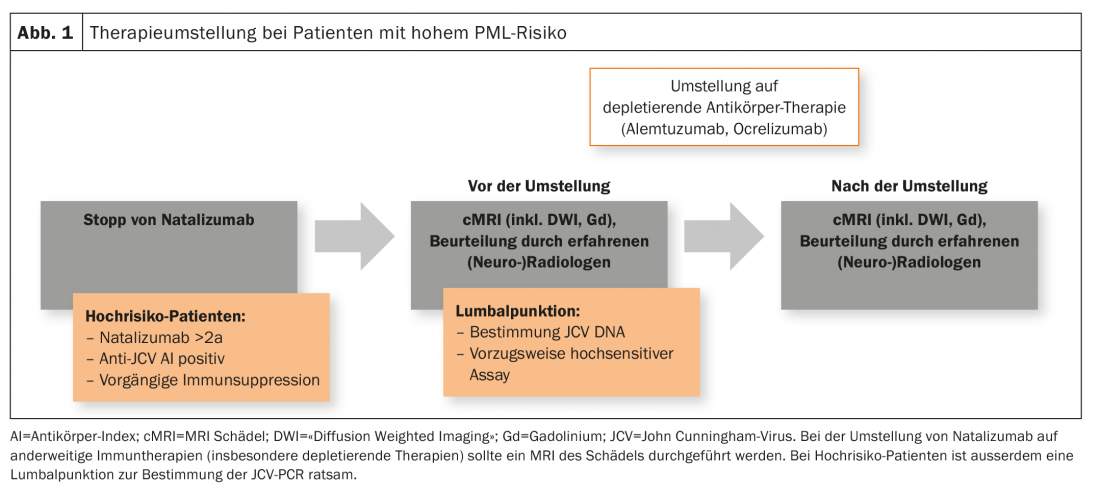
I pazienti ad alto rischio (durata della terapia con natalizumab ≥2 anni, anticorpo anti-JCV positivo, precedente immunosoppressione) devono ricevere una risonanza magnetica cranica attuale come parte di un cambiamento di terapia. Inoltre, è consigliabile una puntura lombare con determinazione del DNA di JCV (preferibilmente con un test altamente sensibile). Questo vale in particolare per il passaggio da natalizumab a terapie depletive come alemtuzumab o ocrelizumab, ma viene effettuato anche in alcuni centri quando si passa da o a fingolimod (Fig. 1). Tuttavia, in Svizzera non c’è consenso su questo punto.
Rapporto di valutazione pubblico svizzero
Nell’ambito della revisione della Legge sugli agenti terapeutici (LTC, art. 67), Swissmedic pubblica ulteriori informazioni di interesse generale nel settore degli agenti terapeutici. Ad esempio, nel caso dei medicinali per uso umano, dopo la decisione di approvare o rifiutare un’autorizzazione all’immissione in commercio viene redatto un rapporto di valutazione sintetico (“Swiss Public Assessment Report”, SwissPAR), al fine di aumentare la trasparenza della procedura di autorizzazione. Ciò è tanto più importante in quanto altri Paesi (ad esempio quelli in via di sviluppo) prendono spunto dall’approvazione svizzera [6,7].
Letteratura:
- MS International Federation: Atlas of MS. www.msif.org/about-us/who-we-are-and-what-we-do/advocacy/atlas, ultimo accesso 28.02.19.
- Dippel FW, et al: I dati delle assicurazioni sanitarie confermano l’alta prevalenza della sclerosi multipla. Akt Neurol 2015; 42(4): 191-196.
- Koch-Henriksen N, et al: L’incidenza della SM è aumentata notevolmente nel corso di sei decenni in Danimarca, in particolare con un esordio tardivo e nelle donne. Neurologia 2018; 90(22): 1954-1963.
- Noseworthy JH, et al: Sclerosi multipla. N Engl J Med 2000; 343(13): 938-952.
- Montalban X, et al: Linea guida ECTRIMS/EAN sul trattamento farmacologico delle persone con sclerosi multipla. Mul Scler 2018; 24(2): 96-120.
- Dalla Torre Di Sanguinetto S, et al: Un esame comparativo delle decisioni di autorizzazione all’immissione in commercio in Svizzera, UE e USA. Ther Innov Regul Sci 2019; 53(1): 86-94.
- Achtnichts L, et al.: Aspetti specifici dell’immunoterapia per la sclerosi multipla in Svizzera: un commento strutturato. Neuroscienze cliniche e traslazionali [in stampa].
- Cohen JA, et al: Alemtuzumab vs. interferone beta 1a come trattamento di prima linea per i pazienti con sclerosi multipla recidivante-remittente: studio randomizzato controllato di fase 3. Lancet 2012; 380(9856): 1819-1828.
- Coles AJ, et al: Alemtuzumab per i pazienti con sclerosi multipla recidivante dopo la terapia modificante la malattia: uno studio randomizzato e controllato di fase 3. Lancet 2012; 380(9856): 1829-1839.
- Kappos L, et al: Uno studio controllato con placebo di Fingolimod orale nella sclerosi multipla recidivante. N Enl J Med 2010; 362: 387-401.
- Cohen JA, et al: Fingolimod orale o interferone intramuscolare per la sclerosi multipla recidivante remittente. N Enl J Med 2010; 362(5): 402-415.
- Traboulsee A, et al: Raccomandazioni rivedute della Task Force del Consorzio dei Centri SM per un protocollo di risonanza magnetica standardizzato e linee guida cliniche per la diagnosi e il follow-up della sclerosi multipla. Am J Neuroradiol 2016; 37(3): 394-401.
- Berger JR, et al: Leucoencefalopatia multifocale progressiva dopo il trattamento con fingolimod. Neurologia 2018; 90(20): 1815-1821.
InFo NEUROLOGIA & PSICHIATRIA 2019; 17(2): 28-30.












