Depuis plus d’une decenie, les biomarqueurs dans le LCR et plus recement dans le sang ont véritablement révolutionné le diagnostic de la maladie d’Alzheimer, permettant une détection plus précoce et plus précise de la pathologie. Les guidelines 2024, avec leur approche clinico-biologique intégrative, offrent une procedure plus complète pour le diagnostic et la prise en charge personnalisée de la maladie, avec des parcours spécifiques pour chaque stade de la pathologie.
Sie können nach empfohlener Durchsicht der materialien den CME-Test in unserer Lernplattform durchführen. Klicken Sie hierzu bitte auf folgenden Button:
La maladie d’Alzheimer (MA) est la principale cause de démence dans le monde, touchant plus de 50 millions de personnes. Cette pathologie neurodégénérative progressive se caractérise par des troubles de la mémoire, de l’encodage et des fonctions cognitives, liés à l’accumulation de plaques amyloïdes et d’enchevêtrements neurofibrillaires dans le cerveau. Historiquement, le diagnostic reposait principalement sur l’observation des symptômes cliniques, souvent confirmé post-mortem par l’analyse du cerveau. Cependant, avec l’avènement des technologies modernes, comme la neuro-imagerie et l’analyse des bio fluides, la MA a progressivement été redéfinie comme une pathologie biologique [1]. L’introduction des biomarqueurs, détectables dans des fluides corporels tels que le liquide céphalo-rachidien (LCR) et plus récemment dans le sang, a considérablement changé la manière de diagnostiquer la maladie, permettant dans les études de recherche une détection de plus en plus précoce de la maladie. En 2018, l’Institut National du Vieillissement (NIA) et l’Association Alzheimer (AA) ont introduit le cadre A/T/N (Amyloïde/Tau/Neurodégénérescence), qui permet de diagnostiquer la physiopathologie de la MA sur la base de biomarqueurs spécifiques [2]. Ce cadre a ainsi transformé la critériologie de la MA et son diagnostic. Cet article se propose d’examiner cette transition de la MA d’une interprétation clinique à une validation Clinico-biologique, en s’intéressant particulièrement aux biomarqueurs les plus prometteurs détectés dans le LCR et le sang, ainsi qu’aux nouvelles guidelines 2024, qui intègrent une approche clinico-biologique complémentaire pour un diagnostic précoce [3].
Les biomarqueurs dans le liquide céphalo-rachidien (LCR)
Le liquide céphalo-rachidien est un fluide biologique essentiel pour l’étude des biomarqueurs de la MA. Il reflète directement les changements pathologiques qui se produisent dans le cerveau. Parmi les biomarqueurs les plus importants mesurés dans le LCR figurent l’amyloïde-β 42 (Aβ42), la protéine tau totale (t-tau) et la protéine tau phosphorylée (p-tau).
Amyloïde-β 42 (Aβ42) et le ratio Aβ42/Aβ40: L’amyloïde-β 42 (Aβ42) est une protéine clé qui forme les plaques amyloïdes dans le cerveau des patients atteints de la MA. Une diminution de la concentration d’Aβ42 dans le LCR est observée en raison de son accumulation sous forme de plaques. Cette diminution est un marqueur précoce de la pathologie amyloïde. Le ratio Aβ42/Aβ40 est un indicateur utilisé pour améliorer la précision du diagnostic [4,5]. Alors que Aβ42 diminue dans le LCR en raison de la formation de plaques, les niveaux d’Aβ40, une forme de la protéine amyloïde moins spécifique à la pathologie, restent stables. Le ratio Aβ42/Aβ40 permet de corriger les variations individuelles des niveaux d’amyloïde-β et améliore la sensibilité et la spécificité du diagnostic de la MA. Un ratio bas indique une accumulation amyloïde significative et constitue un indicateur fiable de la maladie.
La proteine Tau et son hyperphosphorylation: La tau totale (t-tau) dans le LCR est un marqueur général de la neurodégénérescence. La protéine tau, en conditions normales, est impliquée dans la stabilisation des microtubules des neurones. Toutefois, dans la MA, des taux élevés de tau totale dans le LCR indiquent une dégradation neuronale. Bien que t-tau soit un indicateur de la neurodégénérescence [6], il n’est pas spécifique à la MA et peut être élevé dans d’autres pathologies neurodégénératives ou après une lésion cérébrale aiguë. La tau phosphorylée (p-tau) est une forme modifiée de la protéine tau, où des groupes phosphates sont ajoutés à des sites spécifiques, favorisant ainsi la formation d’enchevêtrements neurofibrillaires, une caractéristique clé de la MA. Les principales formes de p-tau mesurées dans le LCR sont p-tau181, p-tau217, et p-tau231. Ces biomarqueurs sont plus spécifiques à la MA que la tau totale.
- P-tau181 est l’un des premiers biomarqueurs tau phosphorylés identifiés pour la maladie d’Alzheimer (MA). Son augmentation dans le LCR reflète les changements pathologiques liés aux enchevêtrements neurofibrillaires, qui sont une caractéristique clé de la MA [7]. p-tau181 est un biomarqueur sensible et relativement spécifique de la MA, permettant de différencier cette maladie d’autres troubles neurodégénératifs. Cependant, bien que majoritairement associé à la MA, il peut aussi être légèrement élevé dans d’autres formes de démences.
- P-tau217 est plus étroitement lié à la pathologie de la MA que p-tau181. Des études récentes ont montré que p-tau217 présente une meilleure corrélation avec la formation des plaques amyloïdes et des enchevêtrements tau [8,9]. En raison de sa plus grande sensibilité et spécificité, p-tau217 pourrait progressivement remplacer p-tau181 en tant que biomarqueur de référence pour le diagnostic précoce, en particulier dans les stades précliniques et légers de la maladie.
- P-tau231 est un biomarqueur encore en phase d’étude, mais il pourrait fournir des informations supplémentaires sur les stades intermédiaires de la MA. Son utilité pourrait se situer principalement dans la surveillance de la transition entre le trouble cognitif léger (MCI) et la démence [10,11]. Bien que prometteur, p-tau231 nécessite encore des recherches pour valider sa spécificité et son rôle potentiel en clinique.
- MTBR-Tau243: Le MTBR-Tau243 est un biomarqueur spécifique et prometteur pour la détection de la pathologie tau dans la maladie d’Alzheimer (MA). Ce biomarqueur se distingue par sa capacité à refléter spécifiquement les agrégats insolubles de tau, qui sont fortement associés aux symptômes cliniques de la MA, notamment au déclin cognitif. Des études récentes ont montré que le MTBR-Tau243, mesuré dans le liquide céphalorachidien (LCR), est le marqueur le plus corrélé à l’imagerie tau-PET, surpassant d’autres formes de tau phosphorylé telles que p-tau181 et p-tau217. De plus, il présente une augmentation significative dans les phases avancées de la maladie, ce qui en fait un indicateur pertinent pour suivre l’évolution de la pathologie tau [12].
En plus de ces biomarqueurs principaux, d’autres formes comme p-tau205 et p-tau396/404 commencent à être explorées [13]. Bien qu’elles n’aient pas encore acquis la même importance que p-tau181 ou p-tau217, elles pourraient offrir des informations supplémentaires sur les stades avancés de la neurodégénérescence. Par exemple, p-tau396/404 est souvent associée aux phases plus sévères de la maladie et pourrait aider à suivre la progression dans les essais cliniques. La combinaison des niveaux de t-tau et de p-tau permet de renforcer le diagnostic de la maladie d’Alzheimer [14]. Alors que t-tau indique une dégénérescence neuronale générale, p-tau est plus spécifique à la pathologie Alzheimer. Un ratio t-tau/Aβ42 élevé est également utilisé comme un indicateur précis, où une augmentation de t-tau combinée à une diminution de Aβ42 reflète une neurodégénérescence avancée et une pathologie amyloïde [15].
Avancées technologiques pour la détection de proteines dans le plasma
La détection de la protéine tau phosphorylée (p-tau) dans le plasma représente l’une des avancées récentes les plus prometteuses dans le domaine des biomarqueurs pour la maladie d’Alzheimer (MA). Historiquement, la mesure de p-tau dans le plasma était limitée en raison de sa très faible concentration et de la présence d’autres protéines circulantes. Cependant, des technologies ultrasensibles, telles que SIMOA (utilisée par Quanterix) et les immunoessais automatisés (développés par Roche et Fujirebio), ont surmonté ces obstacles [16–20]. Elles permettent désormais la détection précise de biomarqueurs tels que p-tau181, p-tau217, et le ratio Aβ42/Aβ40, à des concentrations très faibles. Parmi ces biomarqueurs, p-tau217 s’est distingué par sa capacité à mieux classifier la pathologie amyloïde et tau, surpassant d’autres biomarqueurs comme Aβ42/Aβ40, souvent moins sensibles en raison de variations périphériques. Ces tests sont de plus en plus utilisés, non seulement dans la recherche, mais aussi pour un diagnostic préclinique plus accessible et moins invasif. D’autres sociétés, comme C2N Diagnostics, ont amélioré les tests sanguins pour la détection de Aβ42/Aβ40 à l’aide de la spectrométrie de masse. Bien que ce biomarqueur présente une précision moindre que p-tau217, il reste crucial pour évaluer la charge amyloïde cérébrale, bien que son interprétation doive être associée à d’autres biomarqueurs pour garantir une évaluation clinique fiable. Bien que ces innovations aient démontré un fort potentiel pour divers biomarqueurs, elles nécessitent encore des validations supplémentaires avant de pouvoir être largement utilisées en clinique. Toutefois, avec des précautions appropriées, ces technologies pourraient progressivement être intégrées dans la pratique clinique, offrant des perspectives prometteuses pour un diagnostic précoce, moins invasif, et potentiellement applicable à un dépistage de masse à l’avenir.
Les biomarqueurs sanguins
Au cours des cinq dernières années, les biomarqueurs sanguins ont pris une importance croissante comme alternative non invasive aux analyses du liquide céphalorachidien (LCR). Leur facilité d’utilisation et leur potentiel de dépistage en font des outils prometteurs pour le diagnostic de la maladie d’Alzheimer (MA). Parmi les biomarqueurs les plus étudiés, on retrouve les protéines tau phosphorylées (p-tau), la chaîne légère des neurofilaments (NfL), la gliofibrillaire acide protéine (GFAP), ainsi que les biomarqueurs amyloïdes, tels que le ratio Aβ42/Aβ40 dans le plasma. Bien que ces biomarqueurs offrent des perspectives intéressantes, leurs performances varient selon la technologie utilisée et le stade de la maladie [17].
Amyloïde-β dans le sang: une alternative prometteuse mais avec des limites: La détection des protéines amyloïdes dans le sang, notamment le ratio Aβ42/Aβ40, représente un tournant pour le diagnostic non invasif de la MA. Cependant, des études comparatives recente montrent que les tests basés sur Aβ42/Aβ40 sont globalement moins performants que ceux basés sur les protéines p-tau217 [16]. En effet, les fluctuations dues à des facteurs périphériques non liés à la pathologie cérébrale, comme la présence d’APP dans différents tissus, compliquent l’interprétation de ce biomarqueur. Les technologies comme SIMOA et Lumipulse permettent de mesurer ce ratio avec précision, mais des variations systémiques peuvent réduire leur spécificité. Bien que les biomarqueurs amyloïdes puissent être utiles pour évaluer la charge amyloïde cérébrale, ils nécessitent souvent d’être associés à d’autres biomarqueurs pour améliorer la précision du diagnostic.
Les protéines tau phosphorylées (p-tau): différences technologiques et implications cliniques: Les formes de p-tau mesurées dans le sang, telles que p-tau181, p-tau217, et parfois p-tau231, jouent un rôle crucial dans le diagnostic précoce de la MA. Selon les etudes recentes le p-tau217 est l’un des biomarqueurs les plus prometteurs, avec une meilleure précision diagnostique que p-tau181, notamment pour différencier la MA d’autres formes de démence.
- P-tau181: Bien qu’elle soit une des premières formes utilisées pour le diagnostic sanguin, P-tau181 présente une sensibilité limitée, surtout aux stades très précoces de la maladie [8]. Les tests comme ceux proposés par Roche et Quanterix montrent des performances acceptables, mais inférieures à p-tau217 en termes de corrélation avec les résultats PET amyloïdes [21].
- P-tau217: Selon les études recentes, le p-tau217 détecté via des technologies comme C2N et Fujirebio Lumipulse offre une meilleure sensibilité et spécificité pour la détection de la pathologie amyloïde, surpassant ainsi les autres biomarqueurs dans les tests comparatifs [22]. Les performances de p-tau217 sont particulièrement élevées dans les phases précliniques de la maladie, ce qui en fait un outil essentiel pour un dépistage précoce [21].
Neurofilament léger (NfL): un marqueur non spécifique de neurodégénérescence: NfL est un marqueur de neurodégénérescence non spécifique, mesuré dans le sang. Bien que les niveaux de NfL augmentent dans plusieurs maladies neurodégénératives, y compris la MA, ses performances sont inférieures à celles de p-tau. L’étude montre que les tests comme le Roche NeuroToolKit et le Quanterix Neurology 4-Plex permettent de détecter NfL avec une bonne sensibilité, mais avec une spécificité moindre par rapport à p-tau217. NfL reste néanmoins un excellent marqueur pour suivre l’évolution de la dégénérescence neuronale et pour évaluer les traitements neuroprotecteurs.
Gliofibrillaire acide protéine (GFAP): un marqueur de l’inflammation gliale: GFAP reflète l’inflammation gliale liée à l’activation des astrocytes dans le cerveau. L’étude montre que GFAP est un marqueur prometteur pour détecter l’inflammation associée à la pathologie amyloïde, avec des augmentations significatives observées dans les patients amyloïdes positifs. Cependant, tout comme NfL, GFAP n’est pas spécifique à la MA et peut être observé dans d’autres pathologies neuroinflammatoires. Les technologies Roche et Quanterix permettent de mesurer GFAP avec une grande précision, et sa combinaison avec p-tau améliore l’évaluation clinique [25].
Note: Le gène APOE, et en particulier l’allèle ε4, est le principal facteur de risque génétique de la MA. Les porteurs de l’allèle ε4 ont un risque accru de développer la maladie [26,27]. Cet allèle est également associé à des niveaux plus élevés de p-tau et de plaques amyloïdes, augmentant ainsi la probabilité d’une progression rapide de la pathologie. De plus, les porteurs d’APOE ε4 présentent souvent des niveaux accrus de GFAP, indiquant une neuro-inflammation plus marquée, ce qui suggère que cet allèle contribue non seulement à l’accumulation amyloïde, mais également à l’inflammation associée à la MA. La prise en considération de la genetique peux aussi servir d’indice pour interpréter les résultats d’une analyse de plasma d’un patient symptomatique.
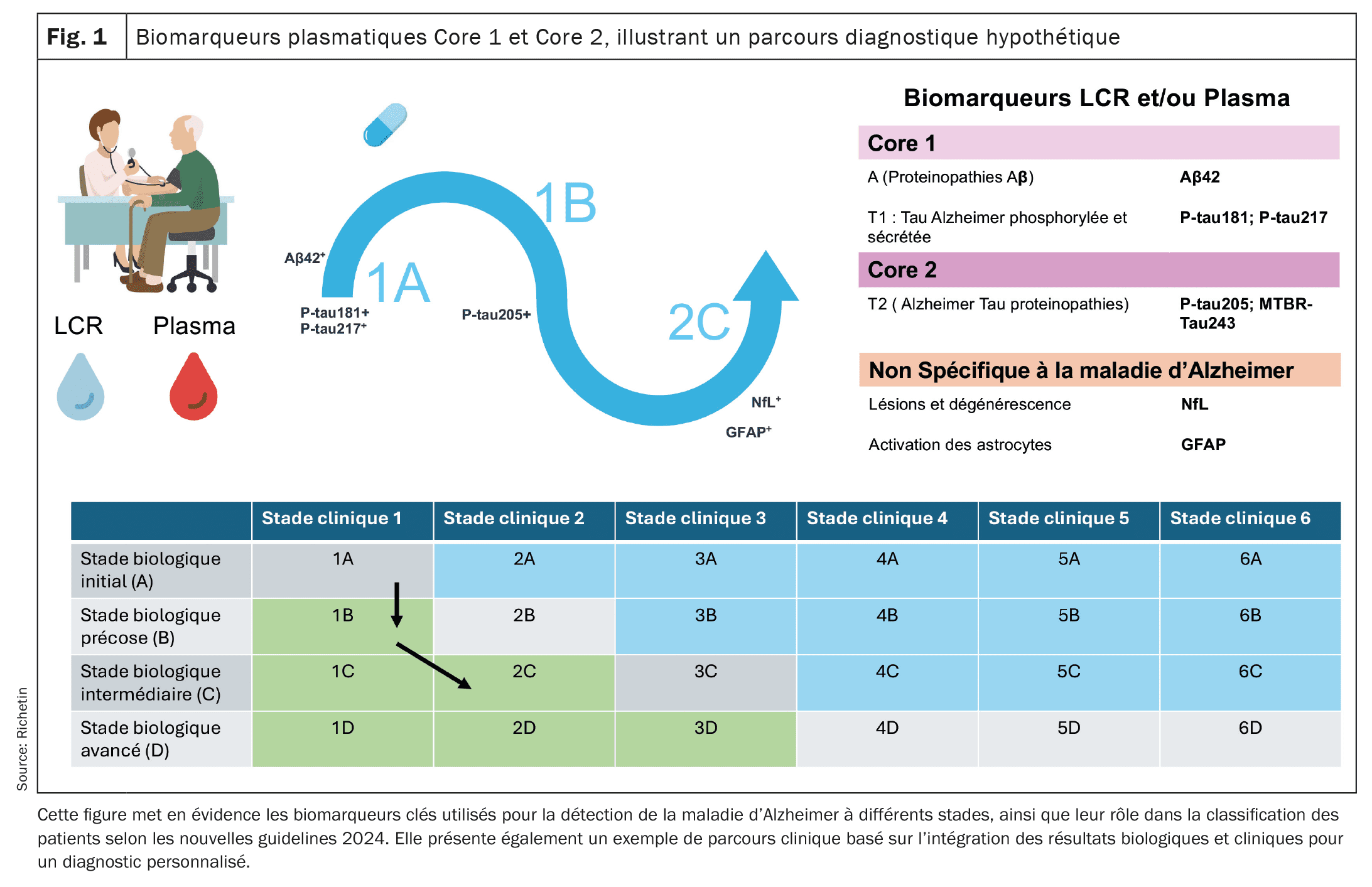
| Un nouveau concept de parcours diagnostiques est donc en train de voir le jour et sera probablement affiné durant ces prochaines années. A ce jour, les parcours classifient les patients selon les anomalies des biomarqueurs Core 1 et Core 2, ainsi que la présence ou non de symptômes cliniques, pour ajuster le diagnostic et le suivi. Ces nouvelles guidelines pourraient fournir un cadre plus précis pour l’évaluation diagnostique et le suivi de l’évolution de la MA de manière plus personnalisée, en intégrant des biomarqueurs plasmatiques, LCR et des évaluations cliniques. Elles faciliteront aussi une prise en charge adaptée à chaque stade de la maladie, de la phase préclinique jusqu’aux stades avancés de neurodégénérescence. |
De la recherche au diagnostique?
Au cours des dernières décennies, les avancées dans la recherche sur les biomarqueurs de la maladie d’Alzheimer ont permis une transition cruciale vers une application clinique et un diagnostique de precision de plus en plus accessible. Les premiers travaux ont porté sur l’identification de la pathologie amyloïde et de la protéinopathie tau dans le liquide céphalo-rachidien (LCR), conduisant à la mise au point de tests capables de détecter ces anomalies avec une grande précision. Ces biomarqueurs, d’abord utilisés en recherche, ont permis de confirmer la présence des changement physiopathologiques avant les symptômes. Cependant, l’accès à ces tests était limité aux centres de recherche spécialisés, en raison des techniques invasives et coûteuses utilisées. Avec l’introduction des biomarqueurs plasmatiques, notamment les formes de p-tau et le ratio Aβ42/Aβ40, la recherche a franchi une étape décisive vers une application clinique plus large. La capacité à détecter ces biomarqueurs dans le sang, grâce à des technologies ultrasensibles, a ouvert la voie à un dépistage non invasif et plus facilement réalisable en clinique. Ces innovations pourrait permettre de confirmer facilement la physiopathologie MA chez les patients avec une clinique suggestive et pourrait permettre d’identifier des individus asymptomatiques à risque de la développer la MA, même avant l’apparition des symptômes cognitifs. Toutefois, des défis subsistent quant à la standardisation des tests, leur variabilité (variation circadienne, fonction renale, vasculaire), leur disponibilité en dehors des grands centres, et la prise en charge des coûts, notamment pour le remboursement des tests plasmatiques. L’intégration progressive des biomarqueurs dans les parcours de soins quotidiens, associée à des technologies d’imagerie comme le PET amyloïde et tau-PET, permet non seulement un diagnostic plus précoce, mais aussi une meilleure évaluation de la progression de la maladie. Ce passage de la recherche à la clinique représente une avancée majeure pour la médecine personnalisée, pourrait permettre des stratégies de prévention secondaire ou tertiaire selon le stade de la maladie.
Vers une approche clinico-biologique plus intégrée
À l’été 2024, l’Institut National du Vieillissement (NIA) et l’Association Alzheimer ont proposé de nouvelles guidelines basées sur une approche combinant des évaluations cliniques et biologiques pour améliorer le diagnostic et le suivi de la progression de la maladie d’Alzheimer (MA) [16]. Ces directives s’organisent autour de deux catégories de biomarqueurs: Core 1 et Core 2, ainsi que plusieurs parcours diagnostiques (1A, 1B, etc.), permettant de classifier les patients selon l’évolution de leur pathologie. Les biomarqueurs du Core 1 mesurent directement la pathologie amyloïde et tau. Ils incluent des indicateurs comme le ratio bêta-amyloïde Aβ42/Aβ40 et les formes de tau phosphorylée (p-tau181, p-tau217). Ces anomalies apparaissent dès les premiers stades de la maladie, souvent en corrélation avec les résultats de l’imagerie PET amyloïde, facilitant ainsi un diagnostic précoce, avant même l’apparition des symptômes cliniques. Les biomarqueurs plasmatiques, en particulier p-tau217 et p-tau181, se sont révélés utiles pour détecter ces anomalies dans le plasma, permettant un dépistage plus large et moins invasif. Toutefois, l’interprétation de ces résultats doit être associée à une évaluation clinique approfondie. Les biomarqueurs du Core 2 reflètent des processus de neurodégénérescence et de protéinopathie tau plus avancée, tels que la MTBR-tau243. Ils deviennent anormaux à des stades plus avancés de la MA, en lien direct avec l’apparition de symptômes cognitifs. Des biomarqueurs comme la chaîne légère des neurofilaments (NfL) et la gliofibrillaire acide protéine (GFAP), détectés dans le sang et le liquide céphalo-rachidien (LCR), fournissent des informations précieuses sur la dégénérescence neuronale et l’inflammation, jouant un rôle crucial dans l’évaluation de la progression de la maladie et l’adaptation des stratégies thérapeutiques.
Proposition d’un scénario hypothétique pour le parcours diagnostique et thérapeutique d’un patient atteint de la maladie d’Alzheimer
Étape 1: Depistage dans un centre de la memoire (Parcours 1A): Mr. K., 62 ans, consulte lors d’une visite de routine sans symptômes cognitifs perceptibles. Compte tenu de ses antécédents familiaux de maladie d’Alzheimer, il serait orienté pour une évaluation précoce dans un Centre de la mémoire. Un test sanguin pourrait révéler des niveaux anormalement élevés de p-tau217 ainsi qu’un ratio Aβ42/Aβ40 réduit, des indicateurs potentiels d’une pathologie amyloïde. Ces résultats seraient confirmés par une analyse du liquide céphalorachidien (LCR), montrant une accumulation anormale d’amyloïde et de protéines tau. À ce stade, Mr K. ne présenterait aucun symptôme clinique, mais ses biomarqueurs Core 1 (p-tau et Aβ) pourraient indiquer une pathologie d’Alzheimer en phase préclinique (Parcours 1A). Étant donné la détection précoce de cette pathologie amyloïde, il serait envisageable de proposer une thérapie anti-amyloïde, telle que le lecanemab ou le donanemab, pour ralentir la formation de plaques amyloïdes dans le cerveau. Ces traitements, administrés à un stade préclinique, pourraient avoir pour objectif de retarder la progression vers des symptômes cognitifs plus graves.
Étape 2: Apparition de troubles cognitifs légers (Parcours 1B): Deux ans plus tard, Mr K. pourrait commencer à ressentir des troubles de la mémoire légers, comme des oublis de rendez-vous. Une réévaluation clinique serait alors réalisée, comprenant une nouvelle série d’analyses sanguines et une ponction lombaire. Les résultats pourraient montrer des anomalies persistantes dans les biomarqueurs Core 1, confirmant la continuité de la pathologie amyloïde et tau. Des tests neuropsychologiques pourraient révéler une détérioration cognitive légère. À ce stade, Mr K. entrerait dans le Parcours 1B, caractérisé par la présence de troubles cognitifs légers (Mild Cognitive Impairment, ou MCI) associés à des biomarqueurs anormaux. Cette évolution pourrait justifier une intensification de la surveillance et un ajustement potentiel de la thérapie anti-amyloïde pour renforcer la prévention des symptômes plus graves. Ces traitements continueraient d’être administrés dans le but de retarder la progression vers une démence confirmée.
Étape 3: Évolution vers une neurodégénérescence avancée (Parcours 2C): Cinq ans après le diagnostic initial, les symptômes de Mr K. s’aggraveraient. Il pourrait présenter des troubles cognitifs plus sévères, affectant ses activités quotidiennes, marquant ainsi la transition vers une démence plus avancée. Une nouvelle série d’analyses de biomarqueurs serait réalisée, révélant des anomalies dans les biomarqueurs Core 2, comme l’élévation du p-tau205. Par ailleurs, des biomarqueurs de neurodégénérescence, tels que le NfL (Neurofilament light chain) et la GFAP (Glial Fibrillary Acidic Protein), pourraient indiquer une neuroinflammation et une destruction active des neurones. Une imagerie tau-PET pourrait montrer une accumulation étendue de tau dans les régions associées à la cognition. À ce stade, Mr K. se trouverait dans le Parcours 2C, avec une neurodégénérescence prononcée. Le plan de traitement se concentrerait alors sur la gestion des symptômes cognitifs et comportementaux, avec une combinaison de thérapies symptomatiques, de soins personnalisés et d’un soutien accru pour la famille, visant à maintenir la qualité de vie du patient.
Conclusion: Ce scénario hypothétique met en lumière l’importance d’une détection précoce par des biomarqueurs sanguins et LCR dans la maladie d’Alzheimer. Il montre également que l’introduction de thérapies anti-amyloïdes pourrait permettre de retarder la progression de la maladie avant l’apparition des symptômes. La surveillance continue des biomarqueurs, couplée à des évaluations neuropsychologiques, permettrait d’ajuster les interventions thérapeutiques en fonction de l’évolution biologique et clinique, assurant ainsi une prise en charge personnalisée du patient.
Avantages cliniques du diagnostic précoce
Le diagnostic précoce de la maladie d’Alzheimer, rendu possible grâce aux biomarqueurs dans le LCR et le sang, apporte des bénéfices cliniques majeurs. Il permet d’intervenir à un stade où des traitements, bien que limités dans leur capacité à inverser la maladie, peuvent ralentir la progression des symptômes cognitifs. En identifiant la pathologie au stade 1A, lorsque les patients ne présentent encore aucun signe clinique, les praticiens pourraient mettre en place des stratégies thérapeutiques préventives qui visent à retarder la transition vers des stades plus symptomatiques. Un autre avantage clé du depistage précoce est qu’il offre la possibilité de mieux planifier les soins à long terme. Une fois que la pathologie a été identifiée par des biomarqueurs amyloïdes ou tau, les patients et leurs familles peuvent bénéficier d’une meilleure anticipation de l’évolution de la maladie. Cela inclut des décisions plus éclairées en matière de soins, de gestion des finances et d’organisation de la vie quotidienne, ainsi que la mise en place de réseaux de soutien adaptés. Cette approche proactive permet d’améliorer la qualité de vie du patient en retardant les effets invalidants de la démence et en favorisant une prise en charge personnalisée.
Le diagnostic précoce, grâce à des biomarqueurs comme p-tau217 et Aβ42/Aβ40, permet également une prise de décision thérapeutique mieux ciblée et adaptée au patient. Les cliniciens peuvent déterminer plus tôt si un patient est éligible pour des essais cliniques sur de nouvelles thérapies ou pour des traitements modificateurs de la maladie qui visent à ralentir l’accumulation amyloïde ou tau. En traitant les patients aux premiers stades de la maladie, il est également possible de limiter l’impact des complications secondaires liées à l’évolution de la MA, telles que la perte d’autonomie, les troubles comportementaux, et la charge accrue pour les aidants. Enfin, le diagnostic précoce permet une meilleure gestion des ressources médicales en particulier dans les pays a faible ressources [28]. En identifiant plus précisément les patients qui bénéficieraient le plus d’une surveillance rapprochée ou d’interventions spécifiques, les cliniciens peuvent adapter leurs pratiques et prioriser les soins en fonction de la gravité de la maladie. Cela pourrait également avoir des implications économiques positives, en réduisant les coûts à long terme associés aux soins tardifs de la démence avancée, qui impliquent souvent des hospitalisations et une prise en charge plus complexe.
Conclusion
Les biomarqueurs dans le LCR et le sang ont véritablement révolutionné le diagnostic de la maladie d’Alzheimer, permettant une détection plus précoce et plus précise de la pathologie, avant même l’apparition des symptômes cliniques. Les guidelines 2024, avec leur approche clinico-biologique intégrative, offrent une procedure plus complet pour le diagnostic et la prise en charge personnalisée de la maladie, avec des parcours spécifiques pour chaque stade de la pathologie. Toutefois, malgré ces avancées, il est nécessaire de poursuivre les efforts pour rendre ces technologies plus accessibles, notamment en élargissant leur disponibilité en dehors des centres spécialisés et en abordant les questions liées aux coûts et au remboursement. Ces initiatives seront cruciales pour améliorer la gestion de cette maladie à grande échelle, en permettant un accès plus équitable aux diagnostics précoces et à des interventions thérapeutiques et surveillances plus adaptées.
Take-Home-Messages
- Depuis plus d’une decenie, les biomarqueurs dans le LCR et plus recement dans le sang ont véritablement révolutionné le diagnostic de la maladie d’Alzheimer, permettant une détection plus précoce et plus précise de la pathologie.
- Les guidelines 2024, avec leur approche clinico-biologique intégrative, offrent une procedure plus complète pour le diagnostic et la prise en charge personnalisée de la maladie, avec des parcours spécifiques pour chaque stade de la pathologie.
- Toutefois, malgré ces avancées, il est nécessaire de poursuivre les efforts pour rendre ces technologies plus fiables et accessibles. Les biomarqueurs de la maladie d’Alzheimer dans le sang, pourraient dans les prochaines années transformer la manière de diagnostiquer précocement la maladie d’Alzheimer, offrant ainsi une fenêtre d’intervention avant même l’apparition des symptômes cliniques.
- Des marqueurs comme p-tau217 et le ratio Aβ42/Aβ40 promettent d’augmenter la précision diagnostique, permettant d’envisager des stratégies thérapeutiques qui ralentiraient la progression de la maladie.
- Ces avancées offriraient aux cliniciens des outils plus sensibles, moins invasifs et potentiellement applicables en routine clinique.
- Bien que des défis subsistent en matière de standardisation et de coût pour les systemes de santé, les guidelines 2024 ouvriraient la voie à une prise en charge personnalisée, associant évaluation biologique et clinique pour optimiser le suivi à chaque stade de la maladie.
Littérature:
- Huang S, Wang YJ, Guo J: Biofluid Biomarkers of Alzheimer’s Disease: Progress, Problems, and Perspectives. Neuroscience Bulletin 2022 38: 6 38, 677–691 (2022).
- Jack CR, et al.: NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimer’s & Dementia 2018; 14: 535–562.
- Jack CR, et al.: Revised criteria for diagnosis and staging of Alzheimer’s disease: Alzheimer’s Association Workgroup. Alzheimer’s and Dementia 2024; 20: 5143–5169.
- Salvadó G, et al.: Specific associations between plasma biomarkers and postmortem amyloid plaque and tau tangle loads. EMBO Mol Med 2023; 15.
- Hansson O, Lehmann S, Otto M, et al.: Advantages and disadvantages of the use of the CSF Amyloid β (Aβ) 42/40 ratio in the diagnosis of Alzheimer’s Disease. Alzheimers Res Ther 2019; 11: 1–15.
- Holper S, Watson R, Yassi N: Tau as a Biomarker of Neurodegeneration. International Journal of Molecular Sciences 2022; 23: 7307.
- Kurihara M, Komatsu H, Sengoku R: FULL-LENGTH ARTICLE CSF P-Tau181 and Other Biomarkers in Patients With Neuronal Intranuclear Inclusion Disease. Cite as: Neurology® 2023; 100: 1009–1019.
- Janelidze S, et al.: Plasma P-tau181 in Alzheimer’s disease: relationship to other biomarkers, differential diagnosis, neuropathology and longitudinal progression to Alzheimer’s dementia. Nat Med (2020), doi: 10.1038/s41591-020-0755-1.
- Janelidze S, et al.: Cerebrospinal fluid p-tau217 performs better than p-tau181 as a biomarker of Alzheimer’s disease. Nature Communications 2020; 11(1): 1–12.
- Ashton NJ, et al.: Plasma p-tau231: a new biomarker for incipient Alzheimer’s disease pathology. Acta Neuropathol 2021; 141: 709–724.
- Buerger K, et al.: CSF tau protein phosphorylated at threonine 231 correlates with cognitive decline in MCI subjects. Neurology 2002; 59: 627–629.
- Horie K, et al.: CSF MTBR-tau243 is a specific biomarker of tau tangle pathology in Alzheimer’s disease. Nature Medicine 2023; 29(8): 1954–1963.
- Lantero-Rodriguez J, et al.: CSF p-tau205: a biomarker of tau pathology in Alzheimer’s disease. Acta Neuropathol 2024; 147: 1–17.
- Olsson B, et al.: CSF and blood biomarkers for the diagnosis of Alzheimer’s disease: a systematic review and meta-analysis. Lancet Neurol 2016; 15: 673–684.
- Santangelo R, et al.: The CSF p-tau181/Aβ42 Ratio Offers a Good Accuracy “In Vivo” in the Differential Diagnosis of Alzheimer’s Dementia. Curr Alzheimer Res 2019; 16: 587–595.
- Schindler SE, et al.: Head-to-head comparison of leading blood tests for Alzheimer’s disease pathology. Alzheimer’s & Dementia (2024), doi: 10.1002/ALZ.14315.
- Hampel H, et al.: Blood-based biomarkers for Alzheimer’s disease: Current state and future use in a transformed global healthcare landscape. Neuron 2023; 111: 2781–2799.
- Hansson O, et al.: The Alzheimer’s Association appropriate use recommendations for blood biomarkers in Alzheimer’s disease. Alzheimer’s & Dementia 2022; 18: 2669–2686.
- Hansson O, Blennow K, Zetterberg H, Dage J: Blood biomarkers for Alzheimer’s disease in clinical practice and trials. Nat Aging 2023; 3: 506–519.
- Álvarez-Sánchez L, Peña-Bautista C, Baquero M, Cháfer-Pericás C: Novel Ultrasensitive Detection Technologies for the Identification of Early and Minimally Invasive Alzheimer’s Disease Blood Biomarkers. Journal of Alzheimer’s Disease 2022; 86: 1337–1369.
- Blennow K, et al.: The potential clinical value of plasma biomarkers in Alzheimer’s disease. Alzheimer’s & Dementia 2023; 19: 5805–5816.
- Ashton NJ, et al.: Diagnostic Accuracy of a Plasma Phosphorylated Tau 217 Immunoassay for Alzheimer Disease Pathology. JAMA Neurol 2024; 81: 255–263.
- Alcolea D, Beeri MS, Rojas JC, et al.: Blood Biomarkers in Neurodegenerative Diseases: Implications for the Clinical Neurologist. Neurology 2023; 101: 172–180.
- Palmqvist S, et al.: Discriminative Accuracy of Plasma Phospho-tau217 for Alzheimer Disease vs Other Neurodegenerative Disorders. JAMA 2020; 324: 772–781.
- Kim KY, Shin KY, Chang KA: GFAP as a Potential Biomarker for Alzheimer’s Disease: A Systematic Review and Meta-Analysis. Cells 2023: 12.
- Yakoub Y, et al.: Longitudinal blood biomarker trajectories in preclinical Alzheimer’s disease. Alzheimers Dement 2023; 19: 5620–5631.
- Stevenson-Hoare J, et al.: Plasma biomarkers and genetics in the diagnosis and prediction of Alzheimer’s disease. Brain 2023; 146: 690–699.
- Nwamekang Belinga L, et al.: Circulating Biomarkers for Alzheimer’s Disease: Unlocking the Diagnostic Potential in Low- and Middle-Income Countries, Focusing on Africa. Neurodegener Dis 2024; 24: 26–40.
InFo NEUROLOGIE & PSYCHIATRIE 2024; 22(6): 14–19