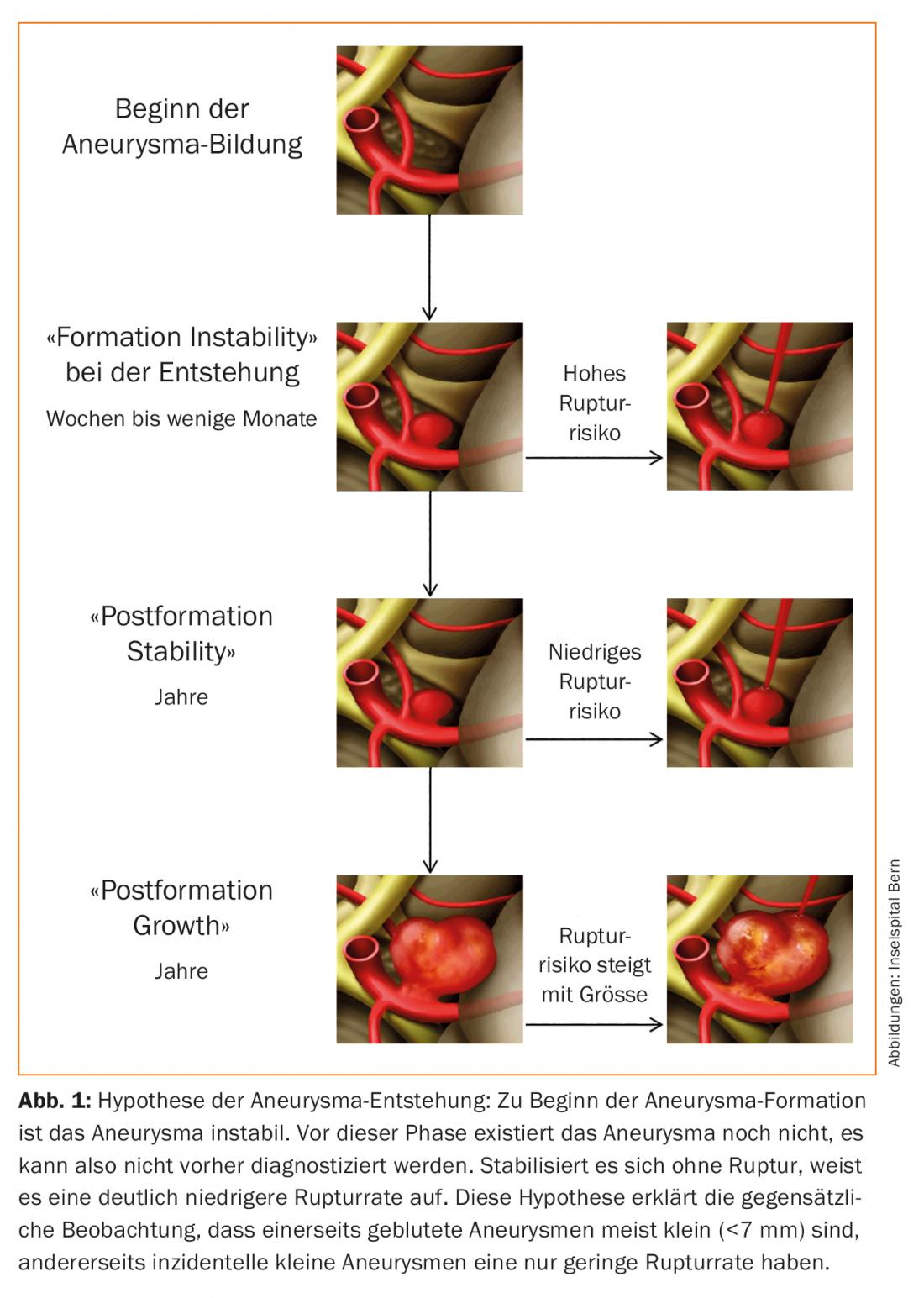
Les anévrismes sont instables au début de leur formation et se rompent fréquemment. Cependant, la majorité des anévrismes se stabilisent sans rupture. Outre les facteurs liés à l’anévrisme, la décision de traiter ou d’observer dépend de l’espérance de vie et du risque lié au traitement.
Les anévrismes ne sont pas innés, ils se développent au cours de la vie. Toutefois, à de très rares exceptions près, ce n’est pas l’anévrisme lui-même, mais la rupture suivie d’une hémorragie sous-arachnoïdienne qui met la vie du patient en danger. En principe, il est vrai que le traitement des anévrismes non rompus permet d’éviter les saignements de l’anévrisme. Cependant, le risque de rupture doit être évalué individuellement par rapport au risque du traitement – et ces deux risques varient considérablement en fonction de la situation, de sorte que l’indication du traitement est toujours une décision au cas par cas. L’article ne traite que des anévrismes incidents sans hémorragie sous-arachnoïdienne préalable.
Prévalence des anévrismes non rompus et incidence des ruptures
L’incidence des anévrismes non rompus dans la population est de 2-3% [1,2]. Des chiffres plus élevés ont également été publiés, mais ils proviennent souvent d’études autopsiques. Le médecin généraliste ou le spécialiste est donc régulièrement confronté à ce résultat lorsqu’il prescrit une IRM à des patients souffrant de troubles non spécifiques ou de céphalées.
L’incidence d’une rupture est d’environ 5 à 10 personnes pour 100 000 habitants pour l’Europe centrale. Elle est plus élevée au Japon et en Finlande pour des raisons peu claires, mais semble converger au cours des dernières décennies. Il est donc clair que seule une partie des anévrismes – environ 15%, comme nous allons le montrer dans le paragraphe suivant – se rompt.
Risque de rupture d’anévrismes non rompus
Comme la plupart des anévrismes rompus sont inférieurs à 7 mm, on estimait jusqu’en 1999 que le taux de rupture était de 0,5 à 1 % par an. L’étude la plus vaste, d’abord rétrospective puis prospective, portant sur 1077 patients (bras prospectif), a étonnamment montré un risque nettement plus faible que ce que l’on pensait jusqu’alors [3]. En particulier, les petits anévrismes accidentels fréquents d’une taille de <7 mm présentaient un risque de rupture de seulement 0-0,1% par an. Les experts s’accordent à dire que les données ISUIA sont probablement trop faibles en raison d’un biais de sélection (de nombreux patients de ce groupe ont été opérés), d’une courte période de suivi (sur les 535 patients mentionnés ci-dessus, seuls 260 ont été suivis pendant deux ans, seuls 112 pendant quatre ans et seuls 35 pendant six ans) et d’une définition de groupe a posteriori. Néanmoins, le risque de rupture nettement plus faible par rapport aux hypothèses précédentes s’est confirmé dans la pratique, même au cours de la gestion “wait and scan”, actuellement beaucoup plus fréquente. Il faut distinguer les anévrismes dits additionnels, qui sont connus pour être présents chez les patients atteints de SAB provenant d’un autre anévrisme, ou tout anévrisme de plus de 7 mm.
La théorie moderne de la maladie anévrismale
La plus grande contradiction réside dans le fait que nous voyons aux urgences des patients présentant une rupture et une hémorragie sous-arachnoïdienne, dont l’anévrisme est dans plus de 50% des cas inférieur à 7 mm [4], mais que pour les anévrismes de la même catégorie de taille découverts par hasard, seuls deux patients sur 535 présentent une rupture sur une période de un à quatre ans.
Une théorie qui s’impose de plus en plus combine ces deux observations. Les anévrismes se forment probablement en quelques semaines ou mois. Pendant cette période, l’anévrisme est instable et peut se rompre. Cette phase instable est difficilement observable par une imagerie aléatoire, car elle est très courte. Il se stabilise ensuite et peut rester stable en taille pendant une longue période ou de manière permanente. Une partie des anévrismes se développe et atteint ainsi un risque de rupture parfois considérablement plus élevé en raison de l’augmentation de la taille et des modifications de la paroi lors de la croissance. (Fig. 1). D’après les données épidémiologiques disponibles, on peut estimer grossièrement que sur l’ensemble des anévrismes, environ 15% se rompent pendant la “naissance” de l’anévrisme et 15% au cours de l’évolution ultérieure – ces derniers étant généralement associés à des facteurs de risque.
Facteurs de risque de rupture
Les risques les plus importants sont
- Une croissance ou un changement visible de la configuration de l’anévrisme (5 à 20 fois)
- Génétique en cas d’anévrisme familial (six fois)
- Polykystose rénale (quintuple)
- Localisation
- Hypertension artérielle
- Fumer
- Forte consommation d’alcool avec plus de 300 g/d.
Ces derniers facteurs sont associés à une augmentation du risque d’environ deux à quatre fois [5].
Comme nous l’avons déjà mentionné, les anévrismes additionnels, dans lesquels le patient a déjà été traité pour une hémorragie due à la rupture d’un autre anévrisme, constituent un groupe de risque distinct avec des taux de rupture plus élevés.
Même pour les anévrismes traités, une récidive de l’anévrisme peut survenir en fonction de la méthode de traitement et des résultats thérapeutiques. Ces patients peuvent également être sujets à des anévrismes de novo dans 0,5 à 2,5% des cas par an.
Oublier, surveiller ou traiter ?
La meilleure gestion dépend de nombreux facteurs et est toujours une décision au cas par cas, qui prend en compte les facteurs suivants :
- Risque de rupture
- Risque lié au traitement
- Espérance de vie en tenant compte de la qualité de vie
- le type de risque et l’attitude du patient.
Le risque de rupture d’anévrisme en cas de découverte fortuite varie dans les cas extrêmes entre 0,1% et 10% par an et dépend de la taille et des autres facteurs de risque déjà mentionnés. Le score PHASES, qui est un score cumulé permettant d’estimer le risque, est devenu la référence en matière d’application pratique [6].
Le risque du traitement dépend également de nombreux facteurs, mais le plus évident est la taille de l’anévrisme. Ainsi, les anévrismes de grande taille ou “géants”, qui présentent le risque de rupture le plus élevé, ont également le risque de traitement le plus élevé. Il est préférable de connaître le risque de complication de l’intervention non pas à partir de la littérature, mais à partir du contrôle de qualité via sa propre base de données.
Dans la balance “risque de rupture/risque de traitement”, il ne faut pas oublier l’influence du risque de complication immédiate d’un traitement par opposition au risque de rupture différée en cas d’observation. L’apparente égalité des risques – par exemple pour un risque de saignement de 4% au cours des 20 prochaines années avec un risque de rupture de 0,2% par an et un risque de complications graves de 4% en cas de traitement – est fausse car, contrairement aux complications liées au traitement, le taux de rupture en cas d’observation est statistiquement réparti sur les 20 ans. L’égalité n’est atteinte que lorsque le temps d’observation est doublé.
Le suivi de l’évolution – “wait and scan” – est une gestion fréquente chez de nombreux patients. Les petits anévrismes de la circulation antérieure sans facteurs de risque majeurs ont un faible risque de rupture, qui se réduit probablement en grande partie aux cas de croissance de taille ou de changement de forme. Là encore, le score PHASES aide à estimer la probabilité de croissance, qui se situe entre 1% et 5% par an [7]. Si un anévrisme présente une augmentation de taille, le risque de rupture augmente massivement et se situe entre 5 et 10 % par an. Une croissance ou un changement de configuration avéré sera donc généralement une indication de traitement.
Résumé
Les chiffres épidémiologiques récents suggèrent un faible risque de rupture pour les petits anévrismes accidentels (<7 mm) de la circulation cérébrale antérieure. Mais souvent, des facteurs de risque supplémentaires et les complications de traitement de la thérapie endovasculaire ou microchirurgicale sont tout aussi déterminants pour la meilleure prise en charge d’un patient concret. L’entretien avec le médecin ne permet souvent pas de donner une recommandation claire et le type de risque du patient influence considérablement la décision. La décision de surveiller ou de traiter un anévrisme découvert par hasard reste une décision neuromédicale très individuelle, qui doit être prise par une équipe interdisciplinaire et bien rodée, qui connaît ses propres complications. Ainsi, nous voyons et discutons environ 850 cas par an dans notre conseil interdisciplinaire sur l’anévrisme (aneurysma.board@insel.ch), ce qui montre l’ampleur des découvertes fortuites.
Messages Take-Home
- Grâce à l’imagerie moderne et à la prévalence de 2%, les médecins généralistes et les spécialistes sont souvent confrontés à la découverte fortuite d’un anévrisme accidentel.
- Les anévrismes sont instables au début de leur formation et se rompent fréquemment. Cependant, la majorité des anévrismes se stabilisent sans rupture.
- Le risque de rupture d’anévrisme en cas de découverte fortuite varie dans les cas extrêmes entre 0,1% et 10% par an et dépend de la taille et d’autres facteurs de risque.
- De nombreux anévrismes peuvent être observés. Ce sont surtout les petits anévrismes (<7 mm) de l’artère cérébrale interne et de l’artère cérébrale moyenne qui présentent un faible risque d’hémorragie en l’absence d’autres facteurs de risque.
- La décision de traiter ou d’observer dépend toutefois, outre de nombreux facteurs liés à l’anévrisme, de l’espérance de vie, du risque du traitement et de l’attitude du patient face au risque et doit être discutée au sein d’un conseil interdisciplinaire sur l’anévrisme.
Littérature :
- Vernooij MW, et al : N Engl J Med 2007 ; 357 : 1821-1828.
- Etminan N, et al : Nat Rev Neurol 2016 ; 12 : 699-713.
- Wiebers DO, et al : Lancet 2003 ; 362 : 103-110.
- Beck J, et al : Acta Neurochir 2003 ; 145 : 861-865.
- Rinkel GJ : Lancet Neurol 2005 ; 4 : 122-128.
- Greving JP, et al : Lancet Neurol 2014 ; 13 : 59-66.
- Backes D, et al : Stroke 2015 ; 46 : 1221-1226.
InFo NEUROLOGIE & PSYCHIATRIE 2017 ; 15(5) : 4-6