Des études telles que CESAR ou SHOCK II, mais aussi le perfectionnement des pompes, des oxygénateurs et des tubes de perfusion, ont contribué à ce que la thérapie par ECMO et ECLS gagne fortement en importance. Ces procédures représentent un défi pour l’équipe de traitement interdisciplinaire.
ECMO signifie “Extracorporeal membrane oxygenation” et désigne une pompe centrifuge extracorporelle équipée d’un oxygénateur et reliée à la circulation du patient par un système de tuyaux. On distingue l’ECMO veino-veineuse, utilisée en cas d’insuffisance pulmonaire aiguë, et l’ECMO veino-artérielle, utilisée chez les patients en choc cardiogénique aigu. Récemment, la nomenclature a été spécifiée en termes d’ECMO pour la configuration veino-veineuse (vv) et d’ECLS (“Extracorporeal Life Support”) pour la configuration veino-artérielle (va).
La thérapie par ECMO/ECLS a connu une croissance rapide au cours des dernières années. Cela était initialement dû aux résultats publiés dans l’étude CESAR, qui indiquaient que les patients traités par ECMO veino-veineuse pour un syndrome de détresse respiratoire aiguë (SDRA) bénéficiaient d’un avantage en termes de survie et de qualité de vie, par rapport aux patients recevant uniquement un traitement ventilatoire axé sur le SDRA [1]. L’implantation de vaECLS en cas de choc cardiogénique a également connu un essor extraordinaire. Cela s’expliquait d’une part par les progrès techniques des pompes, des oxygénateurs et des tuyaux de perfusion. D’autre part, l’étude SHOCK II, qui n’a pas montré d’avantage de survie en cas de choc cardiogénique grâce à l’utilisation de la pompe à ballonnet intra-aortique (PIAA) [2], a ouvert la voie à l’utilisation de la vaECLS.
La prise en charge des patients à la vvECMO ou vaECLS représente un défi particulier. L’implantation du système et le traitement ultérieur du patient nécessitent une équipe pluridisciplinaire et pluriprofessionnelle, comprenant notamment des médecins réanimateurs, des chirurgiens cardiaques, des cardiologues et des pneumologues, ainsi que des cardiotechniciens et des infirmiers en soins intensifs.
Canulation et configuration de vvECMO et vaECLS
En tant que procédure pour insuffisance pulmonaire aiguë, l’ECMO est implantée dans une configuration veino-veineuse (Fig. 1). Pour le drainage veineux, une canule est introduite dans la veine fémorale commune (VFC). L’extrémité de la canule est alors placée sous contrôle échocardiographique de manière à ce qu’elle se trouve à l’entrée de la veine cave inférieure (VCI) dans l’oreillette droite. Pour l’apport de sang oxygéné, une canule est introduite dans la veine jugulaire interne (VJI). L’extrémité de la canule est située dans la veine cave supérieure (VCS).
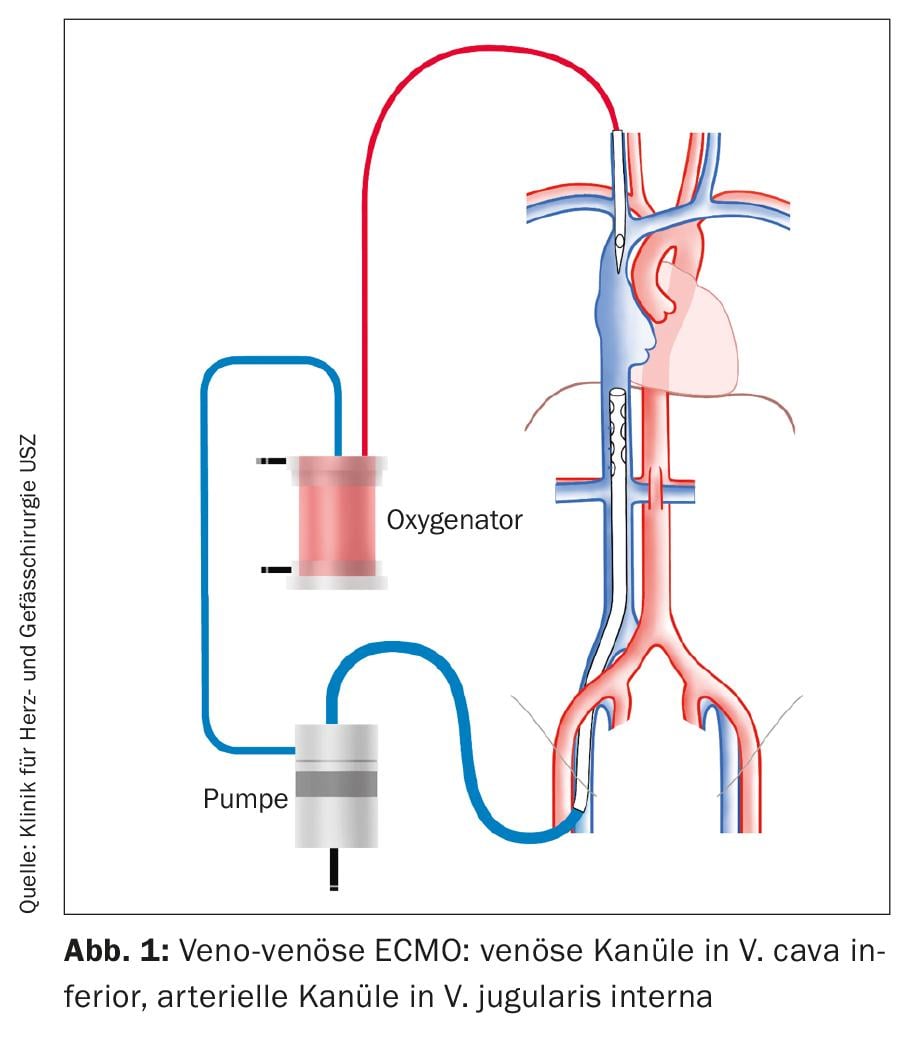
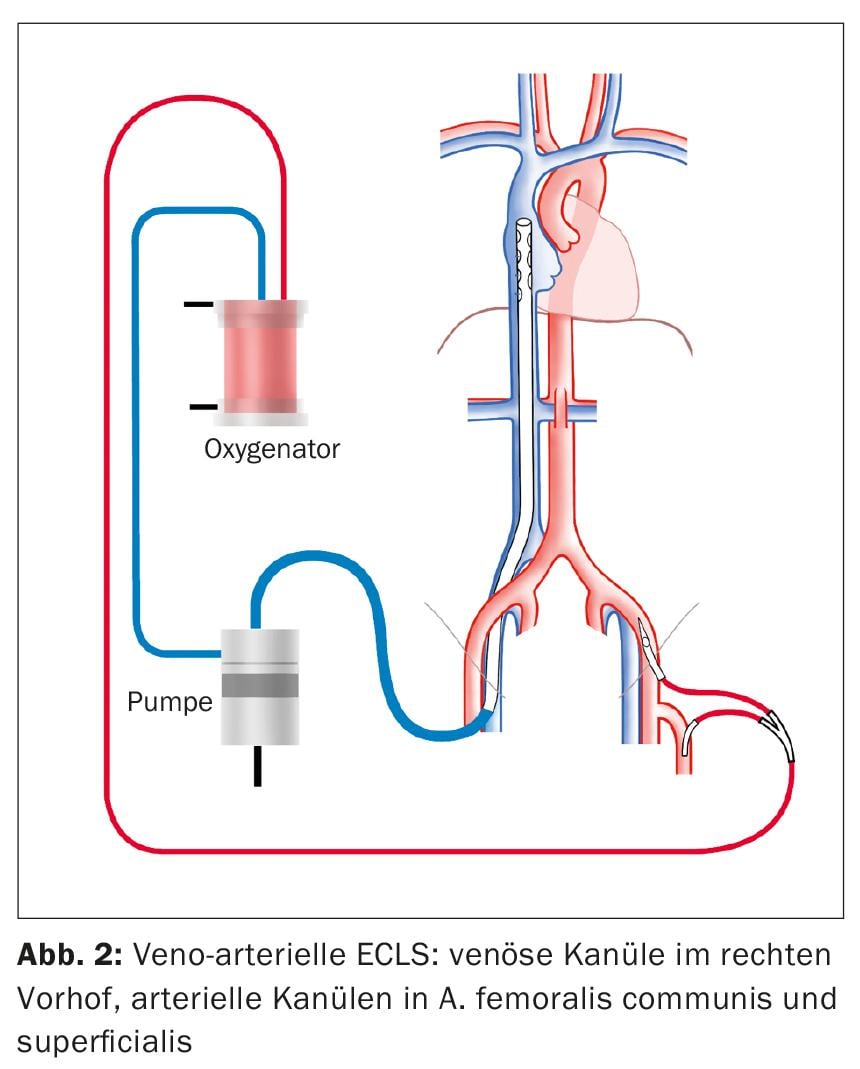
L’ECLS en tant que procédure de choc cardiogénique est implantée dans une configuration veino-artérielle (Fig. 2). Comme pour la vvECMO, une canule est introduite dans la VFC droite pour le drainage veineux. Toujours sous contrôle échocardiographique, l’extrémité de la canule est placée de manière à ce qu’elle se trouve à 1-2 cm dans la veine cave supérieure afin d’obtenir un drainage optimal de la moitié supérieure et inférieure du corps. L’accès standard pour l’apport artériel est l’artère fémorale commune (AFC). La canule est insérée en direction proximale dans l’artère iliaque externe. En outre, une branche de perfusion est placée distalement dans l’artère fémorale superficielle afin d’éviter l’ischémie de la jambe.
En premier lieu, toutes les canules sont implantées par voie percutanée. Avant l’introduction de la canule AFC, un système d’occlusion vasculaire percutané est mis en place afin d’obtenir une fermeture du trou de ponction lors du retrait percutané ultérieur de la canule. Si la ponction percutanée de l’AFC n’est pas efficace, la canule doit être implantée par chirurgie ouverte. Cette procédure peut être nécessaire en cas d’implantation dans des conditions de réanimation. Aucun système d’occlusion vasculaire percutané n’est nécessaire pour retirer les canules veineuses de la VFC et de la VJI. Une suture permet de fermer le trou de ponction.
Stratégies de traitement
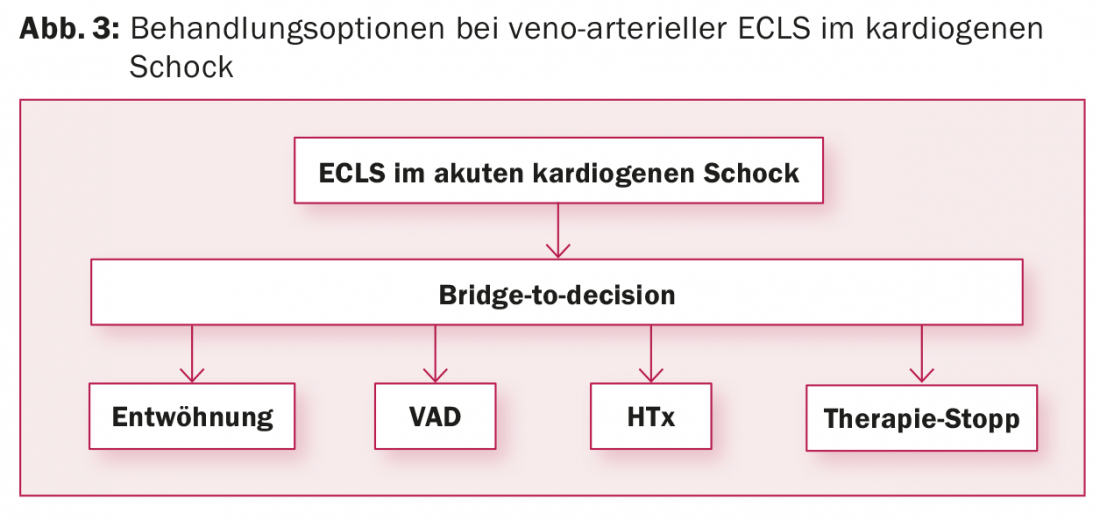
vaECLS : l’implantation de la vaECLS se fait souvent dans une situation d’urgence qui ne laisse pas le temps d’évaluer la stratégie de traitement après la vaECLS. Les comorbidités et l’environnement psychosocial du patient sont généralement inconnus. Il s’agit toutefois d’une condition préalable à la définition du plan de traitement à la suite de la vaECLS. C’est pourquoi la vaECLS est généralement implantée en tant que “bridge-to-decision”, afin de gagner du temps pour déterminer la situation du patient. En plus de l’évaluation des maladies concomitantes et de la situation de vie du patient, il est nécessaire d’évaluer la situation neurologique, en particulier si le vaECLS a été implanté dans des conditions de réanimation. Pour cela, en plus du scanner cérébral et de l’EEG, un test de réveil doit être effectué sur l’ECMO afin de pouvoir évaluer le patient d’un point de vue clinique et neurologique. Une fois les examens complétés, quatre options sont proposées pour la suite du traitement (Fig. 3) :
- Sevrage du patient de la vaECLS si la fonction cardiaque se rétablit.
- Si la fonction cardiaque ne se rétablit pas : Faire passer le patient de la vaECLS à un système d’assistance cardiaque en tant que “bridge-to-transplantation” si le patient est candidat à une transplantation cardiaque, ou en tant que “destination therapy” si le patient n’est pas candidat à une transplantation cardiaque.
- Transplantation cardiaque, si le passage à un système d’assistance cardiaque ne semble pas judicieux, s’il n’existe aucune contre-indication à la transplantation cardiaque et si un cœur de donneur approprié est disponible dans un délai maximal de deux à trois semaines. Pour ce faire, le patient est inscrit en urgence sur la liste d’attente. Si aucun cœur de donneur approprié n’est disponible dans ce délai, le patient se verra implanter un système d’assistance cardiaque, faute de quoi le taux de complications à la vaECLS augmentera.
- Arrêt de la vaECLS avec décès consécutif du patient si la fonction cardiaque du patient ne se rétablit pas et si des contre-indications ne permettent pas l’implantation d’un système d’assistance cardiaque ou une transplantation cardiaque.
Selon les directives actuelles de la Société européenne de cardiologie pour l’insuffisance cardiaque aiguë et chronique de 2016 [3], l’implantation d’un vaECLS peut être envisagée en cas de choc cardiogénique réfractaire en tenant compte de l’âge du patient, des comorbidités et de la fonction neurologique (recommandation IIb, niveau de preuve C).
vvECMO : l’implantation de la vvECMO se fait généralement en urgence et plutôt rarement en urgence. Il existe trois options de traitement après la vvECMO :
- Sevrage de la vvECMO en cas de récupération de la fonction pulmonaire.
- Transplantation pulmonaire, si la fonction pulmonaire ne se rétablit pas et en l’absence de contre-indications.
- Arrêt de la vvECMO suivi du décès du patient si la fonction pulmonaire ne se rétablit pas et si le patient n’est pas candidat à une transplantation pulmonaire.
Mortalité et morbidité
vaECLS : le taux de survie des patients ayant reçu une vaECLS en choc cardiogénique est d’environ 40% jusqu’à leur sortie de l’hôpital. C’est ce qui ressort d’une analyse de 3 846 patients du registre international de l’Extracorporal Life Support Organisation (ELSO) de 2003 à 2013 [4]. Sur la base de leurs résultats, les auteurs ont développé un score de risque, appelé “score SAVE”, qui permet d’estimer le taux de survie des patients à la vaECLS en fonction des facteurs de risque présents. Une méta-analyse de 1199 patients issus de 22 études d’observation menées entre 2000 et 2014 confirme l’analyse du registre ELSO avec un taux de survie des patients vaECLS de 40% jusqu’à leur sortie de l’hôpital [5]. Le taux de survie semble initialement faible, avec environ 40%. Cependant, sans vaECLS, 0% auraient survécu. Le faible taux de survie, malgré le rétablissement d’une circulation suffisante par le vaECLS, est au moins en partie dû aux processus complexes du choc cardiogénique avec développement d’une réaction inflammatoire systémique et d’un syndrome de dysfonctionnement multiorgans. L’établissement d’une perfusion suffisante des organes par la vaECLS ne suffit manifestement pas toujours, à lui seul, à interrompre ces processus.
Les taux de survie à long terme des patients après l’implantation d’un vaECLS sont peu nombreux dans la littérature. Dans la méta-analyse susmentionnée, la survie à 3 ans est estimée à 42,7% [5]. Cela correspond approximativement au taux de survie jusqu’à la sortie de l’hôpital. Ainsi, la mortalité n’est plus que faible une fois que les patients sont sortis de l’hôpital.
Les complications liées à l’ECMO ont généralement un impact négatif sur la survie des patients. Plus de la moitié des patients développent une ou plusieurs complications [5]. Des complications vasculaires peuvent survenir chez 10 à 20 % des patients [5,6]. En fonction du degré d’obstruction des vaisseaux par la canule dans l’AFC, une ischémie des jambes peut se produire. Pour éviter cela, une canule de perfusion distale est aujourd’hui insérée de manière standard dans l’AFS au moment de l’implantation du vaECLS. Des complications hémorragiques surviennent chez 26 à 41% des patients [5,6]. Ils sont favorisés par le trouble de la coagulation intravasculaire disséminée souvent présent dans le choc cardiogénique, la production insuffisante de facteurs de coagulation en cas d’insuffisance hépatique, la thrombocytopénie et l’anticoagulation requise au niveau du vaECLS.
Les complications neurologiques sont des accidents vasculaires cérébraux ischémiques ou hémorragiques chez 6 à 8 % des patients [5,6]. Ils résultent d’une circulation cérébrale insuffisante en cas de choc cardiogénique ou pendant la réanimation avant l’implantation du vaECLS. Le trouble complexe de la coagulation consécutif au choc cardiogénique, qui n’est pas toujours détectable en laboratoire, peut favoriser le développement de ces complications sur la vaECLS. Les complications infectieuses sont fréquentes (25-49%) et comprennent les infections locales au niveau des sites de canulation (17%) ainsi que les infections systémiques, y compris la pneumonie et la septicémie. Les normes de stérilité qui ne peuvent pas toujours être respectées lors de l’implantation d’un vaECLS en urgence, ainsi que le système immunitaire compromis en cas de choc cardiogénique, favorisent le développement d’infections [5–7]. L’insuffisance rénale aiguë résulte d’une diminution de la perfusion en cas de choc cardiogénique et survient chez 47 à 55% des patients [5,6]. Une procédure de remplacement rénal est nécessaire chez 40 à 46% des patients [6,7]. Des scores de risque ont également été développés pour le traitement par vvECMO afin d’évaluer la probabilité de survie, comme par exemple le score PRESERVE ou PRESET [9,10].
vvECMO : plus de 60% des patients qui reçoivent une vvECMO en raison d’une insuffisance pulmonaire réfractaire survivent jusqu’à leur sortie de l’hôpital, comme le montre une méta-analyse récemment publiée portant sur 1042 patients [8]. L’âge du patient et la taille insuffisante de la canule, avec pour conséquence un potentiel d’oxygénation insuffisant, sont des facteurs de risque.
Des complications surviennent dans 40,2% des cas. Les hémorragies sont les plus fréquentes (29,3%). Une hémorragie intracérébrale se produit dans 5,4% des cas. Les saignements au niveau des sites de canulation veineuse ne jouent pas un rôle important (10%), contrairement au risque plus élevé de saignement au niveau des canalisations artérielles dans le cas de la vaECLS. Des infections locales au niveau des sites de canulation se forment chez près de 10% des patients. Mais seulement 7% des complications entraînent la mort.
Transport de patients sous ECMO
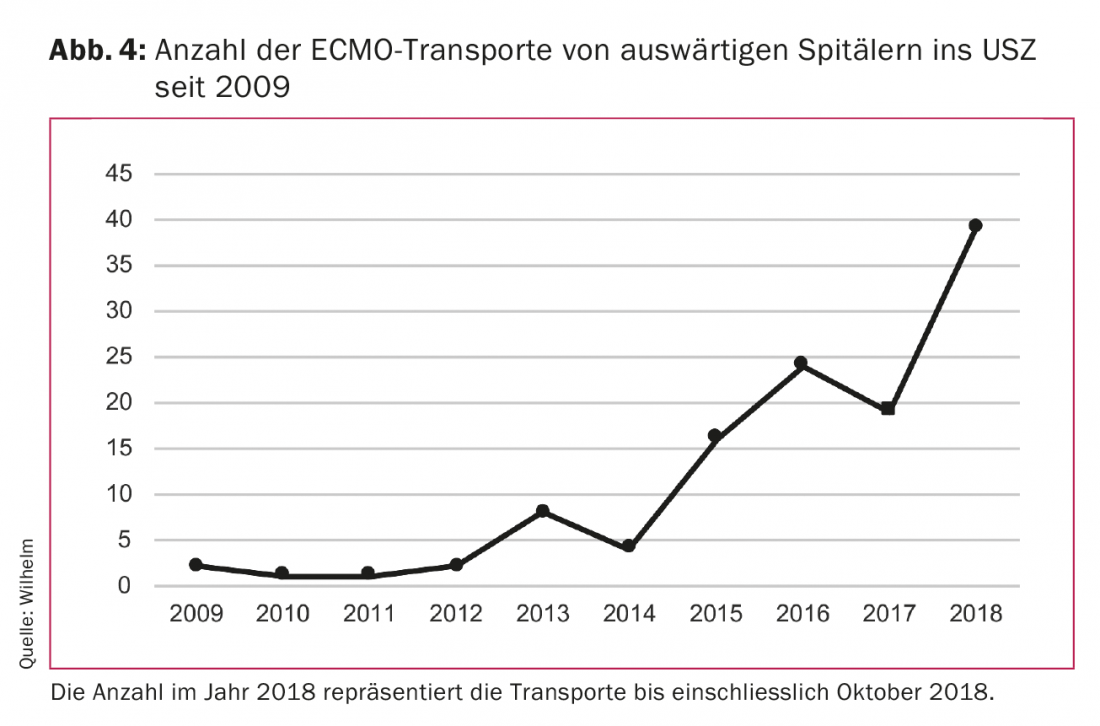
Le développement technique des pompes centrifuges et des oxygénateurs a permis de réduire considérablement la taille des systèmes. De ce fait, ils peuvent aujourd’hui être transportés sans problème en ambulance ou en hélicoptère. Il est ainsi devenu possible de transporter des patients d’un hôpital à l’autre sur la vaECLS ou la vvECMO. Un nouveau concept de traitement a ainsi vu le jour. Les patients hospitalisés à l’extérieur de l’hôpital et souffrant d’une insuffisance pulmonaire aiguë ou d’un choc cardiogénique, qui ne peuvent pas être transportés en raison de leur état critique, peuvent être pris en charge sur place par le vaECLS ou le vvECMO, puis transportés sur ce système vers l’hôpital central pour la suite du traitement. Notre équipe de la clinique de chirurgie cardiovasculaire de l’hôpital universitaire de Zurich (USZ) a pu effectuer de tels transports avec succès, en toute sécurité et sans problèmes techniques, au sol ou par hélicoptère. La demande pour ce type de traitement a considérablement augmenté ces dernières années (Fig. 4). L’équipe, composée d’un chirurgien cardiaque et d’un cardiotechnicien, se rend avec l’équipement à l’hôpital extérieur où elle implante la vaECLS ou la vvECMO. Ensuite, le patient est transporté à l’USZ sur le système. Nos résultats montrent que le taux de survie de ces patients est absolument comparable à celui des patients qui reçoivent la vaECLS ou la vvECMO dans notre hôpital central.
Le défi demeure
L’utilisation de la vaECLS en cas de choc cardiogénique et de la vvECMO en cas de défaillance pulmonaire réfractaire permet de traiter des patients en état critique qui seraient décédés avant que ces traitements ne soient disponibles. Cependant, cette thérapie n’est pas encore aussi efficace que nous le souhaiterions. Cela s’explique par la complexité de ce groupe de patients. Compte tenu des ressources humaines, matérielles et financières nécessaires, l’utilisation de vaECLS ou de vvECMO doit faire l’objet d’un examen critique au cas par cas, d’un point de vue éthique et socio-économique. L’utilisation de scores peut ici aider à évaluer les risques. Les études randomisées et contrôlées qui peuvent aider dans d’autres domaines de la médecine ne sont pas encore disponibles dans ce domaine et ne le seront peut-être jamais.
Messages Take-Home
- L’ECMO veino-veineuse est utilisée en cas d’insuffisance pulmonaire réfractaire.
- L’ECLS veino-artérielle est implantée en cas de choc cardiogénique aigu.
- L’ECMO veino-veineuse et l’ECLS veino-artérielle servent de “décision passerelle”.
- Le taux de survie à la sortie de l’hôpital est de 40% pour la vaECLS et de 60% pour la vvECMO.
- Les patients peuvent être transportés en toute sécurité de l’hôpital extérieur à l’hôpital central à la vaECLS ou à la vvECMO.
Littérature :
- Peek GJ, et al : Efficacité et évaluation économique de l’assistance ventilatoire conventionnelle versus l’oxygénation par membrane extracorporelle pour l’insuffisance respiratoire sévère de l’adulte (CESAR) : un essai contrôlé randomisé multicentrique. Lancet 2009 ; 374(9698) : 1351-1363.
- Thiele H, et al : Intra-aortic balloon counterpulsation in acute myocardial infarction complicated by cardiogenic shock (IABP-SHOCK II) : final 12 month results of a randomised, open-label trial. Lancet 2013 ; 382(9905) : 1638-1645.
- Ponikowski P, et al : 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure : The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016 ; 37(27) : 2129-2200.
- Schmidt M, et al : Predicting survival after ECMO for refractory cardiogenic shock : the survival after veno-arterial-ECMO (SAVE)-score. Eur Heart J 2015 ; 36(33) : 2246-2256.
- Xie A, et al : Venoarterial extracorporeal membrane oxygenation for cardiogenic shock and cardiac arrest : A meta-analysis. J Cardiothorac Vasc Anesth 2015 ; 29(3) : 637-645.
- Cheng R, et al : Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest : a meta-analysis of 1,866 adult patients. Ann Thorac Surg 2014 ; 97(2) : 610-616.
- Bermudez CA, et al : Oxygénation extracorporelle par membrane pour choc réfractaire avancé dans la cardiomyopathie aiguë et chronique. Ann Thorac Surg 2011 ; 92(6) : 2125-2131.
- Vaquer S, et al : Systematic review and meta-analysis of complications and mortality of veno-venous extracorporeal membrane oxygenation for refractory acute respiratory distress syndrome. Ann Intensive Care 2017 ; 7(1) : 51.
- Schmidt M, et al : The PRESERVE mortality risk score and analysis of long-term outcomes after extracorporeal membrane oxygenation for severe acute respiratory distress syndrome. Intensive Care Med 2013 ; 39(10) : 1704-1713.
- Hilder M, et al. : Comparaison des modèles de prédiction de la mortalité dans le syndrome de détresse respiratoire aiguë sous oxygénation par membrane extracorporelle et développement d’un nouveau score de prédiction : le PREdiction of Survival on ECMO Therapy-Score (PRESET-Score). Crit Care 2017 ; 21 : 301.
CARDIOVASC 2018 ; 17(6) : 4-7