Les embolies cardiogéniques sont le plus souvent des thrombus embolisés provenant de l’oreillette gauche en cas de fibrillation auriculaire. La prophylaxie primaire et secondaire des événements cérébraux ischémiques dépend de leur causalité, lorsqu’elle peut être établie, et comprend l’anticoagulation orale ou des mesures correctives telles que la fermeture d’un foramen ovale persistant, d’un défaut du septum auriculaire ou l’exclusion de l’oreillette gauche, afin d’éviter les complications de l’anticoagulation orale qui augmentent à la longue ou un risque embolique élevé en l’absence d’anticoagulation.
L’AVC (infarctus cérébral ou apoplexie), d’origine ischémique à environ 85%, représente la deuxième cause de mortalité après les maladies coronariennes, avec une incidence annuelle d’environ 250 / 100 000 personnes en Europe de l’Ouest et est la première cause de handicap permanent invalidant, avec des conséquences psychosociales et économiques souvent graves. La mortalité reste élevée avec 25% (50% chez les patients de moins de 65 ans) malgré les progrès de la médecine au cours des deux dernières décennies dans le traitement aigu. [1–3]. Plus de 80% des embolies cliniquement apparentes concernent la voie cérébrale, dont 80% dans le territoire antérieur (alimenté par les carotides) et 20% dans le territoire postérieur.
Le cœur en tant que lieu de formation d’un thrombus et donc source d’emboles a été mentionné pour la première fois dans un rapport de cas par Gowers en 1875 [4]. Grâce à des techniques d’imagerie telles que l’échocardiographie transoesophagienne (ETO), la tomodensitométrie avec reconstruction angiographique, l’échographie Doppler et l’imagerie par résonance magnétique, il est possible de documenter une partie des sources d’embolie dans le contexte clinique actuel, ou du moins de les suspecter avec une forte probabilité.
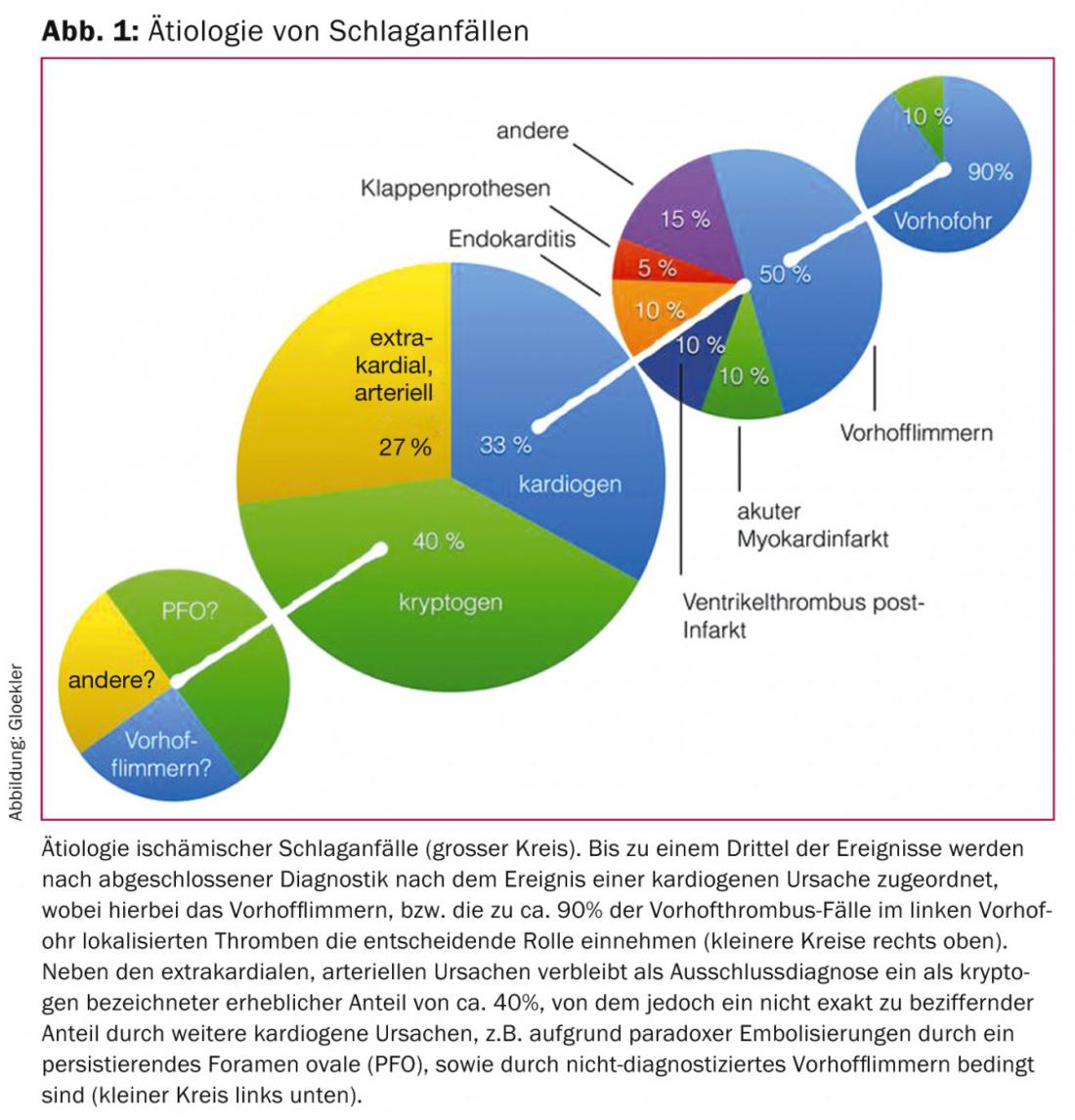
Une proportion sous-estimée de tous les AVC ischémiques (20 à 33%) est qualifiée de cardiogénique-embolique en raison de l’impossibilité fréquente de les détecter directement. Parmi celles-ci, la fibrillation auriculaire (FA) joue le rôle le plus important (figure 1).
Dans la FV, le thrombus se forme dans plus de 90% des cas dans l’oreillette gauche, un résidu aveugle d’une veine pulmonaire primordiale.
Dans environ 40% des cas d’AVC, aucune cause cardiaque ou extracardiaque objectivable n’est trouvée dans la courte fenêtre de traitement diagnostique après un événement. De tels AVC sont donc souvent qualifiés de cryptogéniques (inexpliqués) – cette catégorie est toutefois surestimée. Les AVC cryptogéniques ne sont en principe pas possibles et reflètent nos faiblesses en matière de diagnostic. Par exemple, la présence d’un foramen ovale persistant (PFO) ou d’un défaut du septum auriculaire (ASD) est rarement évaluée et n’est pas reconnue comme une cause conventionnelle d’AVC, même en cas de résultat positif. De même, la FV non détectée est rarement exclue avec la dernière rigueur. Ainsi, le nombre d’AVC d’origine (trans)cardiaque est plus élevé qu’on ne le pense généralement. Si des infarctus cérébraux sont présents dans différents territoires de flux, cela suggère une source d’embolie à distance du cerveau et la FV, le FOP et les veines pulmonaires non évaluables deviennent des sources d’embolie au premier plan.
Il faut espérer que le traitement préventif correctif pourra être amélioré et qu’il sera davantage utilisé.
Fibrillation auriculaire, cause la plus fréquente d’embolie cardiogénique
Environ 20% des AVC ischémiques sont attribués à des embolies cardiogéniques dues à la FV. La FV est l’arythmie la plus fréquente, avec une augmentation continue de la prévalence et de l’incidence (meilleure couverture et augmentation de l’âge moyen de la population) au cours des dernières décennies. Sa prévalence est de plus de 7% chez les femmes et de plus de 10% chez les hommes de plus de 80 ans. [5,6] (Fig. 1).
Dans deux études récemment publiées qui ont surveillé le rythme cardiaque de patients ayant subi un AVC cryptogénique par rapport à un Holter ECG standard, soit à l’aide d’un enregistreur implantable, soit à l’aide d’un enregistreur d’événements de 30 jours (étude CRYSTAL AF [7] et étude EMBRACE [8]), une fibrillation auriculaire paroxystique a été documentée à une fréquence significativement plus élevée chez les patients ayant bénéficié de la méthode d’enregistrement prolongée (12,4 contre 2,0% pendant un an dans CYSTAL AF et trois mois dans EMBRACE). 16,1 contre 3,2% pendant trois mois dans EMBRACE). En conséquence, un nombre significativement plus élevé de patients dans les groupes ayant bénéficié d’une surveillance améliorée ont été protégés contre les AVC récurrents par l’initiation d’un traitement anticoagulant oral (ACO). La FV est sous-diagnostiquée et donc sous-traitée dans le contexte de la recherche de sources pour les AVC ischémiques.
Traitement standard avec anticoagulation permanente
L’anticoagulation orale permanente classique avec des antagonistes de la vitamine K (AVK) ou des agents plus récents de type non antagoniste de la vitamine K (NOAK) réduisent l’incidence des accidents vasculaires cérébraux ischémiques et des décès de deux tiers et d’un quart respectivement et sont efficaces dans la prophylaxie des événements ischémiques [9–13]. Cependant, dans le cas des ACO classiques, il existe une nette sous-utilisation préalable en raison de saignements ou d’un risque accru de saignement (par exemple en cas de risque de chute) [14–16]. Par exemple, jusqu’à 44% des patients atteints de fibrillation auriculaire ne reçoivent pas du tout d’ACO comme protection contre les événements emboliques [17]. Dans une grande étude suédoise issue du registre national des AVC et portant sur plus de 21 077 patients ayant subi un AVC ischémique avec fibrillation auriculaire, les taux d’abandon du traitement par ACO ont été documentés à cinq reprises au cours des deux premières années suivant l’apoplexie : Après deux ans, seuls 45% des patients étaient protégés contre une récidive de l’apoplexie grâce aux ACO, contre 89% initialement. (Fig. 2) [18].
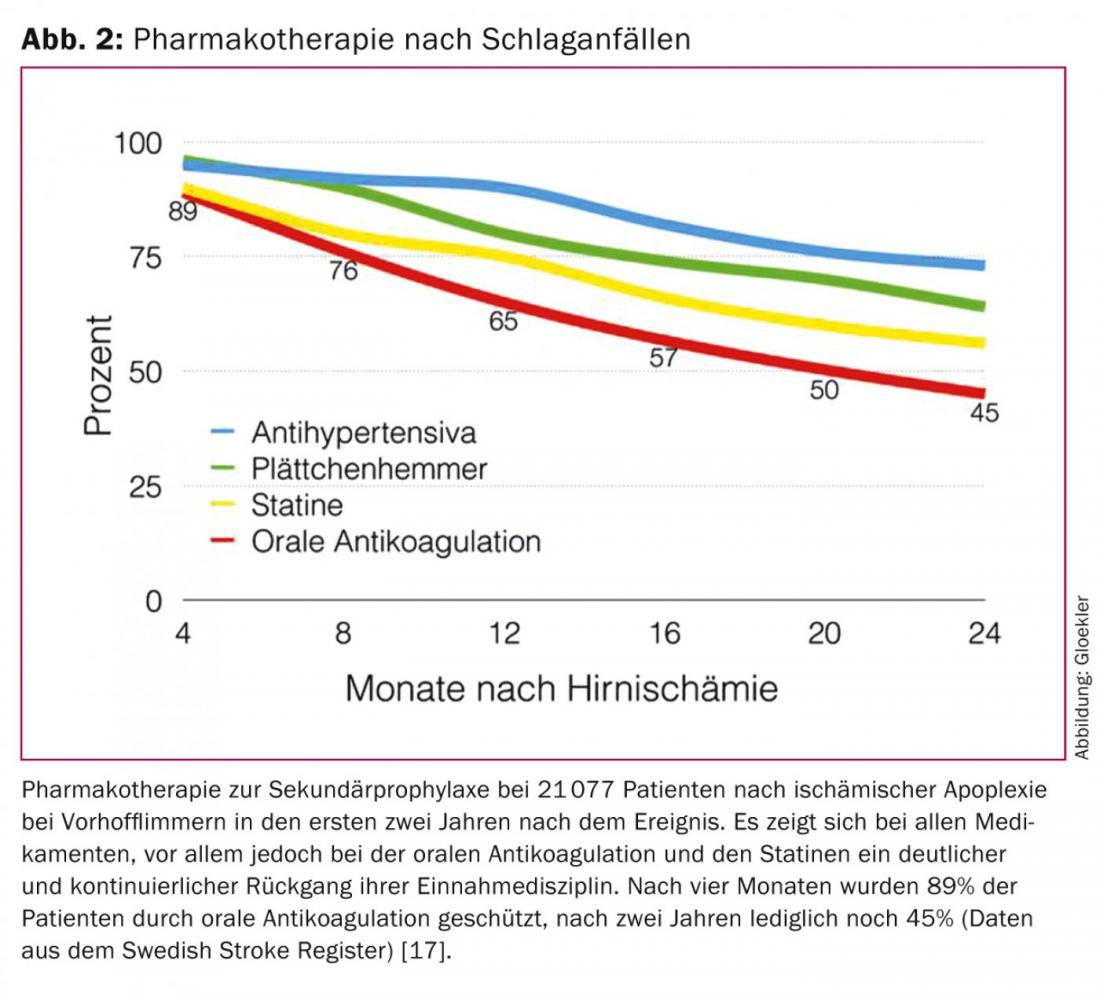
D’autres études et la pratique clinique quotidienne ont également mis en évidence le problème du taux élevé d’abandon du traitement pour les ACO. Une autre limite est que, chez les patients pour lesquels un ACO est poursuivi, l’INR (International Normalized Ratio) se situe dans 30 à 46% des cas en dehors de la plage thérapeutique, ce qui entraîne soit une protection inadéquate contre les embolies (INR <2), soit un risque accru d’hémorragie (INR >3) [13,19]. Si un ACO peut être administré de manière permanente, la protection contre les embolies doit être payée par des taux annuels d’hémorragies significatives qui tendent à augmenter au fil des ans et peuvent atteindre 15% [10–12].
Dans les grandes études d’autorisation des trois NOAK autorisés en Suisse : RE-LY (“Dabigatran Randomised Evaluation of Long-Term Anticoagulation Therapy”) [10]ROCKET AF (“Rivaroxaban Once-daily, oral, direct Factor Xa inhibition Compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation”) et ARISTOTLE (“Apixaban for Reduction In Stroke and Other ThromboemboLic Events in Atrial Fibrillation”), ainsi que l’edoxaban, qui n’est actuellement pas encore autorisé en Suisse : ENGAGE AF-TIMI 48 (“Edoxaban versus Warfarin in Patients with Atrial Fibrillation”), il a été démontré de manière cohérente que les NOAK sont équivalents voire supérieurs aux ACO classiques en termes de prophylaxie des apoplexies. Le risque d’hémorragies intracrâniennes graves et surtout potentiellement mortelles est nettement réduit avec les NOAK par rapport aux ACO classiques, mais le taux d’hémorragies gastro-intestinales est à nouveau légèrement plus élevé [10–13]. Concernant l’utilisation des NOAK, nous vous renvoyons à un article de synthèse récemment publié [20].
Malgré les avantages des NOAK par rapport aux OAK classiques, un taux d’abandon de 17-27% est également documenté dans les différentes études avec les NOAK, ainsi qu’un taux de saignement annuel de 3,1 (RE-LY) à 14,4% (ROCKET AF) en fonction de la classe de risque des différentes populations étudiées. Un autre inconvénient, bien que surestimé, est l’absence jusqu’à présent de moyens fiables pour inverser rapidement l’anticoagulation en cas d’hémorragie mettant la vie en danger.
Ainsi, même avec les NOAK, il est dans la nature des choses qu’un traitement anticoagulant approprié implique toujours un certain taux de saignements pertinents.
Fermeture de l’oreillette gauche comme alternative à la prophylaxie de l’AVC
En raison du fait, déjà bien documenté depuis longtemps par des études pathologiques, chirurgicales et d’imagerie, que plus de 90% de tous les thrombus de la FV proviennent du sac borgne de l’oreillette gauche (OG), ainsi que des risques d’un ACO et d’un AINS systémiques ad infinitum, l’exclusion de l’OG de la circulation sanguine par une occlusion chirurgicale ou par cathétérisme s’impose. [21,22]. La méthode chirurgicale a été publiée pour la première fois par Madden en 1949 [23], mais n’a pas été acceptée par tous en raison de résultats d’exclusion incomplets et du manque d’études comparatives.
L’efficacité et la sécurité du concept d’intervention unique plutôt que d’anticoagulation permanente pour atteindre l’objectif commun d’une prévention efficace des AVC avec peu d’effets secondaires ont été démontrées pour la première fois de manière randomisée dans l’étude PROTECT AF. [24] et est confirmée par l’étude PREVAIL, également randomisée, publiée récemment. [25] a confirmé qu’une fermeture unique de la VHO avec le système WATCHMAN est au moins compétitive par rapport à une OAK permanente à la warfarine. Sur la base de données actuellement non publiées avec une période d’observation prolongée de l’étude PROTECT AF, on peut logiquement supposer une supériorité de la fermeture VHO assistée par cathéter par rapport à l’anticoagulation permanente, car le bénéfice net de la fermeture VHO par rapport à la poursuite de l’anticoagulation augmente avec la durée après l’intervention. De manière intéressante, ce bénéfice net a été démontré de manière plus prononcée chez les patients à haut risque [26]. Pour l’Amplatzer Cardiac Plug, qui, par rapport à la configuration en forme de capuchon du système WATCHMAN, présente un corps occluant la lumière du VHO et un disque scellant l’ostium du VHO, est fabriqué en nitinol et est implanté selon le principe de la tétine, il existe des données similaires issues d’études non randomisées de petite taille (figures 3 et 4) [27–30].
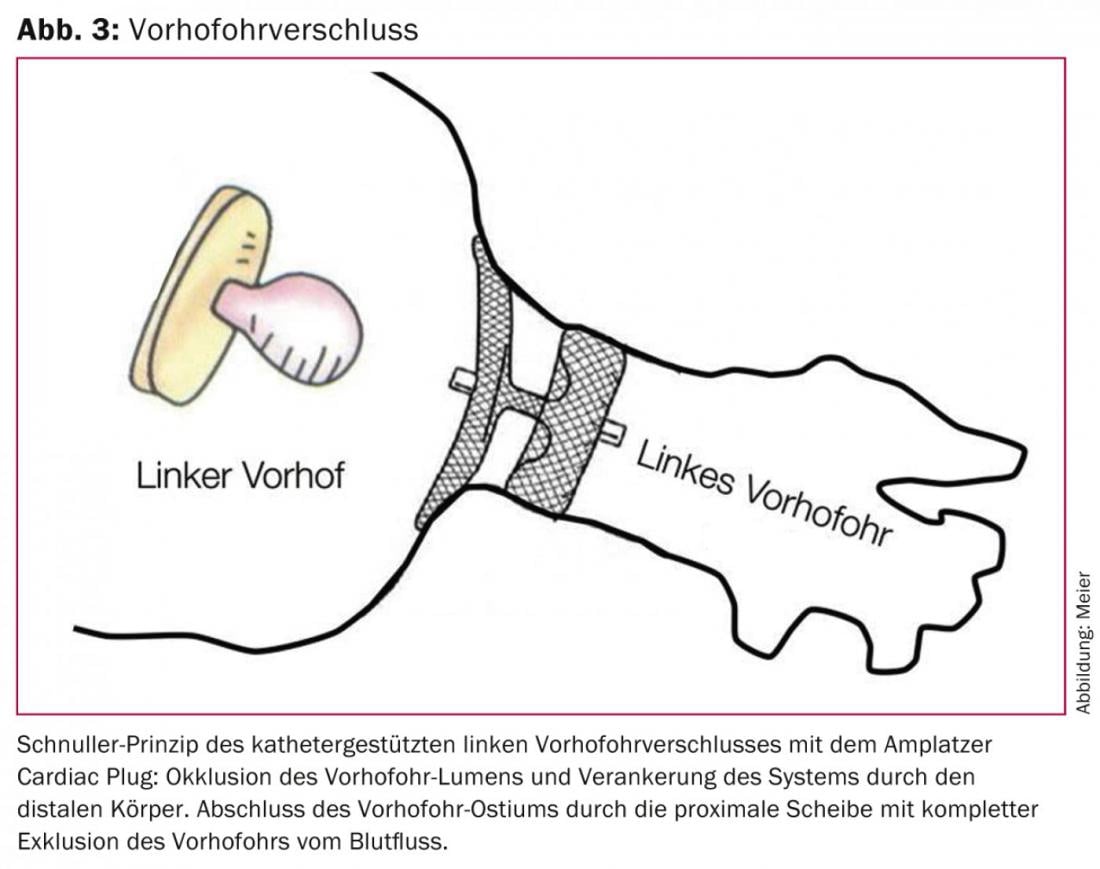
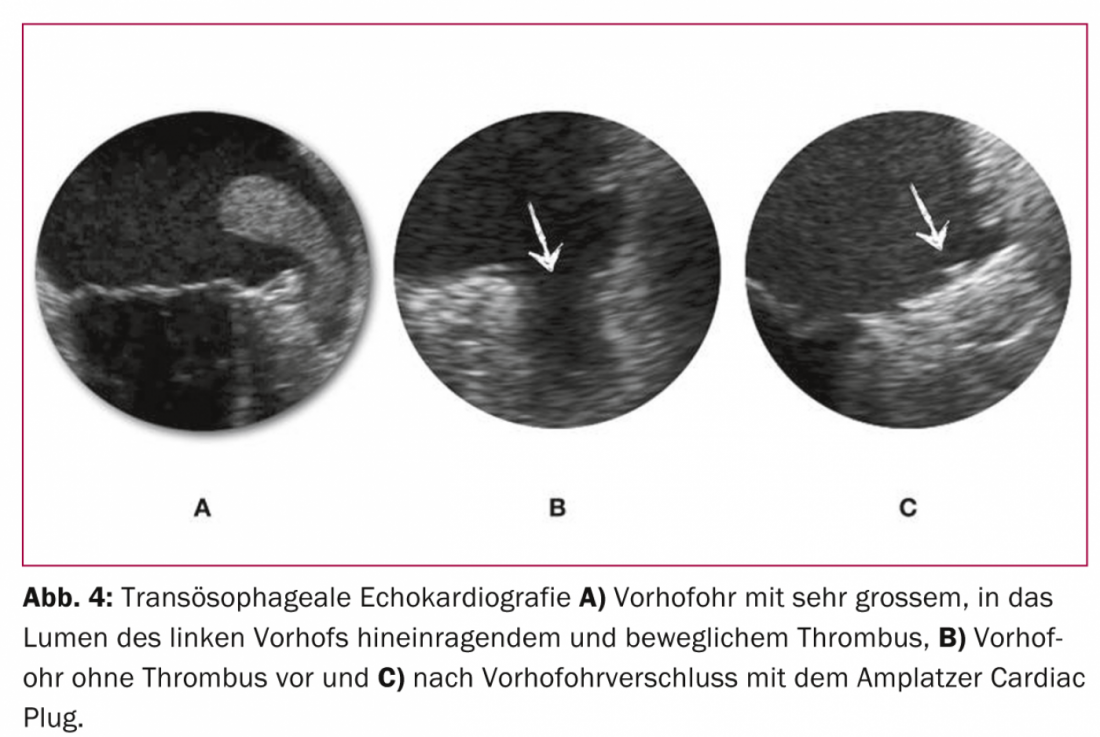
Comme toute intervention, l’occlusion VHO présente un certain taux de complications. Sur plus de 400 patients traités à ce jour dans notre centre avec le système Amplatzer et sans TÖE ou anesthésie générale, le critère de sécurité combiné des complications pertinentes (décès, attaque cérébrale procédurale, tamponnade péricardique ou nécessité d’une révision chirurgicale) est de 8,5%. Ce chiffre doit être comparé à un taux annuel d’hémorragies graves d’environ 4% sous rivaroxaban dans l’étude ROCKET AF [11], qui a examiné des patients présentant un risque comparable d’événements cérébrovasculaires et d’hémorragies. En principe, les taux anticipés des complications périprocédurales uniques de l’occlusion VHO doivent donc être mis en balance avec ceux des complications cumulées des (N)OAK. Avec une espérance de vie résiduelle approximative de trois ans ou plus, on peut donc considérer que la fermeture VHO présente un bénéfice clinique et pronostique net par rapport à une anticoagulation permanente. Ceci est confirmé par les données non encore publiées de l’étude PROTECT AF, qui a démontré pour la première fois une réduction significative de la mortalité globale en faveur de la fermeture VHO.
Sur la base de ces données, la fermeture de la VHO par cathéter constitue une alternative équivalente à moyen terme et supérieure à long terme à l’anticoagulation permanente. Les études comparatives avec les NOAK se feront attendre. En raison de l’efficacité prouvée de l’occlusion VHO et des limites qui subsistent également pour les NOAK, il faut partir du principe que l’occlusion VHO est fondamentalement concurrentielle, voire supérieure, en raison des différences conceptuelles présentées dans la prophylaxie des accidents vasculaires cérébraux.
L’ablation par radiofréquence assistée par cathéter est un traitement valable pour lutter contre les symptômes, mais elle n’est pas curative et permet rarement d’éviter durablement la prophylaxie de l’AVC par (N)OAK ou fermeture VHO assistée par cathéter. Elle correspond donc plus à un complément précieux à la prévention des AVC qu’à une alternative [31].
Embolie paradoxale due à un foramen ovale persistant ou à un défaut du septum auriculaire
Un lien entre les accidents vasculaires cérébraux cryptogéniques et les FOP a été décrit dès 1877 par Julius Conheim et par de nombreux autres par la suite [32]. La recherche d’un FOP fait partie du diagnostic standard après un événement cérébrovasculaire chez tous les patients, et en particulier chez les jeunes patients qui ne souffrent pas encore d’athérosclérose [33]. Par rapport aux TSA, beaucoup plus rares, qui sont de véritables défauts structurels du septum, le FOP est une fente ou un tunnel résiduel dû à une fusion incomplète des deux parties du septum interauriculaire dans la période postnatale. Suite à la publication des trois études randomisées CLOSURE I (“Evaluation of the STARFlex Septal Closure System in Patients with a Stroke and/or Transient Ischemic Attack due to Presumed Paradoxycal Embolism through
a Brevet Foramen Ovale”) [34], PC (“Essai clinique comparant la fermeture percutanée du foramen ovale patient à l’aide de l’occludeur de FOP d’Amplatz avec traitement médical chez les patients atteints d’embolie cryptogénique”) [35] et RESPECT (“Évaluation randomisée des AVC récurrents comparant la fermeture du PFO au traitement standard actuel établi”) [36]Les résultats de l’étude de l’OMS sur la prévention des accidents vasculaires cérébraux (AVC), qui a comparé un traitement médicamenteux antiplaquettaire ou un ACO avec une occlusion par cathéter à l’aide de différents systèmes pour la prévention secondaire des AVC, restent controversés en raison des limites inhérentes à chaque étude, telles que le type de système d’occlusion, le nombre de patients et la durée de la période d’observation. Ces études n’ont pas démontré de supériorité significative de la fermeture du FOP par rapport au traitement médicamenteux [34–38]. Cependant, au moins dans les sous-groupes présentant des shunts importants, des anévrismes septuaires ou la coïncidence de structures telles qu’une valvule d’Eustache ou des réseaux de Chiari, on peut supposer que la fermeture du FOP est supérieure au traitement médicamenteux. En ce qui concerne la sécurité de la procédure, le système Amplatzer est supérieur au système Starflex, qui a été testé dans l’étude CLOSURE I [39]. En raison du faible nombre d’événements dans les trois études randomisées, elles n’ont pas la puissance statistique supposée lors de leur conception : par exemple, dans l’étude CLOSURE I, sur 909 patients suivis pendant deux ans, 5,5 contre 6,8% (p=0,37) ont atteint le critère d’évaluation combiné de l’AVC, de l’accident ischémique transitoire (AIT) et de l’embolie systémique, et 2,9 contre 3,1% (p=0,79) le critère de l’AVC seul. [34]. Dans l’étude PC, une autre étude prospective et randomisée portant sur 414 patients, qui, comme l’étude RESPECT, a examiné la fermeture du FOP avec les systèmes Amplatzer (Fig. 5) avec un traitement médicamenteux sur une période de suivi de deux à quatre ans, 3,4 (n=7) contre 5,2% (n=11) ont atteint le critère combiné de décès, d’AVC, d’AIT ou d’embolie systémique (p=0,34). [35]. Dans l’étude RESPECT, 980 patients ont été randomisés et suivis pendant 2,5 ans : Neuf patients dans le groupe obstruction contre 16 patients dans le groupe médicament ont subi un événement cérébrovasculaire (p=0,08) pendant cette période [36]. Ces deux études feront l’objet d’une collecte de données supplémentaire et il est probable qu’avec une période de suivi prolongée, la tendance actuelle en faveur de la fermeture du FOP avec le système Amplatzer se transformera en une différence significative.
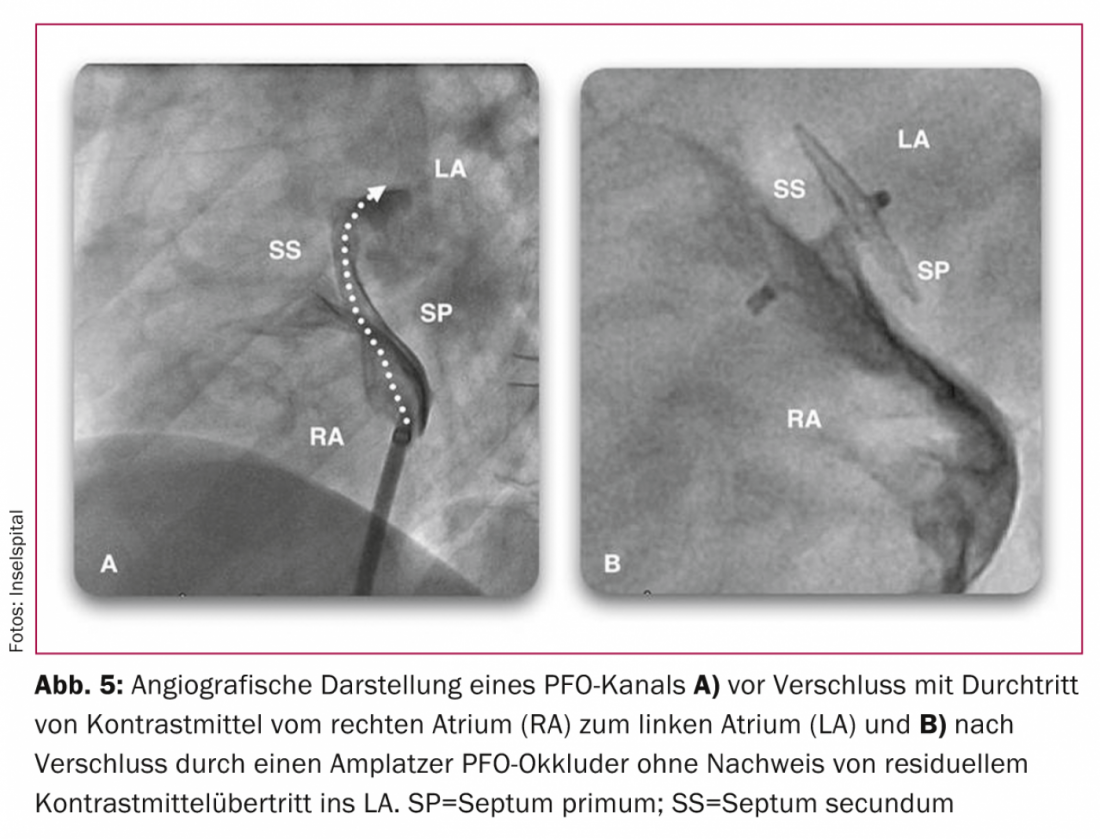
Conformément aux résultats attendus de la prochaine collecte de données des études PC et RESPECT, une étude d’observation à long terme comparant les deux groupes par “propensity matching” avec une durée moyenne d’observation de neuf ans chez 308 patients a montré que la fermeture du FOP était supérieure au traitement médicamenteux en termes d’atteinte du critère d’évaluation combiné (11 contre 21%, p=0,033). Un avantage de survie significatif de la fermeture du PFO a même été démontré en comparant les années d’observation avec ou sans fermeture du PFO [40]. Une méta-analyse a montré une réduction de 84 pour cent du risque d’événements neurologiques récurrents (un événement contre cinq pour 100 années-patients) et une différence significative en faveur de la fermeture du FOP chez les patients âgés et ceux présentant un anévrisme du septum auriculaire ou une thrombophilie [41].
En raison du nombre relativement faible de cas avec une durée de suivi encore insuffisante, du faible nombre d’événements neurologiques et de la qualité variable des systèmes de fermeture, les trois grandes études mentionnées ne montrent pas encore individuellement une supériorité significative claire de la fermeture du FOP par rapport à un traitement purement médicamenteux, mais une tendance solide dans cette direction. On peut donc s’attendre à ce qu’à moyen terme, les preuves issues de la prolongation de la durée d’observation des études actuelles, les méta-analyses ou de nouvelles études plus significatives démontrent la supériorité de la fermeture du PFO dans la prévention secondaire des événements cérébrovasculaires ischémiques. La fermeture du PFO, techniquement simple à réaliser, avec un excellent taux de réussite de près de 100% et pratiquement aucune complication, devrait, compte tenu des conséquences potentiellement catastrophiques de tout événement cérébrovasculaire, être mise à la disposition de tous les patients en prévention secondaire, au sens d’une vaccination mécanique, sur la base de l’ensemble des données actuelles, en particulier pour les patients plus jeunes présentant un anévrisme du septum ou des shunts plus importants. Outre certains effets secondaires utiles comme la réduction des migraines, de l’apnée du sommeil ou encore des infarctus du myocarde par occlusion coronaire paradoxale-embolique, il permet d’éviter une anticoagulation à vie associée à des risques élevés cumulatifs. Pour éviter un accident vasculaire cérébral sur une période de 20 ans, il suffit d’effectuer neuf fermetures de PFO.
Autres sources d’embolie cardiogénique
Outre la fibrillation auriculaire et le FOP, les thrombus cardiaques sont des causes rares d’apoplexie en cas d’infarctus aigu du myocarde ou de séquelles d’infarctus transmural, d’embolies en cas de sténose de la valve mitrale, de syndrome de Sick-Sinus, de myxomes auriculaires, ainsi que de dépôts thrombotiques sur des prothèses valvulaires mécaniques ou biologiques ou d’embolisations septiques en cas d’endocardite (figure 1).
En fonction de la gravité des résultats, la première étape du traitement consiste à commencer un traitement anticoagulant oral, suivi d’examens d’imagerie de contrôle. En second lieu, en l’absence de dissolution des thrombus, en présence de caillots flottants, de tumeurs ou d’endocardites florides, une ablation chirurgicale doit être envisagée.
L’ensemble du lit veineux pulmonaire constitue une source potentielle non visible d’accidents cérébraux emboliques. Il devrait faire l’objet d’un plus grand nombre d’études cliniques.
PD Dr. med. Steffen Gloekler
Conflits d’intérêts potentiels : Bernhard Meier a reçu un soutien institutionnel à la recherche et des honoraires de conférence de St. Jude Medical.
Littérature :
- Go AS, et al. (American Heart Association Statistics Committee and Stroke Statistics Subcommittee) : Heart disease and stroke statistics – 2014 update : a report from the American Heart Association. Circulation 2014 ; 129 : e28-e292.
- Lozano R, et al : Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010 : a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012 ; 380 : 2095-2128.
- Feigin VL, et al. (Étude 2010 sur la charge mondiale de morbidité, les blessures et les facteurs de risque [GBD 2010] et le GBD Stroke Experts Group) : Global and regional burden of stroke during 1990-2010 : findings from the Global Burden of Disease Study 2010. Lancet 2014 ; 383 : 245-254.
- Gowers W : Sur un cas d’embolie simultanée des artères rétiniennes centrales et cérébrales moyennes. Lancet 1875 ; 2 : 794.
- Miyasaka Y, et al : Mortality trends in patients diagnosed with first atrial fibrillation : a 21-year community-based study. J Am Coll Cardiol 2007 ; 49 : 986-992.
- Go S : Prevalence of diagnosed atrial fibrillation in adults : national implications for rhythm management and stroke prevention : the AnTicoagulation and Risk Factors In Atrial Fibrillation (ATRIA) Study. J Am Med Assoc 2001 ; 285 : 2370-2375.
- Gladstone DJ, et al. (EMBRACE Investigators and Coordinators) : Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med 2014 ; 370 : 2467-2477.
- Sanna T, et al. (CRYSTAL AF Investigators) : Cryptogenic stroke and underlying atrial fibrillation. N Engl J Med 2014 ; 370 : 2478-2486.
- Hart RG, Pearce LA, Aguilar MI : Meta-analysis : antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007 ; 146 : 857-867.
- Connolly SJ, et al. (Comité directeur et investigateurs du RE-LY) : Dabigatran versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2009 ; 361 : 1139-1151.
- Patel MR, et al. (ROCKET AF Investigators) : Rivaroxaban versus warfarine dans la fibrillation auriculaire non valvulaire. N Engl J Med 2011 ; 365 : 883-891.
- Granger CB, et al. (Comités et Investigateurs ARISTOTLE) : Apixaban versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2011 ; 365 : 981-992.
- Giugliano RP, et al. (ENGAGE AF-TIMI 48 Investigators) : Edoxaban versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2013 ; 369 : 2093-2104.
- Casciano JP, et al : The costs of warfarin underuse and nonadherence in patients with atrial fibrillation : a commercial insurer perspective. J Manag Care Pharm 2013 ; 19 : 302-316.
- Gladstone DJ, et al. : Les accidents vasculaires cérébraux potentiellement évitables chez les patients à haut risque atteints de fibrillation auriculaire et qui ne sont pas suffisamment anticoagulés. Accident vasculaire cérébral 2009 ; 40 : 235-240.
- Wrigley BJ, Lip GY : Can the WATCHMAN device truly PROTECT from stroke in atrial fibrillation ? Lancet Neurol 2009 ; 8 : 877-878.
- Waldo AL, et al. (Comité directeur NABOR) : Les patients hospitalisés souffrant de fibrillation auriculaire et présentant un risque élevé d’accident vasculaire cérébral ne reçoivent pas d’anticoagulant adéquat. J Am Coll Cardiol 2005 ; 46 : 1729-1736.
- Glader EL, et al : L’utilisation persistante de médicaments préventifs secondaires diminue rapidement au cours des 2 premières années après l’accident vasculaire cérébral. Accident vasculaire cérébral 2010 ; 41 : 397-401.
- Onalan O, et al : Nonpharmacologic stroke prevention in atrial fibrillation. Expert Rev Cardiovasc Ther 2005 ; 3 : 619-633.
- Steffel J : Nouveaux anticoagulants oraux – 10 questions tirées de l’utilisation quotidienne. Cardiovasc 2014 ; 13 : 12-16.
- Blackshear JL, Odell JA : L’oblitération d’appendice pour réduire les accidents vasculaires cérébraux chez les patients en chirurgie cardiaque atteints de fibrillation auriculaire. Ann Thorac Surg 1996 ; 61 : 755-759.
- Di Biase L, et al : La morphologie de l’appendice auriculaire gauche est-elle en corrélation avec le risque d’accident vasculaire cérébral chez les patients atteints de fibrillation auriculaire ? Résultats d’une étude multicentrique. J Am Coll Cardiol 2012 ; 60 : 531-538.
- Madden JL : Resection of the left auricular appendix ; a prophylaxis for recurrent arterial emboli. J Am Med Assoc 1949 ; 140 : 769-772.
- Holmes DR, et al. (Investigateurs PROTECT AF) : Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation : a randomised non-inferiority trial. Lancet 2009 ; 374 : 534-542.
- Holmes DR, et al : Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure Device in Patients With Atrial Fibrillation Versus Long-Term Warfarin Therapy. J Am Coll Cardiol 2014 ; 64 : 1-12.
- Gangireddy SR, et al : Fermeture percutanée de l’appendice auriculaire gauche pour la prévention des accidents vasculaires cérébraux chez les patients atteints de fibrillation auriculaire : une évaluation du bénéfice clinique net. Eur Heart J 2012 ; 33 : 2700-2708.
- Park JW, et al. : Fermeture de l’appendice auriculaire gauche avec le Cardiac Plug d’Amplatzer dans la fibrillation auriculaire : expérience initiale européenne. Catheter Cardiovasc Interv 2011 ; 77 : 700-706.
- Nietlispach F, et al : Amplatzer left atrial appendage occlusion : Single center 10-year experience. Catheter Cardiovasc Interv 2013 ; 82 : 283-289.
- Nietlispach F, et al : Fermeture percutanée de l’appendice auriculaire gauche. Europ Geriat Med 2012 ; 3 : 308-311.
- Nietlispach F, et al : Fermeture percutanée ad hoc de l’appendice auriculaire gauche. J Invasive Cardiol 2013 ; 25 : 683-686.
- Calkins H, et al. : 2012 HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation : recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace 2012 ; 14 : 528-606.
- Lechat P, et al : Prevalence of patent foramen ovale in patients with stroke. N Engl J Med 1988 ; 318 : 1148-1152.
- Meier B, et al : Prévention secondaire des accidents vasculaires cérébraux : foramen ovale patenté, plaque aortique, et sténose carotidienne. Eur Heart J 2012 ; 33 : 705-713, 713a, 713b.
- Furlan AJ, et al. (CLOSURE I Investigators) : Closure or medical therapy for cryptogenic stroke with patent foramen ovale. N Engl J Med 2012 ; 366 : 991-999.
- Meier B, et al. (Investigateurs de l’essai PC) : Fermeture percutanée du foramen ovale patenté dans l’embolie cryptogénique. N Engl J Med 2013 ; 368 : 1083-1091.
- Carroll JD, et al. (Investigateurs RESPECT) : Closure of patent foramen ovale versus medical therapy after cryptogenic stroke. N Engl J Med 2013 ; 368 : 1092-1100.
- Spencer FA, et al : Systematic review of percutaneous closure versus medical therapy in patients with cryptogenic stroke and patent foramen ovale. BMJ Open 2014 ; 4 : e004282.
- Meier B : Le foramen ovale breveté, est-il plus dangereux de le fermer que de le laisser ouvert ? Cardiovasc Med 2012 ; 15 : 183-185.
- Messé SR, Kent DM : Toujours pas de conclusion sur la question de la fermeture du PFO. N Engl J Med 2013 ; 368 : 1152-1153.
- Wahl A, et al : Comparaison du score de propension à long terme de la fermeture percutanée du foramen ovale patenté avec le traitement médical après embolie paradoxale. Circulation 2012 ; 125 : 803-812.
- Agarwal S, et al : Meta-analysis of transcatheter closure versus medical therapy for patent foramen ovale in prevention of recurrent neurological events after presumed paradoxical embolism. JACC Cardiovasc Interv 2012 ; 5 : 777-789.
CARDIOVASC 2014 ; 13(4) : 3-8