Maladie pulmonaire chronique la plus fréquente chez les nourrissons, la dysplasie broncho-pulmonaire (DBP) est associée à des conséquences à long terme qui se prolongent à l’âge adulte. Malgré des améliorations significatives dans les soins périnataux, l’incidence de la DBP est restée inchangée ou a même augmenté chez les nourrissons particulièrement immatures. La différence d’incidence de la DBP dans les différents centres périnataux reflète à la fois les différences dans la population de patients et dans les méthodes de traitement.
Maladie pulmonaire chronique la plus fréquente chez les nourrissons, la dysplasie broncho-pulmonaire (DBP) est associée à des conséquences à long terme qui se prolongent à l’âge adulte [1,2]. Malgré des améliorations significatives dans les soins périnataux, comme le traitement prénatal par stéroïdes pour obtenir un “retard” de maturation des poumons, le traitement par surfactant et le développement de stratégies de ventilation adaptées, l’incidence de la DBP chez les nourrissons particulièrement immatures est restée inchangée ou a même augmenté [3]. Cela est probablement dû à une réduction significative des taux de mortalité, associée à une augmentation du nombre total de nourrissons traités nés nettement trop tôt. La différence d’incidence de la DBP dans les différents centres périnataux reflète à la fois les différences dans la population de patients et dans les méthodes de traitement [4–7]. Des publications font état d’une incidence de l’IOP allant jusqu’à 68% chez les nourrissons de très faible poids de naissance (401-1500 g) et d’un âge gestationnel inférieur à 29 semaines de grossesse, ou jusqu’à 77% chez les nourrissons nés à moins de 32 semaines de grossesse ou d’un poids de naissance inférieur à 1 kg [5,8,9]. Ces chiffres proviennent principalement de pays ayant un produit intérieur brut élevé. Avec environ 15 millions d’enfants nés prématurément chaque année dans le monde, les chiffres ci-dessus démontrent l’importance du défi clinique et socio-économique [10].
La pneumopathie chronique du nouveau-né est classée en trois niveaux de gravité dans la définition de Jobe et Bancalari : légère (supplémentation en oxygène pendant au moins 28 jours postnataux), modérée (supplémentation en oxygène <30% à l’âge postmenstruel de 36 semaines) et sévère (supplémentation en oxygène de 30% et/ou assistance respiratoire à l’âge postmenstruel de 36 semaines) [1].
De grandes études cliniques ont identifié de nombreux facteurs de risque pour le développement de la DBP, notamment les infections congénitales et nosocomiales, la ventilation mécanique et la toxicité de l’oxygène [11–16]. L’influence de ces défis pré- et postnataux est en outre déterminée par la présence d’une carence calorique ou d’un apport insuffisant en vitamines et en oligo-éléments, ainsi que par une sécrétion insuffisante d’hormones surrénaliennes et thyroïdiennes, qui augmentent encore le risque de développer une morbidité pulmonaire [17–19]. La vulnérabilité des poumons en développement au développement de lésions chroniques est également multipliée par 3 à 4 en présence d’un retard de croissance intra-utérin [20–24], le développement alvéolaire et vasculaire étant affecté de manière décisive par l’altération sous-jacente de la transduction du signal [25]. L’exposition à la fumée de cigarette prénatale – largement sous-estimée sur le plan clinique en raison du manque d’informations anamnestiques et de marqueurs cliniques – a également été démontrée comme contribuant de manière significative au développement de la maladie, peut-être même au-delà d’un impact sur la croissance somatique [26,27].
Le rôle des thérapies établies doit également être constamment réévalué en vue d’une éventuelle contribution au développement de complications chroniques. Les effets du traitement par stéroïdes et de l’antibiothérapie maternelle sont discutés ci-dessous dans ce contexte.
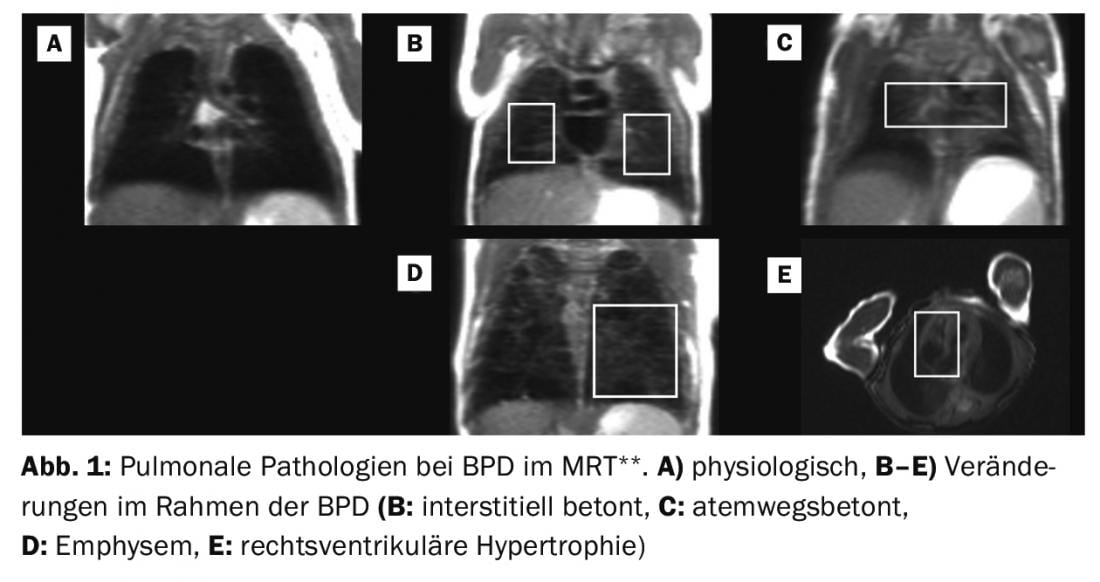
** Adapté de : MRI based scoring of the diseased lung in the preterm infant with BPD. Kai Förster, Hannah Busen, Sophia Stöcklein, Olaf Dietrich, Harald Ehrhardt, Mark O. Wielpütz, Andreas W. Flemmer, Benjamin Schubert, Marcus A. Mall, Birgit Ertl-Wagner, Anne Hilgendorff. Ce manuscrit est en cours de soumission à Thorax.
Enfin, la discussion sur l’importance des différents facteurs de risque doit être menée dans le contexte de nos connaissances actuelles, en constante évolution, sur l’importance des polymorphismes génétiques, et des études indiquent que jusqu’à 53% de la variance de la DBP peut être due à ces facteurs [28]. Parmi les anomalies génétiques identifiées figurent des mutations dans des gènes liés à la synthèse du surfactant, à la réponse immunitaire innée [29,30] et à la superoxyde dismutase [31]. Le risque plus élevé de développer une DBP et une hypertension artérielle pulmonaire (HTAP) chez les prématurés de sexe masculin [32] a été associé à des différences dans la régulation hormonale [33]. En revanche, dans l’évolution ultérieure, les femmes ayant des antécédents de DBP sont plus touchées à long terme [34].
Il est difficile d’identifier les facteurs de risque génétiques pertinents sur le plan clinique, que ce soit pour différencier les facteurs influençant le risque d’accouchement prématuré en soi [35] ou pour considérer les complications aiguës [36] et chroniques les unes par rapport aux autres. Le fait que les grandes études d’association génétique [37] n’aient pas encore pu suivre les succès obtenus dans d’autres domaines de la maladie, tels que la mucoviscidose [38] ou l’HTAP [39,40], dans le sens de résultats novateurs ayant une pertinence clinique, peut également être une indication de l’hétérogénéité du diagnostic de la DBP, en plus des raisons mentionnées. A l’avenir, l’identification des (sous-)entités pathologiques sous-jacentes pourrait permettre d’attribuer plus clairement certains facteurs de risque et polymorphismes génétiques. De même, la connaissance des sites clés de la transduction du signal qui contrôlent l’interaction entre les différentes populations de cellules pulmonaires permettra de classer les gènes candidats. Les sections suivantes abordent différents aspects à cet égard.
De la cause à la conséquence : inflammation et réponse au stress oxydatif
Les influences exogènes décrites, qui agissent en pré- et postnatal sur un poumon structurellement et fonctionnellement immature, entraînent une réaction inflammatoire persistante, le remodelage de la matrice extracellulaire (MEC) ainsi que des modifications fibrotiques diffuses, y compris une hypertrophie des muscles lisses dans les petites artères pulmonaires et les voies respiratoires [41]. Des modifications histopathologiques caractéristiques avec l’image d’une alvéolarisation et d’une vasculogenèse perturbées [1] résulte l’hypoventilation alvéolaire, qui s’exprime par le tableau clinique d’une hypercapnie et d’une hypoxémie et le déséquilibre ventilation-perfusion [42].
Les processus inflammatoires aigus et chroniques qui caractérisent la DBP sont causés à la fois par des mécanismes pré- et postnataux. Les infections et la capacité correspondante à générer une réponse immunitaire compétente jouent un rôle important dans le développement de la BPD [13,43–45]. Les processus inflammatoires prénataux, résumés par exemple par le terme “syndrome de réponse inflammatoire fœtale (SRIF)” ou survenant dans le cadre d’événements infectieux manifestes comme la chorioamniotite prénatale ou postnatale dans le contexte d’infections congénitales et nosocomiales, entraînent un afflux de granulocytes neutrophiles dans les poumons immatures. Il s’ensuit la présence d’un nombre accru de monocytes et de macrophages dans le cadre de ce que l’on appelle la “deuxième vague” de la réponse immunitaire [24,46,47]. Le rôle de l’immunité innée revêt ici une importance particulière, car l’immunité adaptative peut également être variable en fonction de l’âge gestationnel [48]. Les études animales indiquent que le remodelage de la matrice extracellulaire et le dysfonctionnement épithélial alvéolaire précoce ne sont pas seulement une conséquence de la réaction inflammatoire, mais qu’ils continuent à la favoriser [49,50], entraînant ainsi des modifications durables de la fonction immunitaire pulmonaire. En prénatal, l’utilisation généralisée des traitements antibiotiques maternels entraîne une modification durable de la flore bactérienne de l’enfant [51] et de la fonction immunitaire de la descendance dans le modèle murin [52].
En postnatal, l’induction de lésions par barotraumatisme et volutraumatisme dans le cadre de la ventilation mécanique et les conséquences d’une hyperoxie modérée ou sévère sont des facteurs de risque importants pour l’initiation et le maintien des processus inflammatoires soulignés ci-dessus au niveau local et même systémique [53–56]. La libération de cytokines telles que le facteur de croissance transformant (transforming growth factor, TGF)-β, le facteur de nécrose tumorale (tumor necrosis factor, TNF)-alpha et les interleukines, par exemple IL-1beta, contribue de manière significative au déséquilibre de la transduction du signal de différents (autres) facteurs de croissance et conduit à l’activation de facteurs de transcription qui favorisent l’apoptose dans différentes cellules [57–59]. Le débat sur le rôle des cellules inflammatoires recrutées et résidentes [60–64] fournira des informations importantes sur les relations mécanistiques et pour l’identification des options thérapeutiques. Mais dans ce contexte, l’influence supposée des cellules inflammatoires sur le développement des poumons suscitera également de nouvelles pistes de recherche [65].
Les processus inflammatoires aigus et chroniques doivent être considérés dans le contexte de la capacité cellulaire à répondre aux défis postnataux persistants ou récurrents. Ici, le manque relatif d’antioxydants et d’inhibiteurs d’enzymes protéolytiques rend les poumons immatures particulièrement vulnérables aux effets des métabolites toxiques de l’oxygène et des protéases libérées par la matrice extracellulaire et les granulocytes neutrophiles et les macrophages résidents ou recrutés [66-69]. Plusieurs études ont démontré des preuves d’un stress oxydatif accru chez le prématuré. Par exemple, les concentrations urinaires de malondialdéhyde sont élevées au cours de la première semaine de vie. Ces concentrations sont dues à la peroxydation des membranes lipidiques après des lésions à médiation oxydative, pour lesquelles une corrélation a été démontrée avec le risque de maladies radicalaires de l’oxygène, y compris la DBP [70]. Des concentrations réduites d’antioxydants pulmonaires ont été mesurées dans le lavage de bébés prématurés [71], et d’autres études indiquent que les jeunes patients atteints de DBP sont caractérisés par des signes d’augmentation du stress oxydatif dans les voies respiratoires, un signe de changements à long terme dans le système respiratoire après une naissance prématurée [72]. Les thérapies établies doivent également faire l’objet d’un examen critique quant à leur rôle dans le développement pulmonaire à la lumière des nouvelles connaissances, car, par exemple, l’administration prénatale de bétaméthasone, bien que largement utilisée pour favoriser la maturation des poumons et prévenir la détresse respiratoire tout en réduisant les taux de DBP [73,74] ont démontré qu’ils augmentaient les indicateurs de peroxydation des membranes lipidiques [70].
Ces modifications à long terme de la réponse au stress oxydatif et d’autres processus se reflètent dans les modifications des réactions aux infections virales plus tard dans la vie [75]. La réponse du poumon en développement aux dommages précoces, y compris les conséquences à long terme, est spécifique et différente de la réponse de l’organisme adulte. Alors que l’exposition chronique à l’oxygène (60% pendant 14 jours) dans le poumon du rat néonatal augmente la contraction des vaisseaux pulmonaires et des muscles lisses des voies respiratoires et réduit la relaxation de l’oxyde nitrique, le phénomène inverse se produit lors du traitement des animaux adultes [76]. Les effets à long terme après une exposition à l’hyperoxie pendant la première semaine de vie (100% pendant 4 jours) comprennent principalement des complications cardiovasculaires, dans lesquelles une charge ventriculaire droite s’est développée dans l’HTAP à la suite d’une maladie vasculaire pulmonaire et, par conséquent, une augmentation de la mortalité dans le modèle animal [77]. L’altération de la transduction du signal par la protéine morphogénique osseuse (BMP) offre une explication pathomécanique. D’autres mécanismes expliquant la susceptibilité accrue aux lésions aiguës et à long terme dans les poumons du nouveau-né sont démontrés par une autre étude sur les effets induits par l’hyperoxie. Chez la souris néonatale, contrairement à l’animal adulte, les cellules précurseurs circulantes et endothéliales pulmonaires issues de la moelle osseuse sont ici nettement réduites [78], ce qui peut aboutir à un épuisement précoce des capacités de réparation et de régénération. L’influence d’autres processus centraux, tels que ceux de la régulation du cycle cellulaire avec une régulation élevée de P21 après hyperoxie et une activité réduite de l’histone désacétylase [79], ainsi que les effets sur la méthylation de l’ADN [80], indiquent également l’apparition précoce d’effets cumulatifs à long terme dans le contexte de mécanismes de compensation réduits dans le poumon immature.
Caractéristiques histopathologiques – horloge et fonction de mémoire
L’interaction des compartiments cellulaires épithélial, mésenchymateux et endothélial dans leur interaction pour le développement de la zone d’échange gazeux est essentiellement orchestrée par la régulation de différents facteurs de croissance. Il s’agit notamment de Notch et Wingless Int-1 (Wnt), du facteur de croissance dérivé des fibroblastes et des plaquettes (FGF et PDGF), ainsi que du BMP et du facteur de croissance endothélial vasculaire (VEGF) [81–87]. L’interférence précoce avec ces facteurs de transcription perturbe la morphogenèse normale du poumon [88] qui aboutit à un manque de différenciation des structures alvéolaires [89]. De même, la régulation de facteurs de transcription centraux tels que le facteur nucléaire kappa B (NF-kB) joue un rôle et contribue au mauvais développement de la surface d’échange des gaz [88,90,91]. L’association caractéristique d’une alvéolarisation perturbée et de la présence de capillaires dysmorphiques est due à une altération de l’expression des facteurs de croissance angiogéniques, dont une expression pulmonaire réduite du facteur de croissance endothélial vasculaire (VEGF) et des récepteurs du VEGF. [92–94] ainsi qu’une diminution de l’oxyde nitrique synthase endothéliale (eNOS) et de la guanylate cyclase soluble (sGC) dans les vaisseaux sanguins pulmonaires et les voies respiratoires. [95,96]. Ces changements sont similaires à ceux observés dans l’organisme vieillissant et contribuent – notamment en raison de la plasticité réduite des capillaires et des petits vaisseaux – au risque d’HTAP et au développement perturbé du système lymphatique dans les poumons [97–100].
La perturbation de la transduction du signal, associée aux effets directs, par exemple, de la stimulation de la dilatation par la ventilation mécanique et de la toxicité de l’oxygène, contribuent à de graves altérations du squelette pulmonaire [101,102]. Un remodelage accru de la matrice extracellulaire est indiqué, par exemple, par l’augmentation de l’excrétion urinaire de desmosine, précédée d’une augmentation de l’activité de l’élastase [103–105] et est similaire à ce qui a été observé chez les patients atteints du syndrome de détresse respiratoire aiguë (SDRA) [106]. Cependant, le développement physiologique des poumons dépend également de la présence d’élastases et de métalloprotéinases pulmonaires, car un déficit complet en métalloprotéinases matricielles favorise un remodelage pulmonaire typique de la DBP [107].
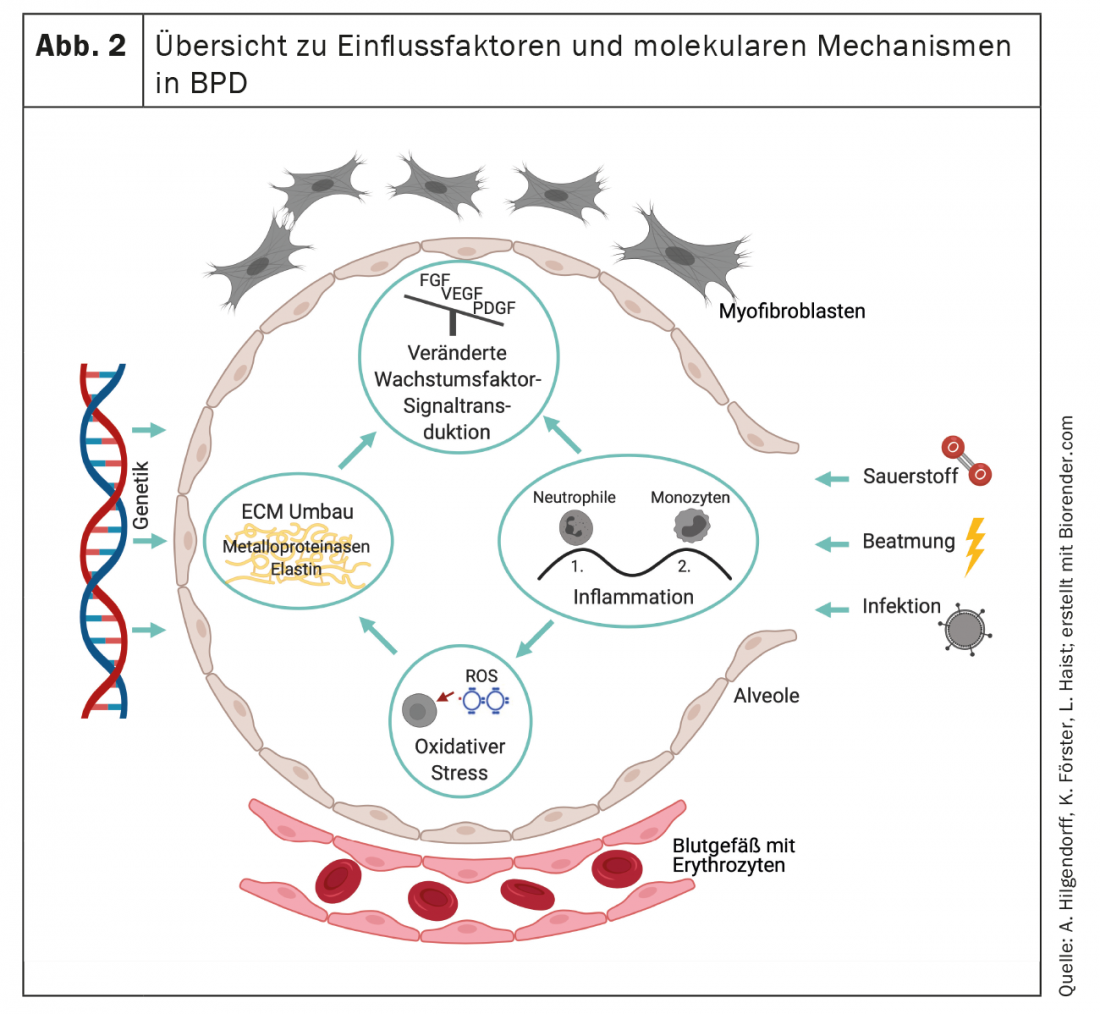
Suite au remodelage, la BPD est caractérisée par une disposition pathologique de l’élastine et une modification qualitative et quantitative de la structure du collagène. [108–110] qui influencent la fonction structurante de la matrice en tant qu’échafaudage pour la formation de nouvelles alvéoles et capillaires et qui définissent le destin des cellules qui colonisent l’organe en développement. [111,112] (Fig. 2). La réorganisation irréversible de la matrice extracellulaire entraînera donc des changements à long terme qui se manifesteront à différents niveaux.
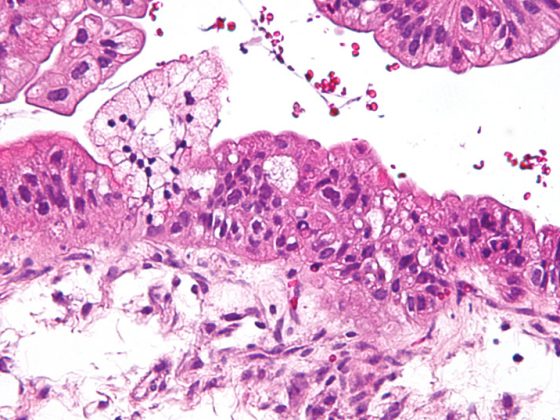
Les modifications histopathologiques et l’hétérogénéité clinique de l’apparition et de l’aspect de la DBP suggèrent l’existence de (sous-)entités de la maladie ou du moins une influence variable selon les individus de différentes modifications structurelles sur l’aspect clinique et l’évolution à long terme. La présence de processus de transformation emphysémateux ou interstitiels primaires, de modifications vasculaires et/ou de pathologies des voies respiratoires sont probablement des “variables d’ajustement” de la DBP qui, dans les premières études, peuvent également être représentées en imagerie morphologique chez les prématurés au moyen de stratégies d’imagerie cliniquement réalisables [113–117]. En reproduisant des études réussies dans d’autres domaines pathologiques, l’utilisation d’autres stratégies d’imagerie [118–121] pourrait permettre d’améliorer encore la stratification des patients à l’avenir.
La fonction pulmonaire dans la DBP – changements précoces et conséquences à long terme
Malgré des efforts soutenus dans les soins périnataux pour éviter les complications à long terme [122,123], la manifestation de symptômes respiratoires à l’âge adulte est fréquente et souvent mal interprétée comme de l’asthme ou une BPCO, en particulier lorsque les événements précoces de la vie ne sont pas connus ou interrogés [124,125].
Cliniquement, le dysfonctionnement pulmonaire se caractérise par une diminution de la compliance pulmonaire, une tachypnée et une augmentation de la ventilation minute, qui se traduisent par une augmentation du travail respiratoire, avec ou sans oxygénodépendance. Ce tableau clinique peut s’accompagner d’une augmentation de la pression microvasculaire dans les poumons, ce qui contribue au développement d’un œdème pulmonaire interstitiel. L’augmentation de la résistance vasculaire pulmonaire, typiquement associée à une diminution de la réponse au monoxyde d’azote inhalé et à d’autres vasodilatateurs, peut évoluer vers une HTAP réversible ou persistante et une insuffisance cardiaque droite [99,100]. La connaissance des changements précoces de la fonction pulmonaire est cruciale, car une maladie pulmonaire plus grave après la naissance est plus susceptible d’évoluer vers une DBP modérée/grave à la date prévue de l’accouchement [126] et la fonction pulmonaire est un bon prédicteur de la morbidité et de la mortalité ultérieures [127]. La DBP se caractérise, au niveau de la fonction pulmonaire, par une résistance accrue des voies respiratoires et une hyperréactivité des voies respiratoires. [128]L’effet de l’hypertension artérielle pulmonaire est souvent associé à une inflammation de l’artère pulmonaire, qui se manifeste cliniquement par une bronchoconstriction épisodique et une cyanose, en association ou non avec une infection pulmonaire (figure 3). La part de la pathologie à médiation vasculaire qui joue ici un rôle au-delà de l’effet Euler-Liljestrand reste souvent obscure en raison de l’absence d’indicateurs sensibles. Les nourrissons concernés peuvent rester dépendants de l’oxygène pendant des mois ou des années, seule une minorité d’entre eux étant réellement dépendants de l’oxygène au-delà de l’âge de deux ans [129,130]. La dépendance à l’oxygène caractérise la gravité particulière de la maladie pulmonaire, et ces nourrissons sont réhospitalisés deux fois plus souvent que les nourrissons non dépendants de l’oxygène. Mais même après la fin de l’oxygénothérapie, les patients souffrant d’une forme modérée ou sévère de la maladie nécessitent jusqu’à 70% de nouvelles hospitalisations, en particulier au cours des deux premières années de vie [126,131,132]. Mais dans l’ensemble, les infections des voies respiratoires inférieures causées par le virus RS (respiratory syncytial virus) restent la principale cause de réadmission à l’hôpital chez les prématurés, quel que soit leur statut DPN [133].
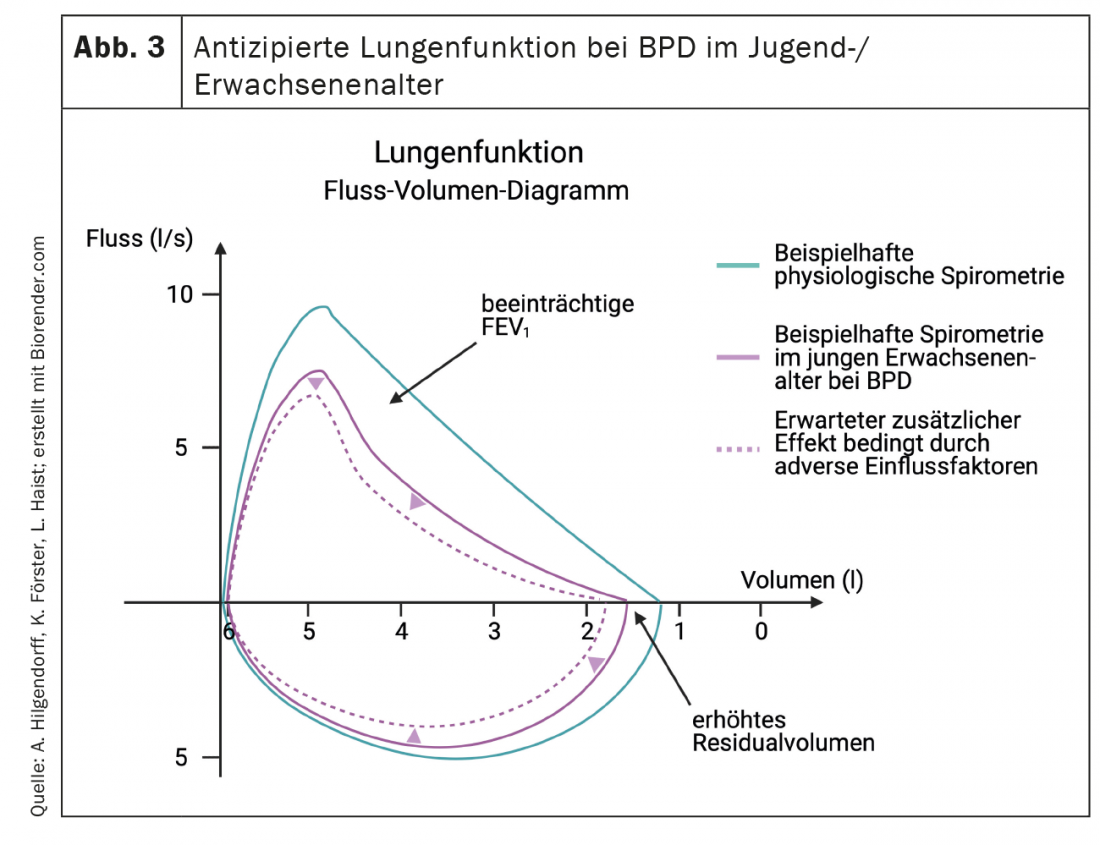
Plus tard dans l’évolution de la maladie, la DBP est un facteur de risque significatif de “wheezen” persistant et de la nécessité d’une thérapie par inhalation (odds ratio 2,7 et 2,4 respectivement), qui concerne environ 20-30% des nourrissons atteints de DBP à l’âge de six et 12 mois [134,135]. Les symptômes respiratoires, en particulier chez les enfants ayant des antécédents de “wheezing”, persistent souvent à l’âge préscolaire et scolaire [129,136] et jusqu’à 80% des prématurés présentent une obstruction des voies respiratoires souvent symptomatique au début de l’enfance et de l’adolescence [137–139]. L’étude EPICure a permis d’obtenir des données importantes sur les résultats à long terme après un accouchement prématuré [140]. Les prématurés présentant une immaturité extrême souffrent à l’âge scolaire d’une consommation de pointe d’oxygène (“peak oxygen consumption”) significativement plus faible en tant qu’évaluation directe de l’aptitude cardiorespiratoire, d’une capacité d’une seconde (volume expiratoire forcé à une seconde, VEMS) plus faible et d’un transfert gazeux limité. Dans ce cas, des pics d’effort significativement plus faibles et des fréquences respiratoires plus élevées, combinés à des volumes courants plus faibles pendant les pics d’effort et à une capacité résiduelle accrue, peuvent refléter l’effet de l’hyperinflation en cas d’obstruction des voies aériennes et/ou de modifications de la fonction des chémorécepteurs pulmonaires, et indiquent la présence de limitations persistantes de la fonction respiratoire et d’une réduction de la surface alvéolaire. Les modifications basées sur la croissance non physiologique des poumons, avec un VEMS et une capacité vitale VEMS/forcée altérés dans le cadre de la DBP, ont été confirmées par plusieurs études chez les enfants et les jeunes adultes [141–144].
L’évolution jusqu’à l’âge adulte est variable. Chez certains patients, notamment ceux atteints de DBP sévère, les symptômes persistent à l’âge adulte [145]. D’autres évolutions indiquent une amélioration temporaire (subjective) avec une réapparition ultérieure des symptômes de la maladie, qui sont la conséquence d’une (nouvelle) réduction de la fonction pulmonaire en dessous d’un seuil clinique (ou individuel). Cette réduction peut apparaître en raison de processus de vieillissement ou d’un déséquilibre émergent du rapport masse pulmonaire/corps et/ou de la consommation d’énergie. Alors qu’un groupe a rapporté une évolution divergente de la croissance pulmonaire à l’adolescence après des mesures spirométriques [141], l’étude EPICure n’a pas montré de rattrapage de la croissance pulmonaire sous-optimale de 11 à 19 ans chez les adolescents nés très prématurément, indépendamment de leur statut DBP, et a même démontré une altération significative de tous les paramètres de la fonction pulmonaire chez les patients nés très prématurément à 19 ans [144]. Entre-temps, Vollsaeter et ses collègues ont rapporté des évolutions parallèles de la fonction pulmonaire au début de l’âge adulte [146].
Mieux comprendre les caractéristiques et les effets du vieillissement pulmonaire prématuré après une naissance prématurée [147,148] et la caractérisation de l’impact des lésions secondaires, telles que le tabagisme, les exacerbations dues à des infections virales et d’autres facteurs environnementaux sur l’évolution de la fonction pulmonaire. [149,150] sera également déterminante pour conseiller les familles dès le début, en vue de l’évolution à long terme et de convenir de stratégies de contrôle.
Un autre champ est défini par l’apparition de comorbidités pour lesquelles le TPL constitue un facteur de risque en soi [151]. Cela concerne les maladies neurologiques et cardiovasculaires et inclut l’examen des complications associées aux soins. Le traitement à la dexaméthasone, en particulier, joue un rôle particulier dans ce domaine, avec des effets négatifs sur la fonction cardiaque, l’espérance de vie et le développement neurologique [152,153].
Résumé
La réponse des poumons immatures aux mécanismes de dommages pré- et postnataux, qui se traduit par une réponse inflammatoire prolongée, une réponse au stress oxydatif et une altération de la transduction du signal des facteurs de croissance, et qui entraîne de graves modifications du développement alvéolaire et vasculaire, y compris un remodelage de la matrice extracellulaire, est associée à des conséquences significatives à long terme. Les anomalies de la fonction pulmonaire (et de l’immunité) chez le nourrisson et dans la petite enfance prédisposent à une fonction pulmonaire réduite chez les adultes ayant survécu à une naissance prématurée et à une altération du processus de vieillissement physiologique par un “effet de mémoire” pulmonaire en réponse aux lésions précoces. Le partage itératif des connaissances entre les pédiatres, les médecins généralistes et les pneumologues pour adultes est nécessaire pour générer une meilleure compréhension de ces effets à long terme, y compris les caractéristiques et les effets du vieillissement prématuré, et les traduire en stratégies de traitement adaptées et en recommandations de mode de vie pour ce groupe de patients. L’interprétation des résultats de la fonction pulmonaire doit tenir compte de l’âge auquel la DBP a été diagnostiquée, de la définition initiale de la DBP et des normes de soins périnataux appliquées.
Messages Take-Home
- La DBP est une maladie respiratoire chronique du nourrisson, caractérisée par une raréfaction alvéolaire, une atteinte des petites voies respiratoires et des modifications vasculaires pulmonaires. Lors du suivi de la fonction pulmonaire, la capacité en une seconde, entre autres, peut être abaissée chez les enfants et les adultes ayant des antécédents de DBP.
- L’association caractéristique d’une alvéolarisation perturbée et de la présence de capillaires dysmorphiques est entraînée par une altération de l’expression des facteurs de croissance angiogéniques. Certaines modifications sont similaires à celles observées dans l’organisme vieillissant et contribuent, à terme, au risque d’HTAP et au développement perturbé du système lymphatique dans les poumons.
- Suite au remodelage, la DBP se caractérise par un agencement pathologique de l’élastine et des modifications qualitatives et quantitatives du squelette collagénique, qui affectent la fonction structurante de la matrice en tant qu’échafaudage pour la formation de nouvelles alvéoles et capillaires et définissent le destin des cellules qui colonisent l’organe en développement.
- Les lésions précoces des poumons entraînent une réaction inflammatoire persistante, une réponse au stress oxydatif et une altération de la transduction des signaux des principaux facteurs de croissance.
- Le partage itératif des connaissances entre les pédiatres, les médecins généralistes et les pneumologues pour adultes est nécessaire pour parvenir à une meilleure compréhension des conséquences à long terme, y compris les caractéristiques et les effets du vieillissement prématuré.
- L’impact d’une maladie pulmonaire chronique précoce sur le développement de comorbidités doit être pris en compte lors de l’élaboration de stratégies de surveillance et de traitement et de recommandations sur le mode de vie pour ce groupe de patients.
Littérature :
- Jobe AH, Bancalari E : Dysplasie broncho-pulmonaire. Am J Respir Crit Care Med 2001 ; 163(7) : 1723-1729.
- Duijts L, van Meel ER, Moschino L, et al : European Respiratory Society guideline on long-term management of children with bronchopulmonary dysplasia. Eur Respir J 2020 ; 55(1).
- Doyle LW : Evaluation of neonatal intensive care for extremely-low-birth-weight infants. Semin Fetal Neonatal Med 2006 ; 11(2) : 139-145.
- Gortner L, Misselwitz B, Milligan D, membres du MRG, et al : Rates of bronchopulmonary dysplasia in very preterm neonates in Europe : results from the MOSAIC cohort. Neonatology 2011 ; 99(2) : 112-117.
- Stoll BJ, Hansen NI, Bell EF, Eunice Kennedy Shriver National Institute of Child H, Human Development Neonatal Research N, et al. : Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics 2010 ; 126(3) : 443-456.
- Vachon E, Bourbonnais Y, Bingle CD, et al : Anti-inflammatory effect of pre-elafin in lipopolysaccharide-induced acute lung inflammation. Biol Chem 2002 ; 383(7-8) : 1249-1256.
- Van Marter LJ, Pagano M, Allred EN, et al : Rate of bronchopulmonary dysplasia as a function of neonatal intensive care practices. J Pediatr 1992 ; 120(6) : 938-946.
- Ehrenkranz RA, Walsh MC, Vohr BR, National Institutes of Child H, Human Development Neonatal Research N, et al. : Validation of the National Institutes of Health consensus definition of bronchopulmonary dysplasia. Pediatrics 2005 ; 116(6) : 1353-1360.
- Johnson AH, Peacock JL, Greenough A, United Kingdom Oscillation Study G, et al : High-frequency oscillatory ventilation for the prevention of chronic lung disease of prematurity. N Engl J Med 2002 ; 347(9) : 633-642.
- Chawanpaiboon S, Vogel JP, Moller AB, et al : Global, regional, and national estimates of levels of preterm birth in 2014 ; a systematic review and modelling analysis. Lancet Glob Health 2019 ; 7(1) : e37-e46.
- Clyman R, Cassady G, Kirklin JK, et al : The role of patent ductus arteriosus ligation in bronchopulmonary dysplasia : reexamining a randomized controlled trial. J Pediatr 2009 ; 154(6) : 873-876.
- Korhonen P, Tammela O, Koivisto AM, et al : Frequency and risk factors in bronchopulmonary dysplasia in a cohort of very low birth weight infants. Early Hum Dev 1999 ; 54(3) : 245-258.
- Kramer BW : Inflammation anténatale et lésion pulmonaire : origine prénatale de la maladie néonatale. J Perinatol 2008 ; 28 Suppl 1 : S21-27.
- Mittendorf R, Covert R, Montag AG, et al : Relations spéciales entre le syndrome de réponse inflammatoire fœtale et la dysplasie bronchopulmonaire chez les nouveau-nés. J Perinat Med 2005 ; 33(5) : 428-434.
- Oh W, Poindexter BB, Perritt R, Neonatal Research N, et al : Association entre la consommation de fluides et la perte de poids pendant les dix premiers jours de vie et le risque de dysplasie bronchopulmonaire chez les nourrissons de très faible poids de naissance. J Pediatr 2005 ; 147(6) : 786-790.
- Stevens TP, Harrington EW, Blennow M, Soll RF : Early surfactant administration with brief ventilation vs selective surfactant and continued mechanical ventilation for preterm infants with or at risk for respiratory distress syndrome. Cochrane Database Syst Rev 2007(4) ; CD003063.
- Biniwale MA, Ehrenkranz RA : The role of nutrition in the prevention and management of bronchopulmonary dysplasia. Semin Perinatol 2006 ; 30(4) : 200-208.
- Shenai JP, Chytil F, Stahlman MT : Statut en vitamine A des nouveau-nés atteints de dysplasie bronchopulmonaire. Pediatr Res 1985 ; 19(2) : 185-188.
- Watterberg KL, Scott SM : Evidence of early adrenal insufficiency in babies who develop bronchopulmonary dysplasia. Pédiatrie 1995 ; 95(1) : 120-125.
- Bose C, Van Marter LJ, Laughon M, Extremely Low Gestational Age Newborn Study I, et al : Fetal growth restriction and chronic lung disease among infants born before the 28th week of gestation. Pediatrics 2009 ; 124(3) : e450-458.
- Regev RH, Lusky A, Dolfin T, Israel Neonatal N, et al : Excess mortality and morbidity among small-for-gestational-age premature infants : a population-based study. J Pediatr 2003 ; 143(2) : 186-191.
- Reiss I, Landmann E, Heckmann M, et al : Increased risk of bronchopulmonary dysplasia and increased mortality in very preterm infants being small for gestational age. Arch Gynecol Obstet 2003 ; 269(1) : 40-44.
- Rieger-Fackeldey E, Schulze A, Pohlandt F, et al : Résultat à court terme chez les nourrissons dont le poids à la naissance est inférieur à 501 grammes. Acta Paediatr 2005 ; 94(2) : 211-216.
- Walsh MC, Yao Q, Horbar JD, et al. : Changes in the use of postnatal steroids for bronchopulmonary dysplasia in 3 large neonatal networks. Pediatrics 2006 ; 118(5) : e1328-1335.
- Rozance PJ, Seedorf GJ, Brown A, et al : Intrauterine growth decreases pulmonary alveolar and vessel growth and causes pulmonary artery endothelial cell dysfunction in vitro in fetal sheep. Am J Physiol Lung Cell Mol Physiol 2011 ; 301(6) : L860-871.
- Gilliland FD, Berhane K, McConnell R, et al : Maternal smoking during pregnancy, environmental tobacco smoke exposure and childhood lung function. Thorax 2000 ; 55(4) : 271-276.
- Vogt Isaksen C : Maternal smoking, intrauterine growth restriction, and placental apoptosis. Pediatr Dev Pathol 2004 ; 7(5) : 433-442.
- Bhandari V, Bizzarro MJ, Shetty A, Neonatal Genetics Study G, et al : Familial and genetic susceptibility to major neonatal morbidities in preterm twins. Pediatrics 2006 ; 117(6) : 1901-1906.
- Hallman M, Haataja R : Influences génétiques et maladies pulmonaires néonatales. Semin Neonatol 2003 ; 8(1) : 19-27.
- Hilgendorff A, Heidinger K, Pfeiffer A, et al : Association of polymorphisms in the mannose-binding lectin gene and pulmonary morbidity in preterm infants. Genes Immun 2007 ; 8(8) : 671-677.
- Poggi C, Giusti B, Vestri A, et al : Polymorphismes génétiques des enzymes antioxydantes chez les nourrissons prématurés. J Matern Fetal Neonatal Med 2012 ; 25 Suppl 4 : 131-134.
- Binet ME, Bujold E, Lefebvre F, Canadian Neonatal N, et al : Role of gender in morbidity and mortality of extremely premature neonates. Am J Perinatol 2012 ; 29(3) : 159-166.
- Trotter A, Maier L, Kron M, Pohlandt F : Effect of oestradiol and progesterone replacement on bronchopulmonary dysplasia in extremely preterm infants. Arch Dis Child Fetal Neonatal Ed 2007 ; 92(2) : F94-98.
- Vrijlandt EJ, Gerritsen J, Boezen HM, Duiverman EJ, Dutch P-CSG : Différences entre les sexes dans les symptômes respiratoires chez les adultes de 19 ans nés avant terme. Respir Res 2005 ; 6 : 117.
- Wadon M, Modi N, Wong HS, et al : Recent advances in the genetics of preterm birth. Ann Hum Genet 2020 ; 84(3) : 205-213.
- Fraser J, Walls M, McGuire W : Complications respiratoires de l’accouchement prématuré. BMJ 2004 ; 329(7472) : 962-965.
- Wang H, St Julien KR, Stevenson DK, et al : A genome-wide association study (GWAS) for bronchopulmonary dysplasia. Pediatrics 2013 ; 132(2) : 290-297.
- Lommatzsch ST, Aris R : Génétique de la mucoviscidose. Semin Respir Crit Care Med 2009 ; 30(5) : 531-538.
- Sztrymf B, Coulet F, Girerd B, et al : Clinical outcomes of pulmonary arterial hypertension in carriers of BMPR2 mutation. Am J Respir Crit Care Med 2008 ; 177(12) : 1377-1383.
- Austin ED, Loyd JE : La génétique de l’hypertension artérielle pulmonaire. Circ Res 2014 ; 115(1) : 189-202.
- Husain AN, Siddiqui NH, Stocker JT : Pathologie du développement acinaire arrêté dans la dysplasie bronchopulmonaire postsurfactante. Hum Pathol 1998 ; 29(7) : 710-717.
- Lopez E, Mathlouthi J, Lescure S, et al : Capnography in spontaneously breathing preterm infants with bronchopulmonary dysplasia. Pediatr Pulmonol 2011 ; 46(9) : 896-902.
- Stoll BJ, Gordon T, Korones SB, et al : Septicémie précoce chez les nouveau-nés de très faible poids de naissance : un rapport de l’Institut national de la santé infantile et du développement humain Réseau de recherche sur la néonatalité. J Pediatr 1996 ; 129(1) : 72-80.
- Watterberg KL, Demers LM, Scott SM, Murphy S : Chorioamnionitis and early lung inflammation in infants in whom bronchopulmonary dysplasia develops. Pédiatrie 1996 ; 97(2) : 210-215.
- Yoon BH, Romero R, Jun JK, et al : Amniotic fluid cytokines (interleukin-6, tumor necrosis factor-alpha, interleukin-1 beta, and interleukin-8) and the risk for the development of bronchopulmonary dysplasia. Am J Obstet Gynecol 1997 ; 177(4) : 825-830.
- Speer CP : Inflammation et dysplasie bronchopulmonaire : une histoire continue. Semin Fetal Neonatal Med 2006 ; 11(5) : 354-362.
- Todd DA, Earl M, Lloyd J, Greenberg M, John E : Changements cytologiques dans les aspirations endotrachéales associées à une maladie pulmonaire chronique. Early Hum Dev 1998 ; 51(1) : 13-22.
- Ibrahim J, Garantziotis S, Savani R : Updates on Neonatal Chronic Lung Disease 2020, Chapter 9 – The Inflammation Superhighway : Tolls, Signals, and Pathways to Bronchopulmonary Dysplasia. 131-150.
- Atochina-Vasserman EN, Bates SR, Zhang P, et al : Le dysfonctionnement épithélial alvéolaire précoce favorise l’inflammation pulmonaire dans un modèle murin du syndrome de Hermansky-Pudlak. Am J Respir Crit Care Med 2011 ; 184(4) : 449-458.
- Hilgendorff A, Parai K, Ertsey R, et al : Inhibiting lung elastase activity enables lung growth in mechanically ventilated newborn mice. Am J Respir Crit Care Med 2011 ; 184(5) : 537-546.
- Stoll BJ, Hansen N, Fanaroff AA, et al : Changes in pathogens causing early-onset sepsis in very-low-birth-weight infants. N Engl J Med 2002 ; 347(4) : 240-247.
- Olszak T, An D, Zeissig S, et al : L’exposition microbienne au début de la vie a des effets persistants sur la fonction des cellules T tueuses naturelles. Science 2012 ; 336(6080) : 489-493.
- Bose CL, Laughon MM, Allred EN, Investigators ES, et al : Systemic inflammation associated with mechanical ventilation among extremely preterm infants. Cytokine 2013 ; 61(1) : 315-322.
- Jobe AH, Kallapur SG : Conséquences à long terme de l’oxygénothérapie dans la période néonatale. Semin Fetal Neonatal Med 2010 ; 15(4) : 230-235.
- Kroon AA, Wang J, Huang Z, et al : Réponse inflammatoire à l’oxygène et à l’endotoxine dans les poumons de rat nouveau-né ventilés avec un faible volume courant. Pediatr Res 2010 ; 68(1) : 63-69.
- Polglase GR, Hillman NH, Ball MK, et al : Lung and systemic inflammation in preterm lambbs on continuous positive airway pressure or conventional ventilation. Pediatr Res 2009 ; 65(1) : 67-71.
- Kunzmann S, Speer CP, Jobe AH, Kramer BW : Antenatal inflammation induced TGF-beta1 but suppressed CTGF in preterm lungs. Am J Physiol Lung Cell Mol Physiol 2007 ; 292(1) : L223-231.
- Kazzi SN, Kim UO, Quasney MW, Buhimschi I : Polymorphisme du facteur de nécrose tumorale alpha et risque et sévérité de la dysplasie bronchopulmonaire chez les nourrissons de très faible poids de naissance. Pédiatrie 2004 ; 114(2) : e243-248.
- Nold MF, Mangan NE, Rudloff I, et al : Interleukin-1 receptor antagonist prevents murine bronchopulmonary dysplasia induced by perinatal inflammation and hyperoxia. Proc Natl Acad Sci U S A 2013 ; 110(35) : 14384-14389.
- Ibrahim JG, Stavros ; Savani, Rashmin : The Inflammation Superhighway : Tolls, Signals, and Pathways to Bronchopulmonary Dysplasia. In : Kallapur SP, Gloria, ed. Updates on Neonatal Chronic Lung Disease (Mises à jour sur les maladies pulmonaires chroniques néonatales). Elsevier 2020 ; 131-150.
- Lechner AJ, Driver IH, Lee J, et al : Recruited Monocytes and Type 2 Immunity Promote Lung Regeneration following Pneumonectomy. Cell Stem Cell 2017 ; 21(1) : 120-134 e127.
- McQuattie-Pimentel AC, Budinger GRS, Ballinger MN : Macrophages alvéolaires dérivés de monocytes : la face cachée de la réparation pulmonaire ? Am J Respir Cell Mol Biol 2018 ; 58(1) : 5-6.
- Olin A, Henckel E, Chen Y, et al : Stereotypic Immune System Development in Newborn Children. Cell 2018 ; 174(5) : 1277-1292 e1214.
- Zaslona Z, Przybranowski S, Wilke C, et al : Les macrophages alvéolaires résidents suppriment, alors que les monocytes recrutés favorisent, l’inflammation allergique des poumons dans des modèles murins d’asthme. J Immunol 2014 ; 193(8) : 4245-4253.
- Yamada M, Fujino N, Ichinose M : Réponses inflammatoires dans l’initiation de la réparation et de la régénération pulmonaires : leur rôle dans la stimulation des cellules souches résidentes pulmonaires. Inflamm Regen 2016 ; 36 : 15.
- Bose CL, Dammann CE, Laughon MM : Bronchopulmonary dysplasia and inflammatory biomarkers in the premature neonate. Arch Dis Child Fetal Neonatal Ed 2008 ; 93(6) : F455-461.
- Rose MJ, Stenger MR, Joshi MS, et al : Inhaled nitric oxide decreases leukocyte trafficking in the neonatal mouse lung during exposure to >95% oxygen. Pediatr Res 2010 ; 67(3) : 244-249.
- Vento G, Tirone C, Lulli P, et al : Bronchoalveolar lavage fluid peptidomics suggests a possible matrix metalloproteinase-3 role in bronchopulmonary dysplasia. Intensive Care Med 2009 ; 35(12) : 2115-2124.
- Watterberg KL, Carmichael DF, Gerdes JS, et al : Secretory leukocyte protease inhibitor and lung inflammation in developing bronchopulmonary dysplasia. J Pediatr 1994 ; 125(2) : 264-269.
- Weinberger B, Anwar M, Henien S, et al : Association of lipid peroxidation with antenatal betamethasone and oxygen radial disorders in preterm infants. Biol Neonate 2004 ; 85(2) : 121-127.
- Collard KJ, Godeck S, Holley JE, Quinn MW : Concentrations d’antioxydants pulmonaires et dommages oxydatifs chez les bébés prématurés ventilés. Arch Dis Child Fetal Neonatal Ed 2004 ; 89(5) : F412-416.
- Filippone M, Bonetto G, Corradi M, et al : Evidence of unxpected oxidative stress in airways of adolescents born very pre-term. Eur Respir J 2012 ; 40(5) : 1253-1259.
- Hennessy EM, Bracewell MA, Wood N, Group EPS, et al : Respiratory health in pre-school and school age children following extremely preterm birth. Arch Dis Child 2008 ; 93(12) : 1037-1043.
- Merritt TA, Deming DD, Boynton BR : The ‘new’ bronchopulmonary dysplasia : challenges and commentary. Semin Fetal Neonatal Med 2009 ; 14(6) : 345-357.
- Buczynski BW, Yee M, Paige Lawrence B, O’Reilly MA : Le développement pulmonaire et la réponse de l’hôte au virus de la grippe A sont altérés par différentes doses d’oxygène néonatal chez la souris. Am J Physiol Lung Cell Mol Physiol 2012 ; 302(10) : L1078-1087.
- Belik J, Jankov RP, Pan J, Tanswell AK : L’exposition chronique à l’O2 augmente la contraction des muscles lisses vasculaires et respiratoires chez le rat nouveau-né mais pas adulte. J Appl Physiol (1985) 2003 ; 94(6) : 2303-2312.
- Yee M, White RJ, Awad HA, Bates WA, et al : L’hyperoxie néonatale provoque une maladie vasculaire pulmonaire et raccourcit l’espérance de vie chez les souris âgées. Am J Pathol 2011 ; 178(6) : 2601-2610.
- Balasubramaniam V, Mervis CF, Maxey AM, et al : Hyperoxia reduces bone marrow, circulating, and lung endothelial progenitor cells in the developing lung : implications for the pathogenesis of bronchopulmonary dysplasia. Am J Physiol Lung Cell Mol Physiol 2007 ; 292(5) : L1073-1084.
- Londhe VA, Sundar IK, Lopez B, et al : Hyperoxia impairs alveolar formation and induces senescence through decreased histone deacetylase activity and up-regulation of p21 in neonatal mouse lung. Pediatr Res 2011 ; 69(5 Pt 1) : 371-377.
- Nanduri J, Makarenko V, Reddy VD, et al : La régulation épigénétique de la détection de l’hypoxie perturbe l’homéostasie cardiorespiratoire. Proc Natl Acad Sci U S A 2012 ; 109(7) : 2515-2520.
- Jankov RP, Keith Tanswell A : Growth factors, postnatal lung growth and bronchopulmonary dysplasia. Paediatr Respir Rev 2004 ; 5 Suppl A : S265-275.
- Alejandre-Alcazar MA, Kwapiszewska G, Reiss I, et al : Hyperoxia modulates TGF-beta/BMP signaling in a mouse model of bronchopulmonary dysplasia. Am J Physiol Lung Cell Mol Physiol 2007 ; 292(2) : L537-549.
- Chao CM, Moiseenko A, Kosanovic D, et al : Impact du déficit en Fgf10 sur la formation des vaisseaux pulmonaires dans un modèle murin de dysplasie bronchopulmonaire. Hum Mol Genet 2019 ; 28(9) : 1429-1444.
- Li C, Smith SM, Peinado N, et al : La signalisation WNT5a-ROR est essentielle pour l’alvéologenèse. Cells 2020 ; 9(2).
- Oak P, Hilgendorff A : Le trio BPD ? Interaction de la signalisation dérégulée du PDGF, du VEGF et du TGF dans les maladies pulmonaires chroniques néonatales. Mol Cell Pediatr 2017 ; 4(1) : 11.
- Sucre JM, Wilkinson D, Vijayaraj P, et al : Un modèle humain en trois dimensions de l’activation fibroblastique qui accompagne la dysplasie bronchopulmonaire identifie la physiopathologie médiée par Notch. Am J Physiol Lung Cell Mol Physiol 2016 ; 310(10) : L889-898.
- Sucre JMS, Deutsch GH, Jetter CS, et al : A Shared Pattern of beta-Catenin Activation in Bronchopulmonary Dysplasia and Idiopathic Pulmonary Fibrosis. Am J Pathol 2018 ; 188(4) : 853-862.
- Iosef C, Alastalo TP, Hou Y, et al : L’inhibition de NF-kappaB dans le poumon en développement perturbe l’angiogenèse et l’alvéolarisation. Am J Physiol Lung Cell Mol Physiol 2012 ; 302(10) : L1023-1036.
- Didon L, Roos AB, Elmberger GP, et al : Lung-specific inactivation of CCAAT/enhancer binding protein alpha causes a pathological pattern characteristic of COPD. Eur Respir J 2010 ; 35(1) : 186-197.
- Alvira CM, Abate A, Yang G, et al : Nuclear factor-kappaB activation in neonatal mouse lung protects against lipopolysaccharide-induced inflammation. Am J Respir Crit Care Med 2007 ; 175(8) : 805-815.
- Yang G, Abate A, George AG, et al : Différences de maturité dans l’activation du NF-kappaB pulmonaire et son rôle dans la tolérance à l’hyperoxie. J Clin Invest 2004 ; 114(5) : 669-678.
- De Paepe ME, Greco D, Mao Q : Angiogenesis-related gene expression profiling in ventilated preterm human lungs. Exp Lung Res 2010 ; 36(7) : 399-410.
- De Paepe ME, Mao Q, Powell J, et al : Growth of pulmonary microvascular in ventilated preterm infants. Am J Respir Crit Care Med 2006 ; 173(2) : 204-211.
- Thebaud B : Angiogenesis in lung development, injury and repair : implications for chronic lung disease of prematurity. Néonatologie 2007 ; 91(4) : 291-297.
- Ito Y, Betsuyaku T, Nagai K, et al : Expression of pulmonary VEGF family declines with age and is further down-regulated in lipopolysaccharide (LPS)-induced lung injury. Exp Gerontol 2005 ; 40(4) : 315-323.
- Vyas-Read S, Shaul PW, Yuhanna IS, Willis BC : Nitric oxide attenuates epithelial-mesenchymal transition in alveolar epithelial cells. Am J Physiol Lung Cell Mol Physiol 2007 ; 293(1) : L212-221.
- Bland RD, Ling CY, Albertine KH, et al : Pulmonary vascular dysfunction in preterm lamb with chronic lung disease. Am J Physiol Lung Cell Mol Physiol 2003 ; 285(1) : L76-85.
- Kamba T, Tam BY, Hashizume H, Haskell A, et al : VEGF-dependent plasticity of fenestrated capillaries in the normal adult microvasculature. Am J Physiol Heart Circ Physiol 2006 ; 290(2) : H560-576.
- Kinsella JP, Greenough A, Abman SH : Dysplasie broncho-pulmonaire. Lancet 2006 ; 367(9520) : 1421-1431.
- Steinhorn RH : Hypertension pulmonaire néonatale. Pediatr Crit Care Med 2010 ; 11(2 Suppl) : S79-84.
- Torday JS, Rehan VK : La mécanotransduction détermine la structure et la fonction des poumons et des os : un modèle théorique pour la physiopathologie des maladies chroniques. Cell Biochem Biophys 2003 ; 37(3) : 235-246.
- Mizikova I, Morty RE : La matrice extracellulaire dans la dysplasie broncho-pulmonaire : cible et source. Front Med (Lausanne) 2015 ; 2 : 91.
- Bruce MC, Schuyler M, Martin RJ, et al : Risk factors for the degradation of lung elastic fibers in the ventilated neonate. Implications pour le développement pulmonaire impraticable dans la dysplasie broncho-pulmonaire. Am Rev Respir Dis 1992 ; 146(1) : 204-212.
- Bruce MC, Wedig KE, Jentoft N, et al : Altered urinary excretion of elastin cross-links in premature infants who develop bronchopulmonary dysplasia. Am Rev Respir Dis 1985 ; 131(4) : 568-572.
- Merritt TA, Cochrane CG, Holcomb K, et al : Elastase and alpha 1-proteinase inhibitory activity in tracheal aspirates during respiratory distress syndrome. Rôle de l’inflammation dans la pathogenèse de la dysplasie bronchopulmonaire. J Clin Invest 1983 ; 72(2) : 656-666.
- Tenholder MF, Rajagopal KR, Phillips YY, et al : Excrétion urinaire de desmosine comme marqueur d’atteinte pulmonaire dans le syndrome de détresse respiratoire de l’adulte. Chest 1991 ; 100(5) : 1385-1390.
- Lukkarinen H, Hogmalm A, Lappalainen U, Bry K : La déficience en métalloprotéinase-9 matricielle provoque des lésions pulmonaires dans un modèle de dysplasie bronchopulmonaire. Am J Respir Cell Mol Biol 2009 ; 41(1) : 59-68.
- Pierce RA, Albertine KH, Starcher BC, et al : Chronic lung injury in preterm lambbs : disordered pulmonary elastin deposition. Am J Physiol 1997 ; 272(3 Pt 1) : L452-460.
- Thibeault DW, Mabry SM, Ekekezie, II, Truog WE : Maturation des tissus élastiques pulmonaires et perturbations au cours de l’évolution des maladies pulmonaires chroniques. Pédiatrie 2000 ; 106(6) : 1452-1459.
- Thibeault DW, Mabry SM, et al : Collagen scaffolding during development and its deformation with chronic lung disease. Pediatrics 2003 ; 111(4 Pt 1) : 766-776.
- Bonvillain RW, Danchuk S, Sullivan DE, et al. : Un modèle de primate non humain de régénération pulmonaire : décellularisation médiée par un détergent et recellularisation initiale in vitro avec des cellules souches mésenchymateuses. Tissue Eng Part A 2012 ; 18(23-24) : 2437-2452.
- Jensen T, Roszell B, Zang F, et al : Un protocole de décellularisation rapide des poumons soutient la différenciation des cellules souches embryonnaires in vitro et après implantation. Tissue Eng Part C Methods 2012 ; 18(8) : 632-646.
- Förster K, Ertl-Wagner B, Ehrhardt H, et al : Altered relaxation times in MRI indicate bronchopulmonary dysplasia. Thorax 2019 ; thoraxjnl-2018-212384.
- Oda K, Ishimoto H, Yatera K, et al : High-resolution CT scoring system-based grading scale predicts the clinical outcomes in patients with idiopathic pulmonary fibrosis. Respir Res 2014 ; 15 : 10.
- Walkup LL, Tkach JA, Higano NS, et al : Imagerie par résonance magnétique quantitative de la dysplasie bronchopulmonaire dans l’environnement des soins intensifs néonatals. Am J Respir Crit Care Med 2015 ; 192(10) : 1215-1222.
- Washko GR : Imagerie diagnostique dans la BPCO. Semin Respir Crit Care Med 2010 ; 31(3) : 276-285.
- Weatherley ND, Eaden JA, Stewart NJ, et al : Techniques d’imagerie expérimentale et quantitative dans les maladies pulmonaires interstitielles. Thorax 2019 ; 74(6) : 611-619.
- Capaldi DP, Zha N, Guo F, et al : Biomarqueurs d’imagerie pulmonaire du piégeage des gaz et de l’emphysème dans la BPCO : (3)He MR Imaging and CT Parametric Response Maps. Radiology 2016 ; 279(2) : 597-608.
- De Boeck K, Derichs N, Fajac I, Group EDNW, EuroCare CFWPGoCFd, et al : New clinical diagnostic procedures for cystic fibrosis in Europe. J Cyst Fibros 2011 ; 10 Suppl 2 : S53-66.
- Sileo C, Corvol H, Boelle PY, et al : HRCT and MRI of the lung in children with cystic fibrosis : comparison of different scoring systems. J Cyst Fibros 2014 ; 13(2) : 198-204.
- Tulek B, Kivrak AS, Ozbek S, et al : Phenotyping of chronic obstructive pulmonary disease using the modified Bhalla scoring system for high-resolution tomography. Can Respir J 2013 ; 20(2) : 91-96.
- Jobe AH, Ikegami M : Prévention de la dysplasie bronchopulmonaire. Curr Opin Pediatr 2001 ; 13(2) : 124-129.
- Newman JB, DeBastos AG, Batton D, Raz S : Dysfonctionnement respiratoire néonatal et performance neuropsychologique à l’âge préscolaire : une étude de nourrissons très prématurés atteints de dysplasie bronchopulmonaire. Neuropsychologie 2011 ; 25(5) : 666-678.
- Bolton CE, Bush A : Venez maintenant à une clinique de chirurgie thoracique près de chez vous. Thorax 2013 ; 68(8) : 707-708.
- Bolton CE, Bush A, Hurst JR, et al : Conséquences pulmonaires chez les adultes nés prématurément. Thorax 2015 ; 70(6) : 574-580.
- May C, Kennedy C, Milner AD, et al : Lung function abnormalities in infants developing bronchopulmonary dysplasia. Arch Dis Child 2011 ; 96(11) : 1014-1019.
- Miller MR, Pedersen OF, Lange P, Vestbo J : Amélioration de la prédiction de la survie à partir des données de la fonction pulmonaire dans un large échantillon de population. Respir Med 2009 ; 103(3) : 442-448.
- Hilgendorff A, Reiss I, Gortner L, et al. : Impact de l’obstruction des voies respiratoires sur la fonction pulmonaire chez les nourrissons très prématurés à terme. Pediatr Crit Care Med 2008 ; 9(6) : 629-635.
- Greenough A, Alexander J, Burgess S, et al : Preschool healthcare use related to home oxygen status. Arch Dis Child Fetal Neonatal Ed 2006 ; 91(5) : F337-341.
- Greenough A, Alexander J, Burgess S, et al : Home oxygen status and rehospitalisation and primary care requirements of infants with chronic lung disease. Arch Dis Child 2002 ; 86(1) : 40-43.
- Doyle LW, Cheung MM, Ford GW, et al : Birth weight <1501 g and respiratory health at age 14. Arch Dis Child 2001 ; 84(1) : 40-44.
- Greenough A, Cox S, Alexander J, et al : Health care use of infants with chronic lung disease, related to hospitalisation for RSV infection. Arch Dis Child 2001 ; 85(6) : 463-468.
- Broughton S, Roberts A, Fox G, et al : Prospective study of healthcare use and respiratory morbidity due to RSV infection in prematurely born infants. Thorax 2005 ; 60(12) : 1039-1044.
- Baraldi E, Carraro S, Filippone M : Bronchopulmonary dysplasia : definitions and long-term respiratory outcome. Early Hum Dev 2009 ; 85(10 Suppl) : 1-3.
- Greenough A, Limb E, Marston L, et al : Risk factors for respiratory morbidity in infancy after very premature birth. Arch Dis Child Fetal Neonatal Ed 2005 ; 90(4) : F320-323.
- Gross SJ, Iannuzzi DM, Kveselis DA, Anbar RD : Effet de la naissance prématurée sur la fonction pulmonaire à l’âge scolaire : une étude prospective contrôlée. J Pediatr 1998 ; 133(2) : 188-192.
- Broughton S, Thomas MR, Marston L, et al : Les enfants nés très prématurément souffrent de rhumatismes au cours du suivi : fonction pulmonaire et facteurs de risque. Arch Dis Child 2007 ; 92(9) : 776-780.
- Pelkonen AS, Hakulinen AL, Turpeinen M : Bronchial lability and responsiveness in school children born very preterm. Am J Respir Crit Care Med 1997 ; 156(4 Pt 1) : 1178-1184.
- Yuksel B, Greenough A : Relations entre les symptômes et les anomalies de la fonction pulmonaire chez les nourrissons nés avant terme au cours du suivi. Pediatr Pulmonol 1991 ; 11(3) : 202-206.
- Welsh L, Kirkby J, Lum S, Odendaal D, Group EPS, et al : The EPICure study : maximum exercise and physical activity in school children born extremely preterm. Thorax 2010 ; 65(2) : 165-172.
- Doyle LW, Faber B, Callanan C, et al : Bronchopulmonary dysplasia in very low birth weight subjects and lung function in late adolescence. Pediatrics 2006 ; 118(1) : 108-113.
- Greenough A, Dimitriou G, Bhat RY, et al : Lung volumes in infants who had mild to moderate bronchopulmonary dysplasia. Eur J Pediatr 2005 ; 164(9) : 583-586.
- Hjalmarson O, Sandberg KL : La fonction pulmonaire à terme reflète la sévérité de la dysplasie bronchopulmonaire. J Pediatr 2005 ; 146(1) : 86-90.
- Hurst JR, Beckmann J, Ni Y, et al : Respiratory and Cardiovascular Outcomes in Survivors of Extremely Preterm Birth at 19 Years. Am J Respir Crit Care Med 2020 ; 202(3) : 422-432.
- Northway WH, Jr, Moss RB, Carlisle KB, et al : Séquelles pulmonaires tardives de dysplasie bronchopulmonaire. N Engl J Med 1990 ; 323(26) : 1793-1799.
- Vollsaeter M, Roksund OD, Eide GE, et al. : Fonction pulmonaire après une naissance prématurée : développement de la mi-enfance à l’âge adulte. Thorax 2013 ; 68(8) : 767-776.
- Bolton CE, Bush A, Hurst JR, et al : Are early life factors considered when managing respiratory disease ? A British Thoracic Society survey of current practice. Thorax 2012 ; 67(12) : 1110.
- Crump C : L’enregistrement de l’historique médical chez les adultes devrait inclure des questions sur l’accouchement prématuré. BMJ 2014 ; 349 : g4860.
- Baraldi E, Filippone M : Maladie pulmonaire chronique après un accouchement prématuré. N Engl J Med 2007 ; 357(19) : 1946-1955.
- Filippone M, Carraro S, Baraldi E : De la BPD à la BPCO ? L’hypothèse est intrigante mais nous manquons de données pathologiques pulmonaires chez l’homme. Eur Respir J 2010 ; 35(6) : 1419-1420 ; author reply 1420.
- Anderson PJ, Doyle LW : Résultat neurodéveloppemental de la dysplasie bronchopulmonaire. Semin Perinatol 2006 ; 30(4) : 227-232.
- Bal MP, de Vries WB, van Oosterhout MF, et al : Long-term cardiovascular effects of neonatal dexamethasone treatment : heodynamic follow-up by left ventricular pressure-volume loops in rats. J Appl Physiol (1985) 2008 ; 104(2) : 446-450.
- Kamphuis PJ, de Vries WB, Bakker JM, et al : Réduction de l’espérance de vie chez les rats après un traitement néonatal à la dexaméthasone. Pediatr Res 2007 ; 61(1) : 72-76.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2021 ; 3(2) : 10-15