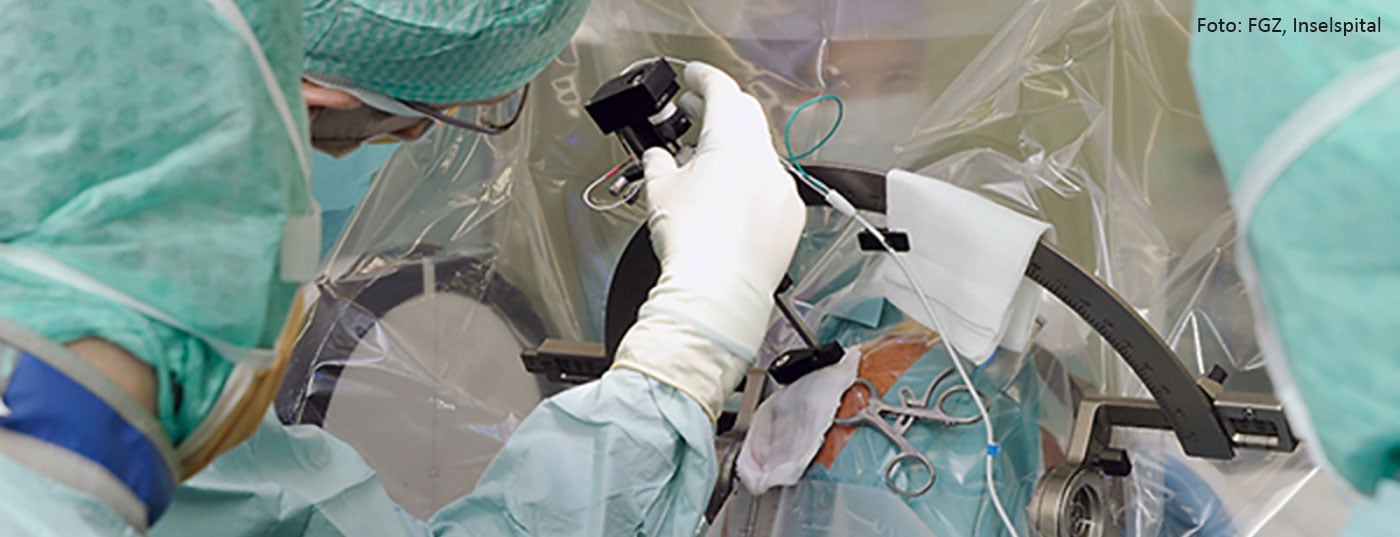
Bien plus d’un tiers des épilepsies ne peuvent pas être traitées de manière satisfaisante par des mesures conservatrices, et un grand nombre de ces patients se prêtent à un traitement chirurgical. La chirurgie diagnostique de l’épilepsie permet de localiser avec précision les foyers épileptogènes et les zones cérébrales fonctionnelles lorsque le diagnostic conventionnel a atteint les limites de ses possibilités. La chirurgie thérapeutique de l’épilepsie comprend différentes procédures microchirurgicales, neuromoductrices et neuroablatives très efficaces. La morbidité périprocédurale est rare et la mortalité opératoire est exceptionnelle. En particulier, pour les épilepsies du lobe temporal résistantes à la pharmacothérapie, il a été démontré que les résultats de la chirurgie de l’épilepsie étaient les meilleurs, avec une guérison de la maladie dans 60 à 80% des cas. Avec une sélection appropriée des patients, une évaluation pré-chirurgicale minutieuse et la réalisation de l’intervention, la chirurgie de l’épilepsie peut non seulement contrôler durablement les crises, mais aussi améliorer de manière décisive l’espérance et la qualité de vie et réduire considérablement les coûts de traitement.
Les épilepsies, certaines des maladies neurologiques les plus fréquentes, les plus variées et les plus graves, constituent un défi diagnostique et thérapeutique pour tout médecin traitant. Jusqu’à 40% des patients concernés souffrent de crises persistantes malgré un traitement médicamenteux adéquat. Plus de cinq millions de patients épileptiques dans le monde représentent des candidats potentiels pour un traitement neurochirurgical. Cet article de synthèse résume les connaissances actuelles sur la chirurgie de l’épilepsie et examine les indications, les méthodes, les possibilités, les risques et les chances de succès du traitement neurochirurgical moderne de l’épilepsie.
Objectifs de la chirurgie de l’épilepsie
Le traitement chirurgical de l’épilepsie est une branche de la neurochirurgie. Les interventions chirurgicales de l’épilepsie devraient être envisagées pour clarifier de manière plus approfondie et invasive les crises qui ne peuvent pas être suffisamment diagnostiquées autrement, ainsi que pour traiter les maladies insuffisamment contrôlées pharmacologiquement. Le but ultime de la chirurgie de l’épilepsie est l’absence totale de crises. Si cet objectif n’est pas réalisable, une réduction maximale des crises et donc une minimisation des risques d’épilepsie et des effets secondaires des médicaments sont recherchées.
Sélection des patients
En principe, les patients présentant tous les types de crises et de syndromes doivent d’abord être considérés comme des candidats potentiels à la chirurgie de l’épilepsie, qui sont de plus en plus difficiles à traiter pharmacologiquement et pour lesquels au moins deux antiépileptiques à des doses appropriées ne suffisent pas. La chirurgie de l’épilepsie est particulièrement indiquée lorsque des effets secondaires de la médication doivent déjà être pris en compte. Plusieurs questions doivent être abordées en préopératoire :
- Les crises sont-elles vraiment d’origine épileptique ?
- Le début est-il focal et unilatéral ?
- S’agit-il d’un focus unique ?
- Où la mise au point est-elle localisée exactement ?
- L’excision peut-elle être complète et sans déficits neurologiques potentiels ?
L’évaluation chirurgicale pré-épileptique est complexe, multidisciplinaire et doit être réalisée, tout comme l’intervention elle-même, dans des centres hautement spécialisés. Elle comprend l’examen des antécédents médicaux et une évaluation clinique récente, un examen neuroradiologique par imagerie par résonance magnétique (IRM) selon des protocoles spécifiques à l’épilepsie et une évaluation par un neuroradiologue expérimenté, l’enregistrement des crises par vidéo-électroencéphalographie (EEG) stationnaire de longue durée (télémétrie) et une évaluation neuropsychologique et psychiatrique. Dans certains cas, il est également nécessaire de procéder à des examens complémentaires spécifiques, tels que des imageries fonctionnelles et des enregistrements EEG intracrâniens (appelés bilan chirurgical pré-épileptique de phase II).
Diagnostic préchirurgical invasif de l’épilepsie
La délimitation la plus précise possible de la zone d’origine des crises (foyer épileptogène) et des zones éloquentes (fonctionnellement importantes) voisines est d’une importance capitale pour la réalisation, la sécurité et le succès d’une intervention chirurgicale de l’épilepsie. Si un EEG de surface non invasif (Phase I) ne permet pas à elle seule de déterminer de manière satisfaisante la latéralisation et la localisation de la zone d’origine des crises, il convient, dans le cadre de la chirurgie diagnostique de l’épilepsie, de procéder à un EEG invasif supplémentaire (phase II) comme pour le stéréo-EEG. C’est notamment le cas lorsque
- même une imagerie à haute résolution n’a pas permis de détecter une lésion épileptogène,
- il existe des résultats discordants concernant la propagation de l’activité épileptogène dans le cerveau,
- multifocalité doit être exclue,
- une résection étroitement circonscrite est indiquée afin d’épargner les tissus cérébraux éloquents adjacents.
Des électrodes intracérébrales profondes et des électrodes en bande ou en plaque épidurales ou sous-durales sont temporairement guidées de manière stéréotaxique par des trépanations et des craniotomies et introduites par neuronavigation. De cette manière, en plus d’une dérivation EEG invasive avec détermination de la position et délimitation de la zone épileptogène, il est possible de réaliser une stimulation intracrânienne qui permet d’évaluer la relation entre les lésions épileptogènes et les zones cérébrales éloquentes. Les électrodes implantées permettent une détection très sensible des crises, mais ne peuvent dériver que des excitations spatialement limitées des zones cérébrales immédiatement adjacentes. En raison du risque accru lié aux implantations polyfocales multiples, il n’est pas non plus possible d’insérer les électrodes en nombre et en emplacement quelconques. C’est pourquoi une planification préopératoire prudente (élaboration d’une hypothèse sur la localisation de la zone d’origine des crises, détermination du type, du nombre et de l’emplacement des électrodes) et une exécution minutieuse de l’implantation elle-même sont essentielles.
La plupart du temps, il faut enregistrer au moins deux crises typiques du patient avant de pouvoir prendre la décision d’une chirurgie thérapeutique de l’épilepsie. Habituellement, les électrodes, souvent insérées uniquement par trépanation, sont retirées à la fin du monitoring invasif et l’intervention thérapeutique est réalisée lors d’une deuxième séance en tenant compte des éventuelles incisions et trépanations antérieures. Si des électrodes à bande ou des électrodes à plaque ont été implantées par craniotomie, l’intervention thérapeutique de chirurgie épileptique peut être effectuée en même temps que l’explantation afin d’éviter au patient une anesthésie et une opération supplémentaires inutiles.
Les interventions chirurgicales diagnostiques de l’épilepsie sont associées à une morbidité temporaire d’environ 8%, et les morbidités permanentes sont très rares (0,6%). Il n’y a généralement pas de mortalité. L’utilisation d’électrodes parenchymateuses au lieu d’électrodes épidurales ou sous-durales permet de minimiser les risques. Les origines des crises sont détectées de manière fiable dans plus de 99% des cas, de sorte que les avantages du monitoring invasif l’emportent sur les risques potentiels. La chirurgie diagnostique de l’épilepsie conduit dans 95% des cas à une intervention chirurgicale thérapeutique de l’épilepsie.
Classification du traitement chirurgical de l’épilepsie
Les interventions chirurgicales thérapeutiques de l’épilepsie comprennent différentes techniques microchirurgicales, stéréotaxiques et fonctionnelles. Les interventions peuvent en principe être classées cliniquement en curatives et palliatives, et méthodologiquement en réséctives, déconnectives, destructives, neuromoductrices et neuroablatives. Les interventions réséquatives et destructives éliminent ou détruisent des zones épileptogènes et les procédures d’isolement déconnectif et de neurostimulation fonctionnelle rompent ou modulent les réseaux épileptogènes. Les procédures à visée curative comprennent les résections, les lésions ectomies et les interventions hémisphériques, tandis que les callosotomies, les transsections sous-piales multiples et les procédures neuromodulaires ont un objectif palliatif. Les techniques neuroablatives constituent une exception à cette règle et sont utilisées à la fois dans le cadre d’une approche thérapeutique curative et palliative.
D’un point de vue anatomique, environ deux tiers des opérations sont réalisées de manière temporale, toutes les autres sont extratemporelles ou multifocales et combinées.
De plus, les procédures sont différenciées selon le degré d’invasivité chirurgicale. Ainsi, les hémisphérectomies sont les plus invasives et les stimulations des nerfs périphériques les moins invasives. Certaines procédures neuroablatives assistées par ultrasons et radiochirurgicales n’impliquent pas d’invasivité chirurgicale. Plusieurs facteurs favorisent les chances de contrôle des crises par la chirurgie de l’épilepsie, notamment la possibilité de circonscrire la lésion, l’exhaustivité de l’élimination, l’absence de crises tonico-cloniques bilatérales et la précocité de l’intervention.
Chirurgie réséquante de l’épilepsie
Les interventions chirurgicales épileptiques réséquées sont généralement temporaires et ont une approche thérapeutique curative en premier lieu. Les patients dont l’origine des crises est focale ou régionale sont généralement éligibles. Le tissu cérébral épileptogène à exciser peut être localisé de différentes manières, être uni- ou multifocal et avoir une taille allant de quelques millimètres à un hémisphère entier. Les zones épileptogènes doivent être suffisamment circonscrites et ne pas être situées dans une zone éloquente du cerveau, de sorte qu’une élimination complète et sûre soit possible et puisse conduire à une absence totale de crises. Les interventions résécables comprennent les résections temporales, extratemporelles et néocorticales, les lésions ectomiques et les interventions hémisphériques.
Résections temporaires
Les lobectomies temporales avec ablation étendue du lobe temporal, y compris des structures mésiales, sont très rares de nos jours. En revanche, la lobectomie temporale antérieure ou résection du lobe temporal, avec ses différentes variations, est l’intervention la plus fréquente en chirurgie de l’épilepsie (70 à 80%). Alors qu’à l’origine, les résections des deux tiers du lobe temporal étaient réalisées avec ou sans amygdalohippocampectomies (corticoamygdalohippocampectomies), il existe aujourd’hui différentes, moins réséquantes, telles que les lobectomies partielles antérieures, les hippocampectomies, les amygdalohippocampectomies corticales et sélectives, les corticoamygdalectomies, les topectomies ou les transsections hippocampiques multiples, réalisées isolément ou en combinaison. Les perspectives de disparition des crises sont globalement élevées, de l’ordre de 60 à 80%.
Résections extratemporelles
Les résections extratemporelles incluent les lobectomies solitaires, les multilobectomies, les hémisphérectomies, les hémisphérotomies, les lésionnectomies et les topectomies. Les taux de réussite sont globalement inférieurs à ceux des interventions temporales, avec des taux d’absence de crises compris entre 30 et 60%. Après les résections du lobe temporal, les interventions du lobe frontal sont les procédures réséquées les plus fréquentes, suivies par les opérations du lobe pariétal et les résections du lobe occipital. Les taux d’absence de crises sont supérieurs à 45% dans chaque cas.
Résections néocorticales
Les interventions sur le néocortex comprennent des opérations temporales et extratemporelles au niveau d’un ou plusieurs lobes cérébraux. En fonction de la lésion sous-jacente, des résections importantes peuvent être nécessaires pour éliminer les zones épileptogènes, en tenant compte de la relation avec les zones éloquentes et du risque de perte de fonction. Les résections néocorticales comprennent également les topectomies, des résections circonscrites de zones épileptogènes précisément localisées au sein d’un lobe cérébral. Selon la localisation, l’absence de crises est décrite chez environ 60% des patients.
Ectomies de lésions
Les épilepsies lésionnelles sont caractérisées par des lésions structurelles épileptogènes telles que des malformations vasculaires, des dysplasies corticales focales, des scléroses temporales mésiales, des encéphalomalacies et des néoplasies de bas grade. Leur ablation entraîne l’absence de crises dans 70 à 90% des cas, en fonction de l’exhaustivité de la résection de la zone épileptogène. Les lésions multifocales et éloquentes ne peuvent souvent être retirées que de manière incomplète et les interventions sont par conséquent associées à des taux de réussite plus faibles. Selon la pathologie sous-jacente, des procédures neuroradiologiques, oncologiques et radio-oncologiques adjuvantes sont utilisées en complément.
Interventions hémisphériques
La chirurgie hémisphérique comprend les hémisphérectomies, les hémidécortications ainsi que les hémisphérectomies et leurs variations respectives. Elles font partie des interventions chirurgicales de l’épilepsie les plus efficaces, mais aussi les plus invasives et radicales. Les candidats sont principalement des enfants présentant des lésions cérébrales hémisphériques étendues et une épilepsie latéralisée. Les pathologies sous-jacentes sont par exemple les kystes porophysaires, les hémiatrophies, les hémimégaloencéphalies, les encéphalites de Rasmussen, les angiomes de Sturge-Weber ou les lésions traumatiques graves.
Les premières hémisphérectomies anatomiques classiques étaient associées à des taux de complications élevés et ne sont généralement plus utilisées. Les modifications telles que l’hémisphérectomie fonctionnelle de Rasmussen sont beaucoup moins résécables et principalement déconnectées ; elles comprennent l’ablation du lobe temporal et du cortex central avec dissociation du néocortex frontal et occipitotemporal des structures sous-corticales et du corps calleux, qui restent toutefois anatomiquement intacts. Les hémisphérotomies fonctionnelles représentent un autre raffinement technique et ne comprennent que des résections très limitées de tissus cérébraux. L’hémisphère ipsilatéral épileptogène est largement déconnecté des centres sous-corticaux et de l’hémisphère controlatéral, mais anatomiquement préservé.
Après une intervention hémisphérique, plus de 73% des patients n’ont plus de crises ; chez les enfants, l’absence de crises peut être obtenue dans 70-80% des cas et jusqu’à 90% chez les adultes.
Chirurgie non réséquative de l’épilepsie
Les interventions chirurgicales épileptiques non résécables, isolatives et fonctionnelles sont beaucoup plus rares, généralement moins prometteuses et ont généralement une approche thérapeutique palliative. L’objectif est de réduire la sévérité de l’épilepsie. Les perspectives de disparition totale des crises sont faibles, mais la fréquence des crises peut être réduite de manière significative chez environ 50% des patients. Les opérations non réséctives comprennent les procédures de déconnexion et d’ablation ainsi que les implants neuromodulateurs ; elles sont envisagées lorsque les interventions réséctives ne sont pas utiles ou possibles.
Les callosotomies : Les callosotomies avec section partielle ou totale du corps calleux sont généralement pratiquées sur des enfants. Les patients présentant une origine bihémisphérique synchrone étendue des crises sans foyer résécable identifiable sont des candidats potentiels. L’objectif est d’empêcher l’activité épileptogène de se propager au-delà de la barre vers l’hémisphère opposé. Les principales indications sont généralement les crises de chute atone non traitables par d’autres moyens, les syndromes de Lennox-Gastaut et les épilepsies multifocales.
L’intervention se déroule généralement en une ou deux étapes. Lors d’une première séance chirurgicale, les deux tiers antérieurs de la poutre sont sectionnés afin de minimiser le risque de syndrome de dislocation. Si cela ne suffit pas, il est possible de sectionner l’ensemble du corps calleux lors d’une deuxième intervention. Selon le type et l’étendue de l’épilepsie, on peut s’attendre à une absence de crises dans 5 à 35% des cas et à une réduction significative de la fréquence des crises dans 60 à 65% des cas.
Transsections sous-piales multiples : Si la zone épileptogène se trouve dans une région du cerveau fonctionnellement importante, les transsections sous-piales multiples sont une option pour le traitement palliatif de l’apparition et de la propagation des crises au sein des zones éloquentes. Les transsections consistent en des incisions néocorticales verticales dans la substance grise ou dans l’hippocampe, dans le but de préserver la fonction anatomique de la région et de supprimer le déclenchement des crises. Elles sont généralement réalisées en même temps que des interventions réséctives.
Après des transsections seules, une réduction de plus de 95% de la fréquence des crises est décrite chez 60 à 70% des patients, selon le type de crise. Si les transsections sont réalisées en même temps que les résections, des taux de réussite de 70 à 90% peuvent être atteints.
Neuromodulation
Les options de thérapie neuromodulatrice augmentative implantables pour le traitement des épilepsies, surtout multifocales, et des formes sévères de la maladie comprennent la neurostimulation directe des structures cérébrales centrales au moyen d’une stimulation cérébrale superficielle profonde et continue, et la neurostimulation indirecte par l’intermédiaire de nerfs périphériques tels que les nerfs vague et trijumeau. Les procédés non implantables et non invasifs tels que la stimulation magnétique transcrânienne et la stimulation électrique directe ne relèvent que partiellement de la chirurgie de l’épilepsie et ne seront donc pas abordés en détail ici. Les mécanismes d’action respectifs de ces procédés ne sont pas encore totalement élucidés. Leurs modes comprennent une stimulation continue et périodique indépendante des crises (“en boucle ouverte”) et une stimulation intermittente associée aux crises (“en boucle fermée”).
Stimulation cérébrale profonde : la stimulation cérébrale profonde, qui consiste à insérer des électrodes dans des noyaux profonds pour une stimulation chronique via des neuro-pédulateurs, est utilisée comme option thérapeutique palliative. Les électrodes sont implantées soit directement dans la zone épileptogène, soit à distance dans des noyaux circonscrits tels que l’hippocampe, le cervelet et le thalamus. Des cibles alternatives rares sont la substantia nigra, le locus coeruleus et les noyaux sous-thalamiques et caudatus. La stimulation est généralement continue et indépendante des crises, bien qu’il existe des approches de stimulation adaptative, liée aux crises. L’absence de crises n’est généralement pas attendue avec ce traitement. Cependant, selon le site d’action de la stimulation, des réductions de la fréquence des crises sont décrites chez 15% (hippocampe), 20% (cortex) et 26% (thalamus) des patients.
Stimulation cérébrale superficielle : la stimulation cérébrale superficielle est effectuée chez les patients ne présentant pas plus de deux foyers épileptogènes, au moyen d’électrodes implantées dans la région sous-durale et parenchymateuse proche de la zone épileptogène. Au cours des stimulations corticales réactives, les crises sont détectées et une zone limitée du cortex est stimulée via un neurostimulateur et un algorithme approprié. Cela entraîne l’interruption des décharges ictales. Environ 38% des patients obtiennent ainsi une réduction des crises d’au moins 50%.
Stimulation du nerf vague : les stimulations du nerf vague sont indiquées chez les patients épileptiques chez lesquels aucune zone épileptogène circonscrite accessible à la chirurgie n’a été identifiée et pour lesquels les procédures réséquables ne sont pas appropriées. Les électrodes sont appliquées sur le nerf vague gauche au niveau du cou et reliées à un neurostimulateur. La stimulation peut être intermittente ou induite par l’ECG en raison de crises imminentes et peut combiner les deux modes. L’absence de crises n’est observée en moyenne que chez 14% des patients traités, mais la fréquence des crises peut être réduite chez environ 51% d’entre eux.
Stimulation du nerf trijumeau : cette procédure consiste à stimuler les branches du nerf trijumeau par voie transcutanée ou invasive (respectivement les nerfs ophtalmique, supraorbitaire et infraorbitaire des deux côtés). Jusqu’à présent, il n’existe que peu de résultats sur cette nouvelle méthode. Des réductions soutenues de la fréquence des crises de plus de 50% ont été documentées chez 44-59% des patients.
Neuroablation
Les méthodes de traitement neuroablatif occupent une place particulière dans la chirurgie de l’épilepsie. L’approche thérapeutique est à la fois curative et palliative, elle provoque des lésions permanentes, sert en particulier à traiter les épilepsies du lobe temporal mésial ainsi que les foyers épileptogènes profonds circonscrits et comprend des interventions thermocoagulantes (y compris des méthodes guidées par IRM telles que l’ablation par ultrasons focalisés et par laser) et des procédures assistées par stéréotaxie (ablation par radiofréquence et radiochirurgie). Selon le type d’épilepsie et la méthode utilisée, les taux d’élimination des crises peuvent atteindre 25% (ablation par radiofréquence), 77% (radiochirurgie) et 86% (ablation par laser). En ce qui concerne le nouveau traitement par ultrasons, il faut attendre les résultats d’études significatives avec des indications sur la fréquence des crises.
Les avantages de ces procédures sont une invasivité minimale, comme dans le cas de l’ablation par radiofréquence et par laser, voire l’absence d’invasivité chirurgicale, comme dans le cas de l’ablation par ultrasons et de la radiochirurgie. L’expérience et les résultats obtenus jusqu’à présent sont encore limités et inégaux. Il n’est donc pas possible de procéder à une évaluation définitive à l’heure actuelle. La radiochirurgie a permis d’obtenir des taux de réussite comparables à ceux des séries résécables, mais il faut garder à l’esprit que les résultats ne sont connus qu’avec un temps de latence de plusieurs mois, alors que pendant cette période, des œdèmes cérébraux nécessitant un traitement apparaissent souvent et que les symptômes peuvent s’aggraver, ce qui peut nécessiter une thérapie stéroïdienne prolongée, avec les effets secondaires que cela implique.
Possibilités, risques et chances de succès
Les complications chirurgicales de l’épilepsie sont rares, généralement sans gravité et temporaires. Ils comprennent les risques généraux d’une intervention, tels que les infections et les saignements, ainsi que des risques spécifiques, en fonction du type et de l’étendue de l’intervention et de sa localisation. Les taux de complications, toutes procédures confondues, se situent globalement entre 5 et 11%. Les interventions chirurgicales épileptiques résiduelles sont associées à une morbidité temporaire d’environ 5% et à une morbidité permanente de 1,5%. La mortalité périopératoire est faible et se situe globalement entre 0,1 et 0,5%. Pour les procédures temporales, la mortalité péri-opératoire est de 0,4%, pour les procédures extra-temporelles de 1,2%. Les complications neurologiques temporaires sont plus fréquentes chez les enfants et après des interventions extra-temporelles et peuvent atteindre jusqu’à 11%. Des déficits persistants ne sont constatés que chez environ 5%. Les réopérations en raison de complications ou pour traiter des crises postopératoires persistantes sont rarement nécessaires. Toutefois, si l’indication est posée avec soin, une deuxième intervention peut être effectuée de manière sûre et efficace pour poursuivre le traitement de l’épilepsie si l’opération initiale n’a pas été suffisamment efficace ou a échoué.
Les chances de succès de la chirurgie thérapeutique de l’épilepsie dépendent du type d’épilepsie, de la pathologie sous-jacente, de l’emplacement de la zone épileptogène, de la précision de la localisation et de l’exhaustivité de la résection. En moyenne, le taux d’absence de crises après toutes les interventions est de 62,5%. Les épilepsies temporales représentent jusqu’à 76% des cas et les épilepsies extratemporelles 34 à 56%. Dans les études à long terme, on constate une absence durable de crises après un total de 48% de toutes les opérations chirurgicales de l’épilepsie. Les chances de réussite sont comparables chez les enfants et les adultes. Les résections pour les scléroses de l’hippocampe et les tumeurs bénignes et de bas grade montrent une absence de crises plus fréquente par rapport à toutes les autres entités provoquant une épilepsie. En outre, l’évolution est en principe plus favorable après une chirurgie lésionnelle de l’épilepsie lorsque des anomalies épileptogènes ont été mises en évidence par l’imagerie morphologique préopératoire.
Neuroprotection par la chirurgie de l’épilepsie
Les épilepsies accompagnées de crises chroniques incontrôlables sont cliniquement des maladies malignes . Alors que les patients épileptiques sans crises ont une espérance de vie comparable à celle de la population générale, la mortalité des patients souffrant de crises persistantes est augmentée de 4,7%. En outre, les épilepsies insuffisamment traitées peuvent être associées à un risque d’atrophie corticale croissante et de déclin cognitif. Les effets secondaires du traitement médicamenteux continu sont également fréquents.
Des études ont montré que les interventions chirurgicales de l’épilepsie peuvent augmenter l’espérance et la qualité de vie des patients concernés et réduire les coûts de traitement. L’absence de crises, surtout à un jeune âge, réduit le risque de problèmes cognitifs, comportementaux et psychologiques et améliore l’intégration sociale. Si le foyer épileptogène peut être délimité avec précision en préopératoire et complètement retiré en peropératoire avec un faible risque, le traitement neurochirurgical des épilepsies pharmacorésistantes a plus de chances d’aboutir à la disparition des crises que toute autre tentative de traitement conservateur. En évitant les dommages neurologiques progressifs, la chirurgie de l’épilepsie a un effet neuroprotecteur et réduit le risque de blessures ou même de décès.
Une efficacité supérieure, mais trop peu utilisée
La chirurgie de l’épilepsie a énormément évolué au cours des dernières décennies et comprend désormais différentes options neuromoductrices et neuroablatives, en plus des procédures microchirurgicales classiques réséquantes et disconnectives. La mise en œuvre du traitement chirurgical de l’épilepsie fait appel à différents principes modernes d’imagerie, de stéréotaxie et d’électrophysiologie, ainsi qu’à des méthodes spéciales, telles que la neuronavigation, la cartographie cérébrale, la radiofréquence, la technologie laser, les ultrasons et la radiochirurgie. Si l’évaluation préopératoire interdisciplinaire, la sélection des patients et l’indication sont effectuées avec soin dans un centre spécialisé, les chances de succès de la chirurgie de l’épilepsie sont élevées et les risques sont faibles. Bien que l’efficacité et la supériorité du traitement chirurgical par rapport au traitement médicamenteux dans le traitement des épilepsies pharmacorésistantes aient été démontrées, la chirurgie de l’épilepsie est encore trop rarement et trop tardivement envisagée comme option thérapeutique.
Littérature :
- Barbaro NM, et al : A multicenter, prospective pilot study of gamma knife radiosurgery for mesial temporal lobe epilepsy : seizure response, adverse events, and verbal memory. Ann Neurol 2009 ; 65(2) : 167-175.
- Bergey GK, et al : Traitement à long terme par stimulation cérébrale réactive chez les adultes souffrant de seizures partielles réfractaires. Neurology 2015 ; 84(8) : 810-817.
- Connor DE Jr, et al : Vagal nerve stimulation for the treatment of medically refractory epilepsy : a review of the current literature. Neurosurg Focus 2012 ; 32(3) : E12.
- DeGiorgio CM, et al : Trigeminal nerve stimulation for epilepsy : long-term feasibility and efficacy. Neurology 2009 ; 72(10) : 936-938.
- DeGiorgio CM, et al : Étude pilote de la stimulation du nerf trijumeau (TNS) pour l’épilepsie : un essai de preuve de concept. Epilepsia 2006 ; 47(7) : 1213-1215.
- Engel J Jr, et al : Traitement chirurgical précoce de l’épilepsie du lobe temporal pharmacorésistante : un essai randomisé. JAMA 2012 ; 307(9) : 922-930.
- Engel Jr, et al : Practice parameter : temporal lobe and localized neocortical resections for epilepsy : report of the Quality Standards Subcommittee of the American Academy of Neurology, in association with the American Epilepsy Society and the American Association of Neurological Surgeons. Neurology 2003 ; 60(4) : 538-547.
- Englot DJ, Chang EF, Auguste KI. Stimulation du nerf vague pour l’épilepsie : une méta-analyse de l’efficacité et des prédicteurs de réponse. J Neurosurg 2011 ; 115(6) : 1248-1255.
- Fisher R, et al : Electrical stimulation of the anterior nucleus of thalamus for treatment of refractory epilepsy. Epilepsia 2010 ; 51(5) : 899-908.
- Griessenauer CJ, et al : Hemispherectomy for treatment of refractory epilepsy in the pediatric age group : a systematic review. J Neurosurg Pediatr 2015 ; 15(1) : 34-44.
- Guénot M, et al : SEEG-guided RF-thermocoagulation of epileptic foci : a therapeutic alternative for drug-resistant non-operable partial epilepsies. Adv Tech Stand Neurosurg 2011 ; 36 : 61-78.
- Guerrini R, Rosati A, Giordano F, Genitori L, Barba C. The medical and surgical treatment of tumoral seizures : current and future perspectives. Epilepsia 2013 ; 54 Suppl 9 : 84-90.
- Hader WJ, et al : Complications of epilepsy surgery : a systematic review of focal surgical resections and invasive EEG monitoring. Epilepsia 2013 ; 54(5) : 840-847.
- Heck CN, et al. : Réduction des crises sur deux ans chez les adultes atteints d’épilepsie à début partiel médicalement intractable traitée par neurostimulation réactive : résultats finaux de l’essai pivot du système RNS. Epilepsia 2014 ; 55(3) : 432-441.
- Hu WH, et al : Chirurgie hémisphérique pour l’épilepsie réfractaire : une revue systématique et méta-analyse en mettant l’accent sur les prédicteurs de l’épilepsie et les résultats. J Neurosurg 2015 Oct 23 : 1-10 [Epub ahead of print].
- Jobst BC, Cascino GD. Chirurgie épileptique résiduelle pour l’épilepsie focale pharmacorésistante : une revue. JAMA 2015 ; 313(3) : 285-293.
- Jobst BC, Darcey TM, Thadani VM, Roberts DW. Stimulation cérébrale pour le traitement de l’épilepsie. Epilepsia 2010 ; 51 Suppl 3 : 88-92.
- Jolesz FA, McDannold NJ. Échographie focalisée guidée par résonance magnétique : une nouvelle technologie pour les neurosciences cliniques. Neurol Clin 2014 ; 32(1) : 253-269.
- Krishnaiah B, Ramaratnam S, Ranganathan LN. Chirurgie de la transection sous-picale pour l’épilepsie. Cochrane Database Syst Rev 2015 ; 12 : CD008153.
- Kuzniecky R, Devinsky O. Surgery Insight : gestion chirurgicale de l’épilepsie. Nat Clin Pract Neurol 2007 ; 3(12) : 673-681.
- Kwan P, Brodie MJ. Identification précoce de l’épilepsie réfractaire. N Engl J Med 2000 ; 342(5) : 314-319.
- Laxpati NG, Kasoff WS, Gross RE. La stimulation cérébrale profonde pour le traitement de l’épilepsie : circuits, cibles et essais. Neurotherapeutics 2014 ; 11(3) : 508-526.
- Lega BC, Halpern CH, Jaggi JL, Baltuch GH. La stimulation cérébrale profonde dans le traitement de l’épilepsie réfractaire : mise à jour des données actuelles et des orientations futures. Neurobiol Dis 2010 ; 38(3) : 354-360.
- Lew SM. Hemispherectomy in the treatment of seizures : a review. Transl Pediatr 2014 ; 3(3) : 208-217.
- Lhatoo SD, Moghimi N, Schuele S. Épilepsie liée à une tumeur et chirurgie de l’épilepsie. Epilepsia 2013 ; 54 Suppl 9 : 1-4.
- Liu SY, et al : Résultats cliniques et qualité de vie suite au traitement chirurgical de l’épilepsie réfractaire : une revue systématique et une méta-analyse. Medicine (Baltimore) 2015 ; 94(6) : e500.
- McIntosh AM, Kalnins RM, Mitchell LA, Fabinyi GC, Briellmann RS, Berkovic SF. Lobectomie temporale : résultat à long terme de l’épilepsie, récidive tardive et risques de récidive de l’épilepsie. Brain 2004 ; 127(Pt 9) : 2018-2030.
- Monteith S, et al : Transcranial magnetic resonance-guided focused ultrasound for temporal lobe epilepsy : a laboratory feasibility study. J Neurosurg 2016 Feb 12 : 1-8 [Epub ahead of print].
- Morrell F, Whisler WW, Bleck TP. Multiple subpial transection : une nouvelle approche du traitement chirurgical de l’épilepsie focale. J Neurosurg 1989 ; 70(2) : 231-239.
- Morrell M. Brain stimulation for epilepsy : can scheduled or responsive neurostimulation stop seizures ? Curr Opin Neurol 2006 ; 19(2) : 164-168.
- Morrell MJ, Halpern C. Responsive direct brain stimulation for epilepsy. Neurosurg Clin N Am 2016 ; 27(1) : 111-1121.
- Morrell MJ ; RNS System in Epilepsy Study Group. La stimulation corticale sensible pour le traitement de l’épilepsie partielle médicalement intractable. Neurology 2011 ; 77(13) : 1295-1304.
- Nair DR, Burgess R, McIntyre CC, Lüders H. Chronic subdural electrodes in the management of epilepsy. Clin Neurophysiol 2008 ; 119(1) : 11-28.
- Nair DR. Prise en charge de l’épilepsie pharmacorésistante. Continuum (Minneap Minn) 2016 ; 22(1 Epilepsy) : 157-172.
- Nowell M, Miserocchi A, McEvoy AW, Duncan JS. Advances in epilepsy surgery (Avancées dans la chirurgie de l’épilepsie). J Neurol Neurosurg Psychiatry 2014 ; 85(11) : 1273-1279.
- Nowell M, Miserocchi A, McEvoy AW. Les tumeurs dans l’épilepsie. Semin Neurol 2015 ; 35(3) : 209-217.
- Panebianco M, Rigby A, Weston J, Marson AG. Stimulation du nerf vague pour les seizures partielles. Cochrane Database Syst Rev 2015 ; 4 : CD002896.
- Patil AA, Andrews R. Suivi à long terme après transection hippocampique multiple (MHT). Seizure 2013 ; 22(9) : 731-734.
- Patil AA, Chamczuk AJ, Andrews RV. Transects hippocampiques pour l’épilepsie. Neurosurg Clin N Am 2016 ; 27(1) : 19-25.
- Quigg M, Harden C. Techniques peu invasives pour la chirurgie de l’épilepsie : radiochirurgie stéréotaxique et autres technologies. J Neurosurg 2014 ; 121 Suppl : 232-240.
- Ryvlin P, Cross JH, Rheims S. Epilepsy surgery in children and adults. Lancet Neurol 2014 ; 13(11) : 1114-1126.
- Ryvlin P, Kahane P. La chirurgie de l’épilepsie réduit-elle la mortalité de l’épilepsie pharmacorésistante ? Epilepsy Res 2003 ; 56(2-3) : 105-120.
- Salanova V, et al : Efficacité et sécurité à long terme de la stimulation thalamique pour l’épilepsie partielle pharmacorésistante. Neurology 2015 ; 84(10) : 1017-1025.
- Sawhney IM, Robertson IJ, Polkey CE, Binnie CD, Elwes RD. Transection sous-piale multiple : une revue de 21 cas. J Neurol Neurosurg Psychiatry 1995 ; 58(3) : 344-349.
- Schramm J. La chirurgie de l’épilepsie et l’évolution de la science clinique et translationnelle. Neurosurgery 2014 ; 61 Suppl 1 : 54-65.
- Spencer S, Huh L. Résultats de la chirurgie de l’épilepsie chez les adultes et les enfants. Lancet Neurol 2008 ; 7(6) : 525-537.
- Sprengers M, Vonck K, Carrette E, Marson AG, Boon P. Deep brain and cortical stimulation for epilepsy. Cochrane Database Syst Rev 2014 ; 6 : CD008497.
- Surges R, Elger CE. Réopération après une opération d’épilepsie réséquée. Seizure 2013 ; 22(7) : 493-501.
- Tanriverdi T, et al : Morbidity in epilepsy surgery : an experience based on 2449 epilepsy surgery procedures from a single institution. J Neurosurg 2009 ; 110(6) : 1111-1123.
- Téllez-Zenteno JF, et al : Résultats à long terme dans la chirurgie de l’épilepsie : les médicaments antiépileptiques, la mortalité, les aspects cognitifs et psychosociaux. Brain 2007 ; 130(Pt 2) : 334-345.
- Téllez-Zenteno JF, et al : Surgical outcomes in lesional and non-lesional epilepsy : a systematic review and meta-analysis. Epilepsy Res 2010 ; 89(2-3) : 310-318.
- West S, Nolan SJ, Cotton J, Gandhi S, Weston J, Sudan A, Ramirez R, Newton R. Surgery for epilepsy. Cochrane Database Syst Rev 2015 ; 7 : CD010541.
- Wiebe S, et al. : Efficacité et efficience de la chirurgie pour l’épilepsie du lobe temporal Groupe d’étude. Un essai randomisé et contrôlé de la chirurgie de l’épilepsie du lobe temporal. N Engl J Med 2001 ; 345(5) : 311-318.
- Wiebe S, Jetté N. Epilepsy surgery utilization : who, when, where, and why ? Curr Opin Neurol 2012 ; 25(2) : 187-193.
- Wu C, Sharan AD. Neurostimulation pour le traitement de l’épilepsie : une revue des interventions chirurgicales actuelles. Neuromodulation 2013 ; 16(1) : 10-24.
InFo NEUROLOGIE & PSYCHIATRIE 2016 ; 14(3) : 12-17