L’incontinence d’effort est abordée par la chirurgie, tandis que l’hyperactivité vésicale est traitée en premier lieu par des médicaments. En l’absence de succès des mesures conservatrices, un examen urogynécologique et urodynamique doit être effectué.
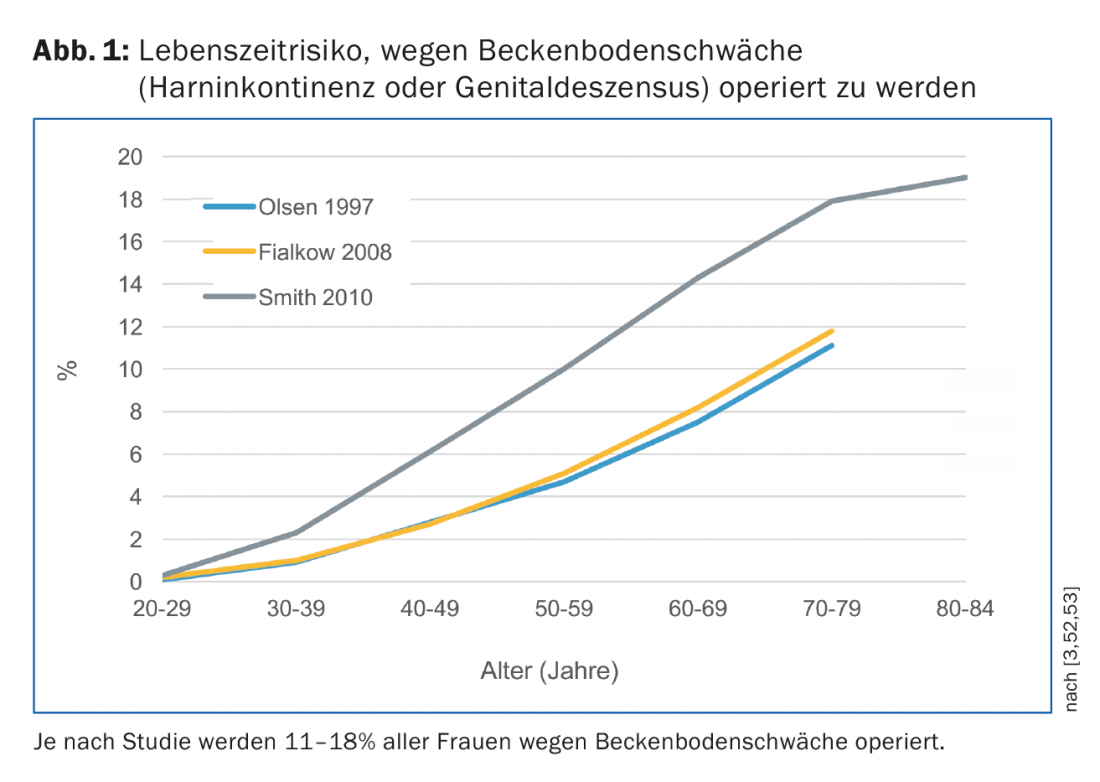
L’incontinence urinaire touche les personnes de tout âge, mais sa prévalence augmente en fonction de l’âge [1,2]. Dans le monde occidental, elle se situe entre 24% et 45%. En Suisse, selon l’Enquête suisse sur la santé 2012 de l’Office fédéral de la statistique, une femme sur dix a “parfois du mal à retenir l’eau” et a besoin d’une intervention chirurgicale en raison d’une incontinence urinaire ou d’une descente génitale (descente ou descente du vagin ou de l’utérus) jusqu’à l’âge de 80 ans (Fig. 1) [3].
La définition de l’incontinence urinaire est “toute perte involontaire d’urine” [4]. Si elle se produit en synchronisation avec une activité physique telle que la toux, les éternuements ou le rire, on parle d’incontinence urinaire d’effort (“stress urinary incontinence”, SUI). Si les patients souffrent d’un besoin impérieux et difficilement réprimable d’uriner, accompagné typiquement de “frequency” (mictions fréquentes) et de nycturie (mictions nocturnes), il s’agit d’un syndrome de vessie hyperactive (“overactive bladder syndrome”, OAB ; anciennes dénominations “vessie irritable” ou “incontinence d’urgence”) ; un tiers est incontinent, deux tiers sont continents (OAB “wet” ou humide resp. OAB “dry” ou sec). La distinction entre l’incontinence d’effort et l’OAB est importante, car les approches thérapeutiques sont différentes : Alors que l’incontinence d’effort peut être corrigée par la chirurgie, l’OAB est abordée en premier lieu par des médicaments. Près d’un tiers présente une incontinence d’effort pure et un quart une OAB pure (selon le collectif de patientes de notre consultation spécialisée en urogynécologie à l’hôpital universitaire de Zurich, dont l’âge moyen est de 58,5 ans). En clinique, près d’une personne sur deux souffre d’une combinaison des deux formes d’incontinence (incontinence mixte), ce qui complique le traitement et réduit son efficacité. Les maladies neurologiques, les fistules ou l’incontinence par regorgement d’origine polyneuropathique en cas de diabète sucré sont des exemples d’autres formes d’incontinence rares.
L’incontinence urinaire n’est pas dangereuse en soi. Il est étonnant de constater que, malgré une qualité de vie réduite, seul un tiers des personnes atteintes de cette pathologie consulte un médecin [5]. Cette affection engendre des coûts considérables en termes de consultations médicales, de médicaments, d’aides à l’incontinence, de cathéters, de kinésithérapie, de chirurgie, de linge, de vêtements, de traitements d’infections cutanées ou urinaires, de nettoyage de tapis et de meubles : Aux États-Unis, on estime que les coûts annuels s’élèvent à 17,5 milliards de dollars et en Allemagne à près de 4 milliards d’euros [6,7]. L’incontinence urinaire peut alors être traitée, à condition que ce sujet tabou soit abordé ouvertement.
Étiologie de l’incontinence urinaire
Le plancher pelvien constitue l’extrémité inférieure de la cavité abdominale. La marche debout augmente la pression abdominale. Le plancher pelvien doit y faire face tout au long de sa vie, tout en permettant les fonctions physiologiques de miction, de défécation et de reproduction. La grossesse et les accouchements (surtout vaginaux) endommagent le plancher pelvien de manière aiguë, tandis que l’obésité, la toux chronique, les maladies pulmonaires ou la constipation surchargent le plancher pelvien de manière chronique. Les autres facteurs de risque sont la carence en œstrogènes, l’hystérectomie, une déficience cognitive, le tabagisme, le diabète sucré, l’hypertension artérielle et probablement une faiblesse héréditaire du tissu conjonctif [8]. Comme nombre de ces facteurs de risque augmentent avec l’âge et que l’allongement de l’espérance de vie entraîne une sollicitation prolongée du plancher pelvien, l’incontinence urinaire constitue un problème de santé, en particulier pour les personnes âgées. Les processus de vieillissement, tels que la modification de la proportion de tissu conjonctif musculaire au détriment de la proportion de muscle, semblent avoir une influence négative sur la fonction et la structure du plancher pelvien et donc sur le mécanisme complexe de continence. Chez la femme, l’urètre repose sur le fascia endopelvien et la paroi vaginale antérieure : il est suspendu latéralement à l’arcus tendineus fasciae pelvis et est tendu et stabilisé par le muscle lévator (théorie du hamac selon DeLancey) [9]. Cette couche de soutien est suspendue comme un trampoline en avant par les ligaments pubo-urétraux (suspension sous-urétrale), latéralement par l’arcus tendineus fasciae pelvis et dorsalement par les ligaments sacrouterina et cardinalia (théorie intégrale de Petros et Ulmsten) [10]. Ainsi, en cas d’augmentation de la pression intra-abdominale, l’urètre est pressé contre cette couche de soutien en forme de hamac et sa lumière est fermée. Des ligaments pubourethraux endommagés ou affaiblis peuvent entraîner une hypermobilité de l’urètre et, à terme, une incontinence à l’effort. Le principe des boudins d’incontinence vise à les corriger. La pression de fermeture urétrale due à la contraction du sphincter urétral contribue également au mécanisme de continence. Le nombre et le diamètre de ses fibres musculaires diminuent d’environ 2% par année de vie, ce qui explique l’observation en urodynamique de la diminution de la pression d’occlusion urétrale de repos avec l’âge sur le plan histomorphologique [11,12]. Des modifications correspondantes liées à l’âge sont également observées pour le compartiment antérieur du plancher pelvien [8].
Tout cela explique l’apparition de l’incontinence d’effort et de la descente génitale. Comme des récepteurs d’œstrogènes ont été mis en évidence dans l’épithélium pavimenteux de l’urètre proximal et distal, dans le vagin, dans le trigone vésical et également dans l’appareil de maintien du plancher pelvien (par exemple dans le muscle pubococcygien) chez les femmes préménopausées, la carence en œstrogènes est considérée comme coresponsable du développement d’une insuffisance du plancher pelvien chez les personnes âgées [13–16]. Les altérations nerveuses centrales et périphériques liées à l’âge, telles que la réduction des nerfs positifs à l’acétylcholinestérase et du nombre d’axones dans le muscle vésical, influencent à leur tour la miction avec le développement d’une OAB et entraînent également une diminution de l’activité électromyographique [17–21]. Cette dénervation est plus fréquente chez les femmes qui ont accouché, après une chirurgie du petit bassin ou en cas de neuropathie [22–24].
Diagnostic
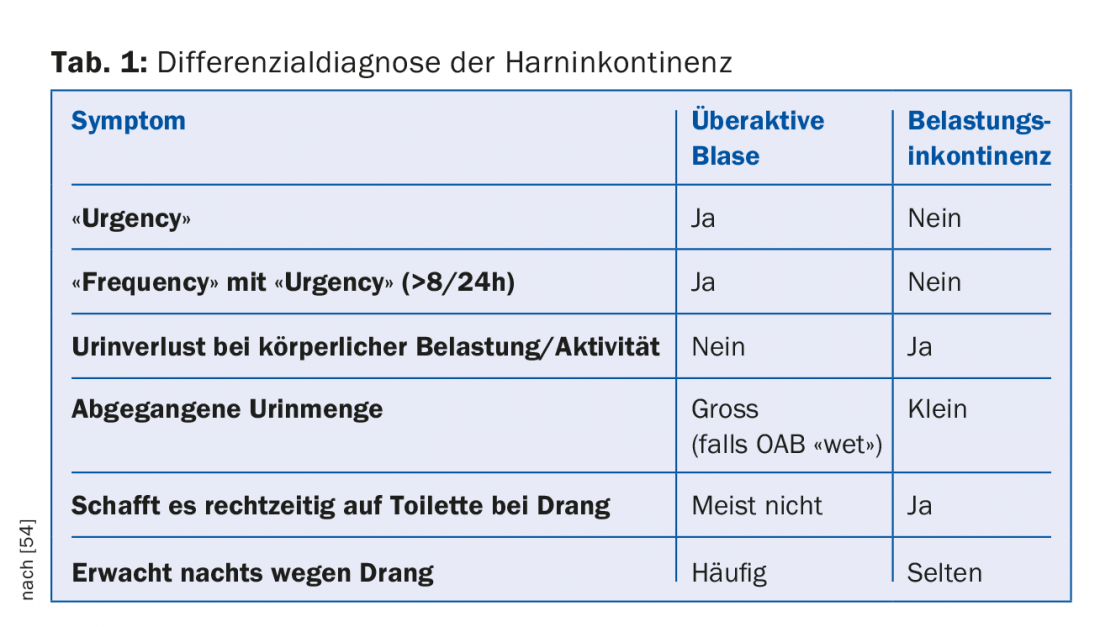
Même si la patiente n’aborde pas d’elle-même ce sujet tabou, l’anamnèse spécifique à l’incontinence doit néanmoins porter sur les situations de fuites urinaires, le besoin de protections, les troubles de la descente (les symptômes typiques sont une pression vaginale, une sensation de corps étranger ou des douleurs abdominales qui augmentent au cours de la journée et s’améliorent en position couchée), l’hématurie, les infections urogénitales, les accouchements (les accouchements par ventouse ou par voie basse sont plus souvent associés à des dysfonctionnements du petit bassin) et les traumatismes obstétricaux, les opérations ou les radiations du petit bassin, les maladies neurologiques et endocrinologiques, les troubles gastro-intestinaux, la prise de médicaments ainsi que les antécédents sexuels et fécaux. [25]. Un journal des mictions sur deux ou trois jours permet d’objectiver le comportement en matière de mictions et de boissons et facilite la distinction entre les différentes formes et causes d’incontinence (par ex. polydipsie ou nycturie isolée d’origine cardiaque) grâce à des indications claires sur la “fréquence”, les envies impérieuses d’uriner, les épisodes d’incontinence, la consommation de serviettes, la nycturie et la polyurie. Comme le montre le tableau 1, la distinction entre l’incontinence d’effort et l’OAB est possible dès l’anamnèse. L’acronyme “DIAPPERS” sert d’aide-mémoire pour exclure les causes possibles d’OAB : délire, infection (HWI), urétrite/vaginite atrophique, psychogène (dépression, névrose), pharmacothérapie, élimination urinaire excessive, mobilité réduite (“restricted”) et masse fécale dans le rectum (“stool impaction”) [26]. En cas de fuites urinaires continues après une intervention chirurgicale dans le petit bassin ou après un accouchement, il faut également penser à une fistule vésico-vaginale et l’exclure sur le plan urogynécologique.
L’exclusion d’une infection urinaire et d’une formation d’urine résiduelle est fondamentale lors de l’examen. Cela peut être fait dans le cabinet du médecin généraliste avec un test rapide de bandelettes urinaires et une culture d’urine ou un test d’urine. Échographie ou cathétérisme à usage unique faisable. Toute infection urinaire doit d’abord être traitée en fonction de la résistance avant de poursuivre les investigations, car chez les femmes âgées, elle n’est souvent associée qu’à des symptômes irritatifs de l’OAB tels que la “fréquence” ou la pollakiurie et l’incontinence urinaire, sans présence de symptômes typiques de l’IHE tels que l’algie ou la dysurie, et peut ainsi simuler une OAB (nouvellement apparue) [27]. D’une part, les OAB et les infections urinaires sont toutes deux fréquentes et de plus en plus fréquentes avec l’âge, et d’autre part, les symptômes d’infection urinaire ne sont pas toujours typiques chez les personnes âgées, ce qui rend le diagnostic plus difficile. Inversement, des troubles préexistants du SAO peuvent rendre difficile la détection d’une infection urinaire floride [28].
Des quantités d’urine résiduelle supérieures à 100 ml peuvent être la conséquence d’une descente génitale (troubles de la miction, par exemple en cas de cystocèle) ou être d’origine neurologique et nécessitent donc un examen urogynécologique plus approfondi. D’ailleurs, l’incontinence urinaire et la formation d’urine résiduelle ne sont pas incompatibles (incontinence par regorgement) ; des quantités élevées d’urine résiduelle peuvent favoriser l’apparition d’IHE.
Une descente génitale peut être rapidement évaluée grâce au réglage du spéculum : En règle générale, un abaissement de la paroi antérieure (vessie), postérieure (rectum) ou apicale du vagin ou de l’anus doit être détecté. utérus au-delà de la marge hyménale en direction distale entraîne des symptômes. La trophicité génitale peut être évaluée à l’aide de bandelettes de test pH (papier Lakmus) ou en natif : Un pH ≥4,5 indique – si une infection est exclue – une atrophie génitale. Le natif montre alors presque uniquement des cellules parabasales, en plus d’éventuels signes d’inflammation. Si la vessie n’est pas vide, le test de la toux peut être effectué immédiatement : Une émission d’urine synchronisée avec la toux et visible sur le méat urétral externe prouve cliniquement l’incontinence d’effort. Toutefois, un test de toux négatif n’exclut pas l’incontinence.
En cas d’échec des mesures conservatrices, avant un traitement chirurgical, en cas d’antécédents complexes ou de maladies neurologiques, mais aussi pour toute incontinence inexpliquée ou renouvelée, nous recommandons de poursuivre le bilan urogynécologique et urodynamique pour objectiver et quantifier les symptômes d’incontinence urinaire, ce qui est également utile chez les patientes âgées [29]. Il s’agit notamment de l’urodynamique par cysto- et uréthrotonométrie et mictimétrie, complétée par l’échographie périnéale (visualisation de l’urètre et du col vésical avec une sonde abdominale placée sur le périnée) et, le cas échéant, par la cystoscopie. Cet examen urogynécologique et urodynamique est une prestation obligatoire de l’assurance maladie.
Grâce à un diagnostic urodynamique plus précis, il est possible de mieux évaluer le succès de l’opération et de fournir des informations préopératoires individualisées aux patientes. Ainsi, les patientes idéales pour une boucle d’incontinence présentent un profil de pression urétrale normal et un urètre mobile. En revanche, les facteurs défavorables sont une pression d’occlusion urétrale maximale préopératoire basse (<20 cm H2O), des contractions pathologiques du détrusor apparaissant lors de la cystométrie de remplissage (>25 cm H2O) et, surtout, l’association d’une pression d’occlusion urétrale basse et d’une urètre immobile (insuffisance sphinctérienne intrinsèque).
Approche thérapeutique
Chez les patientes post-ménopausées, nous recommandons l’œstrogénisation locale pour toutes les formes d’incontinence. L’hormonothérapie orale systémique dans le traitement de l’IUE a montré une aggravation des symptômes d’incontinence dans l’étude HERS ; cependant, les données sont moins claires en ce qui concerne l’œstrogénisation locale [30–32]. On ne peut nier la réduction de l’incidence des infections urinaires de 5,9 à 0,5 par an et la normalisation de la flore vaginale par l’estriol intravaginal chez les femmes ménopausées [33].
Étant donné que l’âge semble être le facteur prédictif le plus important pour le développement de l’incontinence d’effort, bien plus que le statut ménopausique, l’intérêt d’une substitution œstrogénique pourrait être la prévention ou le traitement de l’incontinence d’effort. dans le report de la symptomatologie [34–38].
La physiothérapie pour la rééducation du plancher pelvien est utile en cas d’IUE et d’OAB. Nous avons pu montrer des taux de réussite comparables pour les patientes jeunes et âgées [39]. Dans le cas de l’OAB, la thérapie comportementale avec entraînement de la vessie pour augmenter progressivement les quantités d’urine ou la fréquence des mictions est également nécessaire. L’augmentation de l’intervalle et la tenue d’un calendrier mictionnel pour l’autocontrôle font partie du traitement. En ce qui concerne la gestion des fluides, il faut veiller à boire environ 1,5 l par jour, réparti en quatre portions.
Les anticholinergiques sont considérés comme une pharmacothérapie de première ligne pour l’OAB. Ils réduisent le besoin impérieux d’uriner de 50%, les épisodes d’incontinence de 70% (0,6 épisode d’incontinence par jour), la “fréquence” de 20-30% et améliorent la qualité de vie [40]. Les effets apparaissent au bout d’une semaine et atteignent leur maximum après huit à douze semaines. Cependant, l’observance est mauvaise : au bout de six à douze mois, seul un cinquième prend le médicament, soit parce qu’il est insuffisamment efficace, soit parce qu’il provoque des effets secondaires intolérables tels que la sécheresse de la bouche dans 25% des cas, la constipation dans 10% des cas et des troubles centraux tels que les nausées, la fatigue, le manque de concentration et une vision floue dans jusqu’à 12% des cas. Les contre-indications aux anticholinergiques sont par exemple le glaucome à angle fermé non traité, les sténoses du tractus gastro-intestinal ou les arythmies cardiaques tachycardiques. Les agonistes des récepteurs adrénergiques B3, qui relaxent directement le détrusor vésical, constituent une nouvelle classe de médicaments dont le mécanisme d’action est différent. Leur effet est comparable à celui des anticholinergiques, mais sans effets secondaires anticholinergiques. Les effets secondaires les plus fréquents sont l’hypertension, les infections urinaires, les maux de tête et la rhinopharyngite.
Les pessaires et tampons d’incontinence constituent une alternative viable pour les patientes motivées. La patiente insère elle-même ces dispositifs par voie vaginale pendant la journée si nécessaire et les retire le soir. Pour toute incontinence urinaire, il ne faut pas oublier les protections contre l’incontinence, en vente libre dans le commerce, qui sont remboursées en Suisse par les caisses-maladie de manière variable selon le degré de gravité (Liste des moyens et appareils LiMA 15.01-15.07).
Traitement chirurgical de l’incontinence d’effort
L’étalon-or du traitement chirurgical de l’incontinence d’effort chez la femme avec urètre (hyper)mobile est aujourd’hui l’anse vaginale sans tension. En nous basant sur les résultats de nos propres études, nous préférons la méthode originale : le “tension-free vaginal tape” (TVT) rétropubien développé par Ulmsten et Petros et introduit en 1995 [41–43]. Cette technique d’anse peu invasive implique l’implantation d’une bande de polypropylène non résorbable, macroporeuse et monofilamentaire, sous anesthésie locale et analgésie, à travers une 1 Le colpotomie sous-urétrale d’une longueur de 1 cm au niveau de la partie médiane de l’urètre (midurethra) est introduite derrière la symphyse à l’aide d’aiguilles spéciales et est ensuite évacuée par voie rétropubienne vers la paroi abdominale, juste au-dessus de la symphyse, à partir de deux incisions de piqûre suprasymphysaires. On parle donc d’anses “miuréthrales” ou “sous-uréthrales”. Les termes sont utilisés ici comme synonymes. Le principe d’action consiste à renforcer l’ancrage pubo-urétral affaibli et à stabiliser le midurethra, mais sans l’élever ni l’obstruer. L’intervention est réalisée dans le cadre d’une hospitalisation de courte durée. Le taux de guérison objectif est de 90% [44]. Le guidage rétropubien de la bande explique les complications peropératoires possibles telles que la perforation de la vessie, les lésions intestinales ou les hémorragies, raison pour laquelle la procédure transobturatrice a été développée pour les réduire [45,46]. En postopératoire, il faut s’attendre à environ 5% de troubles mictionnels et environ 7% de troubles urinaires de novo.
Lorsque l’urètre est peu mobile voire fixe et hypotonique, on parle d’insuffisance sphinctérienne intrinsèque. Cette forme d’incontinence d’effort se manifeste par exemple comme une incontinence récurrente après une opération de l’incontinence, ce qui a rendu l’urètre rigide et hypotonique. Son pronostic est plus difficile à traiter. C’est là qu’intervient l’injection péri-urétrale d'”agents de bulking” : Ceux-ci dilatent localement le tissu péri-urétral et rétrécissent l’urètre, augmentant ainsi la transmission de la pression dans l’urètre proximal ou moyen [47]. Comme cette technique est nettement moins invasive que le TVT et qu’elle peut être réalisée sous anesthésie locale, elle convient également comme traitement pour les patientes multimorbides. Toutefois, les taux de réussite (76% à un an et 48% à deux ans) sont nettement inférieurs à ceux de la TVT et les “agents de bulking” ne sont pas remboursés.
La neurotoxine botulique dans le traitement de l’hyperactivité vésicale
En cas d’hyperactivité vésicale idiopathique ou neurogène réfractaire, soit en raison d’effets secondaires anticholinergiques ou B3-sympathomimétiques intolérables des médicaments, soit en raison de contre-indications à un traitement médicamenteux, la neurotoxine botulique peut être injectée dans le muscle vésical et sous l’urothélium sous anesthésie locale ou sous anesthésie générale et sous visualisation cystoscopique [48,49]. En règle générale, 100 unités de type A (Botox®) sont injectées en cas d’OAB idiopathique. En Suisse, cette thérapie est obligatoire en cas d’OAB réfractaire, à condition qu’elle soit pratiquée dans un centre ou une clinique. évalué et mis en œuvre avec l’expertise appropriée. La neurotoxine botulique de type A empêche la libération d’acétylcholine au niveau de la plaque terminale motrice. Cette chimiodénervation est réversible et dure environ trois mois au niveau des efférences des muscles striés squelettiques et huit à dix mois au niveau des muscles lisses (muscle détrusor vesicae), mais elle concerne également les afférences. La patiente ressent de plus en plus l’effet à partir du deuxième jour [50]. Après deux semaines, l’urine résiduelle doit être contrôlée. Celui-ci peut occasionnellement atteindre plusieurs centaines de millilitres pendant quelques semaines ou mois ; si des troubles de la miction ou des infections urinaires surviennent en plus, le (auto)cathétérisme doit être effectué. Dans le cas contraire, l’urine résiduelle peut être contrôlée de manière étroite. En effet, l’effet de la chimiodénervation diminue au fil des semaines et des mois, parmi lesquels le volume d’urine résiduelle se normalise. Les taux de réussite mesurés par la réduction des épisodes d’incontinence varient de 67 à 100% pour l’OAB idiopathique, selon les études [51]. L’étude prospective multicentrique suisse a montré une amélioration statistiquement significative de la fonction vésicale et de la qualité de vie dans 88% des cas [49]: après deux semaines déjà, 82% des patients étaient libérés des symptômes d’urgence et 86% de l’incontinence, et la fréquence mictionnelle était pratiquement normalisée avec une récupération correspondante de la capacité maximale de la vessie. Son utilisation est contre-indiquée en cas de tumeurs malignes de la vessie, de grossesse et d’allaitement, d’insuffisance rénale et d’infection urinaire floride. Nous sommes également très réticents à l’égard du diabète sucré. Les réinjections en cas de perte d’efficacité doivent être effectuées au plus tôt après trois mois afin d’éviter la formation d’anticorps. Dans la pratique clinique quotidienne, nous constatons que nous ne devons répéter les injections de Botox qu’après un ou deux ans.
Messages Take-Home
- L’évaluation et le traitement de l’incontinence urinaire ne diffèrent que très peu entre les patients jeunes et âgés.
- Pour toute nouvelle incontinence urinaire, il convient de toujours exclure une infection des voies urinaires et une augmentation de l’urine résiduelle.
- Alors que l’incontinence d’effort est traitée chirurgicalement (ou mécaniquement), l’hyperactivité vésicale est traitée en premier lieu par des médicaments.
- Un examen urogynécologique et urodynamique est indiqué au plus tard en l’absence de succès des mesures conservatrices telles que les anticholinergiques ou la physiothérapie.
Littérature :
- Hannestad YS, et al : A community-based epidemiological survey of female urinary incontinence : the Norwegian EPINCONT study. Épidémiologie de l’incontinence dans le comté de Nord-Trondelag. J Clin Epidemiol 2000 ; 53(11) : 1150-1157.
- Buckley BS, et al. : Prevalence of urinary incontinence in men, women, and children–current evidence : findings of the Fourth International Consultation on Incontinence. Urologie 2010 ; 76(2) : 265-270.
- Olsen AL, et al : Épidémiologie des prolapsus d’organes pelviens et des incontinences urinaires traités par voie chirurgicale. Obstet Gynecol 1997 ; 89(4) : 501-506.
- Abrams P, et al : The standardisation of terminology in lower urinary tract function : Report from the standardisation sub-committee of the International Continence Society. Urologie 2003 ; 61(1) : 37-49.
- Hunskaar S, et al. : The prevalence of urinary incontinence in women in four European countries. BJU Int 2004 ; 93(3) : 324-330.
- Hu TW, et al. : Coûts de l’incontinence urinaire et de la vessie hyperactive aux États-Unis : une étude comparative. Urologie 2004 ; 63(3) : 461-465.
- Klotz T, et al : The economic costs of overactive bladder in Germany. Eur Urol 2007 ; 51(6) : 1654-1662 ; discussion 62-63.
- Scheiner D, Betschart C, Perucchini D : [Aging-related changes of the female pelvic floor]. Ther Umsch 2010 ; 67(1) : 23-26.
- DeLancey JO : Support structurel de l’urètre en rapport avec l’incontinence urinaire d’effort : l’hypothèse du hamac. Am J Obstet Gynecol 1994 ; 170(6) : 1713-1720 ; discussion 20-23.
- Petros PE, Ulmsten UI : Une théorie intégrale de l’incontinence urinaire féminine. Considérations expérimentales et cliniques. Acta Obstet Gynecol Scand Suppl 1990 ; 153 : 7-31.
- Perucchini D, et al : Effets de l’âge sur le muscle strié urétral. I. Changes in number and diameter of striated muscle fibers in the ventral uretra. American Journal of Obstetrics and Gynecology 2002 ; 186(3) : 351-355.
- Rud T : Profil de pression urétrale chez les femmes continentales de l’enfance à la vieillesse. Acta Obstet Gynecol Scand 1980 ; 59(4) : 331-335.
- Iosif CS, et al : Récepteurs d’estrogènes dans le tractus urinaire inférieur féminin humain. Am J Obstet Gynecol 1981 ; 141(7) : 817-820.
- Blakeman P, Hilton P, Bulmer J : Cartographie des récepteurs d’œstrogènes et de progestérone à travers le tractus urinaire féminin. Neurourol Urodyn 1996 ; 15 : 324-325.
- Ingelman-Sundberg A, et al : Récepteurs d’œstrogènes cytosoliques dans les tissus urogénitaux chez les femmes en état de stress. Acta Obstet Gynecol Scand 1981 ; 60(6) : 585-586.
- Smith P : Estrogens and the urogenital tract. Études sur les récepteurs d’hormones stéroïdes et étude clinique d’un nouvel anneau vaginal libérant de l’estradiol. Acta Obstet Gynecol Scand Suppl 1993 ; 157 : 1-26.
- Griffiths DJ, et al : Urge incontinence et impuissance contractile du détrusor chez les personnes âgées. Neurourol Urodyn 2002 ; 21(2) : 126-131.
- Griffiths DJ, et al : Characteristics of urinary incontinence in elderly patients studied by 24-hour monitoring and urodynamic testing. Age Ageing 1992 ; 21(3) : 195-201.
- Griffiths DJ, et al : Cerebral aetiology of urinary urge incontinence in elderly people. Age Ageing 1994 ; 23(3) : 246-250.
- Gilpin SA, et al : The effect of age on the autonomic innervation of the urinary bladder. Br J Urol 1986 ; 58(4) : 378-381.
- Aukee P, Penttinen J, Airaksinen O : L’effet du vieillissement sur l’activité électromyographique des muscles du plancher pelvien. A comparative study among stress incontinent patients and asymptomatic women. Maturitas 2003 ; 44(4) : 253-257.
- Olsen AL, et al : Pelvic floor nerve conduction studies : establishing clinically relevant normative data. American Journal of Obstetrics and Gynecology 2003 ; 189(4) : 1114-1119.
- Allen RE, et al. : Lésions du plancher pelvien et accouchement : une étude neurophysiologique. Br J Obstet Gynaecol 1990 ; 97(9) : 770-779.
- Bidmead J, Cardozo LD : Modifications du plancher pelvien chez la femme âgée. Br J Urol 1998 ; 82(Suppl 1) : 18-25.
- Betschart C, Scheiner DA, Perucchini D : No 1 : Bilan en cas d’incontinence urinaire et de descente génitale. Gynécologie 2012.
- Resnick NM : Incontinence urinaire. Public Health Rep 1987 ; 102(4 Suppl) : 67-70.
- Arinzon Z, et al : La présentation clinique des infections du tractus urinaire (IU) diffère avec le vieillissement chez les femmes. Arch Gerontol Geriatr 2012 ; 55(1) : 145-147.
- Mirsaidov N, Wagenlehner FM : [Urinary tract infections in the elderly]. Urologue A 2016 ; 55(4) : 494-498.
- Resnick NM, Yalla SV, Laurino E : The pathophysiology of urinary incontinence among institutionalized elderly persons. N Engl J Med 1989 ; 320(1) : 1-7.
- Grady D, et al : Hormones post-ménopausiques et incontinence : l’étude Heart and Estrogen/Progestin Replacement. Obstet Gynecol 2001 ; 97(1) : 116-120.
- Hendrix SL, et al. : Effets des œstrogènes avec et sans progestin sur l’incontinence urinaire. JAMA 2005 ; 293(8) : 935-948.
- Steinauer JE, et al. : Traitement hormonal post-ménopausique : provoque-t-il des incontinences ? Obstet Gynecol 2005 ; 106(5 Pt 1) : 940-945.
- Raz R, Stamm WE : A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. N Engl J Med 1993 ; 329(11) : 753-756.
- van Geelen JM, Hunskaar S : The epidemiology of female urinary incontinence. European Clinics in Obstetrics and Gynaecology 2005 ; 1(1) : 3-11.
- Iosif CS, Bekassy Z : Prévalence des symptômes génito-urinaires à la fin de la ménopause. Acta Obstet Gynecol Scand 1984 ; 63(3) : 257-260.
- Hilton P : Urethral pressure measurement by microtransducer : observations on the methodology, the pathophysiology of stress incontinence and the effects of treatment in the female (MD Thesis). Université de Newcastle-upon-Tyne 1981.
- Jolleys JV : Prévalence rapportée de l’incontinence urinaire chez les femmes dans un cabinet de médecine générale. Br Med J (Clin Res Ed) 1988 ; 296(6632) : 1300-1302.
- Fantl JA, Cardozo L, McClish DK : Estrogen therapy in the management of urinary incontinence in postmenopausal women : a meta-analysis. Premier rapport du Comité sur les hormones et la thérapie urogénitale. Obstet Gynecol 1994 ; 83(1) : 12-18.
- Betschart C, et al : Pelvic floor muscle training for urinary incontinence : a comparison of outcomes in premenopausal versus postmenopausal women. Female Pelvic Med Reconstr Surg 2013 ; 19(4) : 219-224.
- Wein AJ, Rackley RR : Vessie hyperactive : une meilleure compréhension de la physiopathologie, du diagnostic et de la prise en charge. The Journal of Urology 2006 ; 175(3) : S5-S10.
- Ulmsten U, Petros P : Intravaginal slingplasty (IVS) : an ambulatory surgical procedure for treatment of female urinary incontinence. Scand J Urol Nephrol 1995 ; 29(1) : 75-82.
- Scheiner DA, et al : Twelve months effect on voiding function of retropubic compared with outside-in and inside-out transobturator midurethral slings. Int Urogynecol J 2012 ; 23(2) : 197-206.
- Betschart C, et al. : Satisfaction du patient après slings rétropubiens et transobturateurs : première évaluation à l’aide du Questionnaire sur les résultats de l’incontinence (IOQ). Int Urogynecol J 2011 ; 22(7) : 805-812.
- Nilsson CG, et al. : Seventeen years’ follow-up of the tension-free vaginal tape procedure for female stress urinary incontinence. Int Urogynecol J 2013 ; 24(8) : 1265-1269.
- Delorme E : [Transobturateur de suspension urétrale : procédure mini-invasive dans le traitement de l’incontinence urinaire d’effort chez la femme]. Prog Urol 2001 ; 11(6) : 1306-1313.
- de Leval J : Nouvelle technique chirurgicale pour le traitement de l’incontinence urinaire d’effort féminine : Transobturator Vaginal Tape Inside-Out. Urologie européenne 2003 ; 44(6) : 724-730.
- Kuhn A, et al : Où faut-il injecter les agents de stimulation pour l’incontinence urodynamique de stress chez la femme ? Int Urogynecol J Pelvic Floor Dysfunct 2008 ; 19(6) : 817-821.
- Schurch B, Schmid DM, Stohrer M : Traitement de l’incontinence neurogène par la toxine botulique A. N Engl J Med 2000 ; 342(9) : 665.
- Schmid DM, et al. : Expérience de 100 cas traités par injections de toxine botulique A dans le muscle détrusor pour le syndrome de vessie hyperactive idiopathique réfractaire aux anticholinergiques. J Urol 2006 ; 176(1) : 177-185.
- Kalsi V, et al : Effet précoce sur les symptômes d’hyperactivité vésicale suite à des injections de neurotoxine botulique de type A pour l’hyperactivité du détrusor. Eur Urol 2008 ; 54(1) : 181-187.
- Schurch B : Botulinum toxin for the management of bladder dysfunction. Drogues 2006 ; 66(10) : 1301-1318.
- Fialkow MF, et al : Lifetime risk of surgical management for pelvic organ prolapse or urinary incontinence. Int Urogynecol J Pelvic Floor Dysfunct 2008 ; 19(3) : 437-440.
- Smith FJ, et al : Risque à vie de subir une intervention chirurgicale pour un prolapsus d’organe pelvien. Obstet Gynecol 2010 ; 116(5) : 1096-1100.
- Abrams P, Wein AJ : La vessie hyperactive : une condition généralisée et traitable. Erik Sparre Medical AB 1998.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(5) : 16-22