“Il est plus important de savoir quelle personne a une maladie que de savoir quelle maladie a une personne” – cette phrase est attribuée à Hippocrate, ce qui signifie que le Grec ancien connaissait déjà le bien-fondé d’une thérapie personnalisée il y a environ 2400 ans. Des études sont en cours pour déterminer dans quelle mesure une telle approche peut également aider en rhumatologie à identifier précocement les patients à risque de PR et à les traiter de manière ciblée.
Le concept de médecine “taille unique”, c’est-à-dire le déroulement standardisé de la thérapie indépendamment des particularités de chaque patient, entraîne naturellement toujours une proportion relativement élevée d’effets secondaires (graves) et de non-répondeurs. Les effets de la médecine personnalisée, basée sur le diagnostic moléculaire (analyse des biomarqueurs) et la stratification des patients sur la base des biomarqueurs, devraient permettre de les réduire et d’augmenter le taux de répondeurs.
La liste des médicaments dont l’utilisation est soumise à un test génétique en Allemagne s’étend sur 29 pages sur le site web de l’Association des fabricants de médicaments de recherche (vfa). Les maladies rhumatismales ne figurent pas encore sur cette liste. Andrea Rubbert-Roth, de la clinique de rhumatologie de l’hôpital cantonal de Saint-Gall, que la médecine personnalisée n’a pas encore réussi à s’imposer dans le domaine de la rhumatologie.
On sait qu’il existe une prédisposition génétique à la polyarthrite rhumatoïde (PR), en plus de facteurs environnementaux tels que le tabagisme, les poussières et les fibres textiles. En 2007 déjà, une grande analyse de données portant sur 14 000 patients et 3 000 témoins de 7 maladies a montré que dans le cas de la PR, deux gènes, HLA et PTPN22, se distinguent. Le professeur Rubbert-Roth a rappelé l’hypothèse appelée Shared Epitope (SE), selon laquelle les allèles HLA-DRB1 associés à la PR codent pour une séquence commune d’acides aminés dans la 3e région hypervariable de la chaîne DRβ1.
Les patients SE-positifs bénéficient davantage
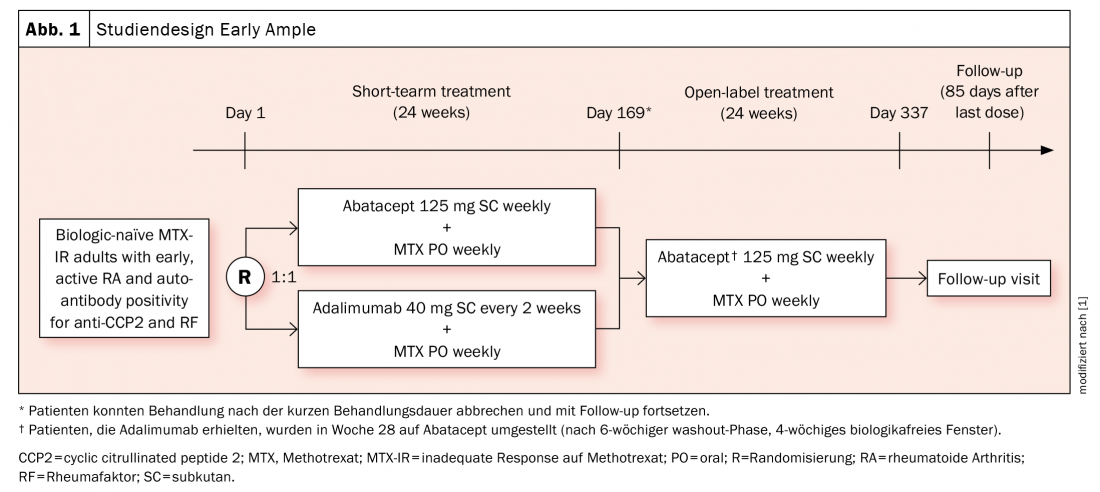
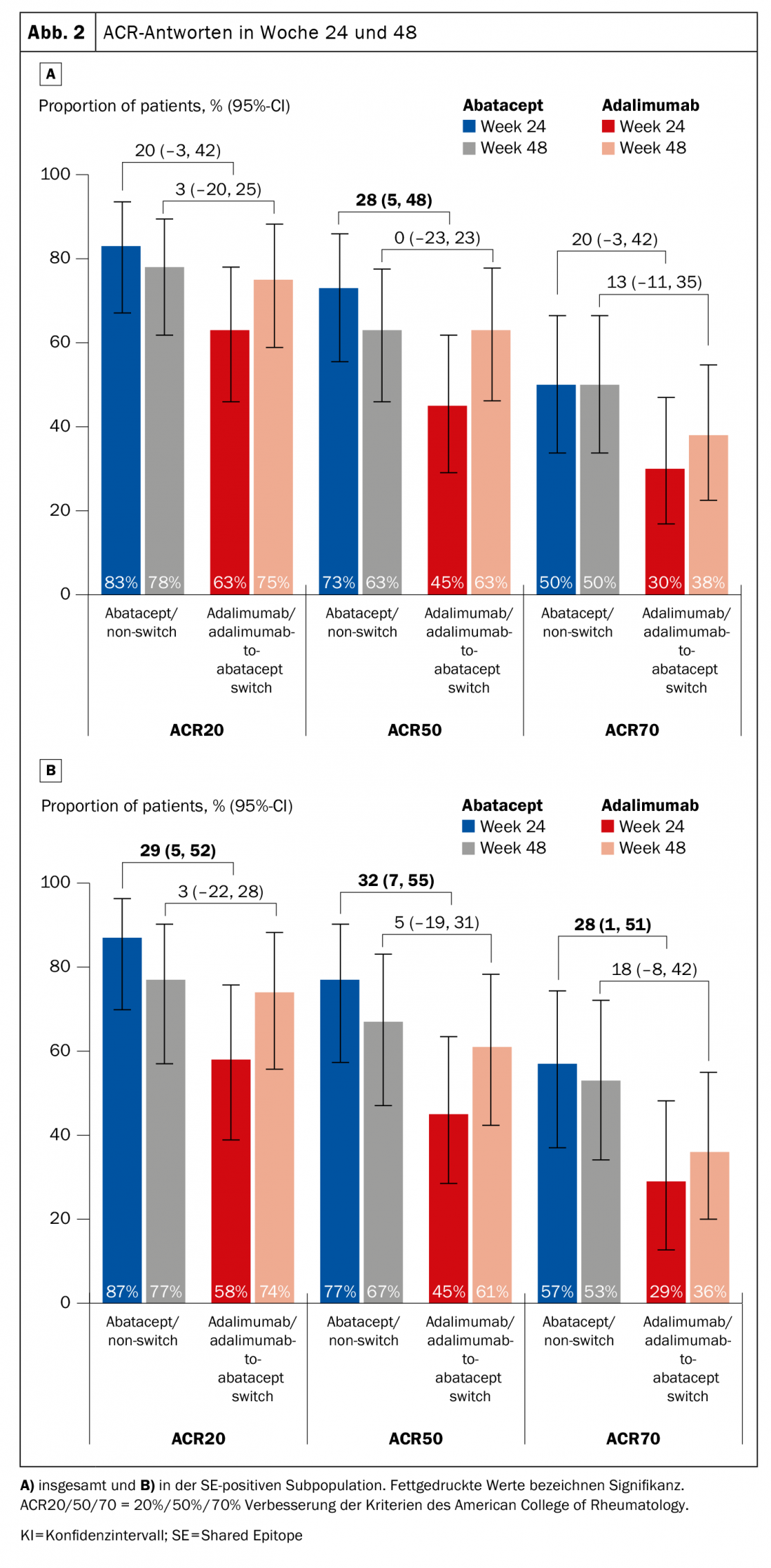
Des évaluations antérieures ont fourni des indications selon lesquelles les patients HLA-DRB1 positifs répondent mieux à l’abatacept (ce qui ne signifie pas que cela ne peut pas s’appliquer à d’autres molécules, comme l’a souligné l’experte). L’étude de phase 4 Early Ample [1], publiée en 2021, se fonde sur ce principe et a réparti les patients atteints de PR précoce naïve sur le plan biologique et n’ayant pas suffisamment répondu au méthotrexate (MTX) dans un bras abatacept (n=39, dont 30 SE-positifs) et un bras adalimumab (n=40, dont 31 SE-positifs) (figure 1). Les personnes concernées devaient être positives au CCP2 et au facteur rhumatoïde. Pendant 24 semaines, les sujets ont été randomisés pour recevoir soit l’ABA soit l’ADA, puis tous ont été convertis à l’ABA. Il s’est avéré que les patients HLA-DRB1 positifs avaient déjà de bien meilleures chances d’obtenir un ACR20, -50 et -70 avec l’abatacept après 24 et 48 semaines (figure 2A). Le résultat est encore plus marqué en faveur de la sous-population SE+ (figure 2B).
Peut-on prévenir la PR chez les patients à risque ?
On sait que les patients qui n’ont pas encore de synovite cliniquement identifiable, mais qui ont déjà des anticorps anti-CCP détectables, présentent un risque accru de développer une PR. L’étude ARIAA, qui sera présentée lors du congrès ACR 2021, vise à déterminer s’il est possible de prévenir précocement l’évolution vers la PR dans ce groupe et, le cas échéant, de quelle manière [2]. Les critères d’inclusion pour cette étude de phase 2 étaient la positivité à l’ACPA (+/- RF), des arthralgies pendant au moins 6 semaines, des signes d’inflammation de la main dominante (synovite, ténosynovite ou ostéite) à l’IRM, mais pas de gonflement clinique, et l’absence de traitement antérieur par stéroïdes ou DMARD. 49 patients ainsi identifiés ont été traités par abatacept versus placebo sur une période de 6 mois (n=49). Cette étude a été suivie d’une période de suivi de 12 mois sans traitement.
Le critère d’évaluation principal, à savoir l’amélioration d’au moins un paramètre IRM (score RAMRIS), a été atteint : une amélioration significative a été observée chez 61,2% des patients dans le bras abatacept (contre 30,6% sous placebo ; p=0,0043). Pour les critères d’évaluation secondaires, l’arrêt prématuré de l’étude et la progression vers la PR clinique, le groupe sous traitement a également obtenu des résultats significativement meilleurs (arrêt 14,3% vs 42,9% ; p=0,0032 ; progression 8,2% vs 34,7% ; p=0,0025). Le bénéfice de l’abatacept par rapport au placebo est donc clairement visible et le professeur Rubbert-Roth espère que les autres résultats du suivi à long terme seront présentés dès le prochain EULAR. “Si les résultats étaient confirmés sur la période de suivi, ce serait vraiment spectaculaire”, conclut-elle.
Messages Take-Home
- La mise en œuvre de nouveaux concepts d’études intégrant une stratégie personnalisée peut également contribuer à optimiser l’efficacité et la sécurité d’un traitement DMARD en rhumatologie.
- Preuve de principe : l’idéal serait à l’avenir de disposer de biomarqueurs facilement accessibles et simples à déterminer.
- Possibilité d’appliquer ce concept à d’autres maladies rhumatologiques ? (par exemple, signature interféron dans le LED)
Littérature :
- Rigby W, Buckner JH, Louis Bridges S, et al : HLA-DRB1 risk alleles for RA are associated with differential clinical responsiveness to abatacept and adalimumab : data from a head-thead, randomized, single-blind study in autoantibody-positive early RA. Arthritis Res Ther 2021 ; 23 : 245 ; doi : 10.1186/s13075-021-02607-7.
- Rech J, et al : ACR 2021 [#0455].
InFo DOULEUR & GERIATRIE 2022 ; 4(1-2) : 20-21