Le symposium sur la sclérose en plaques qui s’est tenu à l’hôpital de l’Île à Berne a donné un large aperçu de l’épidémiologie, de l’étiologie, de l’évolution, de l’évaluation et de la pharmacothérapie actuelle de cette affection. Des résultats passionnants sont issus de la recherche fondamentale, qui a identifié la cytokine GM-CSF comme nouvelle cible thérapeutique potentielle. Dans le cadre de l’enquête sur le handicap dans la SEP, des outils électroniques sont actuellement à l’étude et pourraient contribuer à la standardisation à l’avenir. La pharmacothérapie reste un vaste domaine – le profil des effets secondaires sert principalement à la prise de décision.
Le Dr Christian Kamm, de la clinique universitaire de neurologie de l’Hôpital de l’Île à Berne, a présenté brièvement l’épidémiologie de la sclérose en plaques (SEP). La SEP est une maladie inflammatoire chronique du système nerveux central (maladie auto-immune). Elle se compose généralement d’une première phase de réactions inflammatoires qui conduisent à des poussées. Ensuite, généralement après 15-20 ans, vient la deuxième phase dégénérative secondairement progressive (parfois encore masquée par des poussées).
En moyenne, les personnes atteintes ont environ 30 ans (pic d’incidence entre 20 et 40 ans). La prévalence est de 83/100 000 en Europe – elle a augmenté ces dernières années en raison de l’allongement de l’espérance de vie des patients atteints de SEP et des progrès réalisés en matière de diagnostic. Les femmes sont généralement touchées un peu plus tôt (deux à cinq ans) et aussi plus fréquemment. “L’étiologie exacte reste incertaine, mais les facteurs environnementaux et génétiques jouent un rôle clé”, a déclaré le conférencier. Les influences environnementales se traduisent parfois par une répartition différente de la maladie en fonction de la latitude : plus on se rapproche de l’équateur, plus le risque de SEP diminue, ce qui s’explique parfois par le métabolisme de la vitamine D [1]. L’effet d’une substitution en vitamine D reste encore incertain, mais il fait actuellement l’objet de plusieurs études (l’étude SOLAR sera bientôt terminée).
Les comorbidités vasculaires (tabagisme, etc.) aggravent également considérablement l’évolution. De plus en plus, leur nombre est associé à un risque accru de progression du handicap, de passage à la phase secondairement progressive, ainsi qu’à la progression et à la gravité de la maladie en général. Les infections jouent également un rôle. L’un des déclencheurs connus de la sclérose en plaques est le virus d’Epstein-Barr. Les enfants et les adolescents sont particulièrement vulnérables aux facteurs de risque environnementaux. Les personnes qui contractent la mononucléose infectieuse à la fin de l’adolescence ont un risque plus élevé de développer une SEP.
La composante génétique se traduit parfois par une plus grande fréquence de la maladie chez les parents d’un patient par rapport à la population générale (le risque relatif chez les parents au premier degré est d’environ 9,2). Il existe des corrélations avec ce que l’on appelle l’antigène leucocytaire humain (HLA). Des études de population ont en outre montré que la fréquence des maladies diffère également entre des ethnies exposées à des influences environnementales comparables.
GM-CSF, une nouvelle cible thérapeutique ?
Prof. Dr. rer. nat. Burkhard Becher, de l’Institut d’immunologie expérimentale de l’Université de Zurich, a notamment évoqué le rôle de la cytokine GM-CSF, qui favorise l’inflammation. Ce dernier est essentiel pour le développement de la SEP chez la souris. Afin de clarifier le rôle du GM-CSF dans la pathogenèse de la SEP humaine, on a analysé le sang de patients atteints de SEP ou de donneurs sains, isolé les globules blancs et analysé les cytokines produites. Les études mettent en évidence que le nombre de cellules T produisant du GM-CSF est fortement augmenté chez les patients atteints de SEP. De plus, plus l’activité de la maladie est intense, plus les cellules produisent du GM-CSF. Celle-ci est induite par l’interleukine 2 (IL-2), ce qui fait du récepteur de l’IL-2 un agent de risque de la SEP. Il a donc été démontré que les donneurs sains présentant ce gène à risque (polymorphisme du gène du récepteur α de l’IL-2) ont plus de cellules T produisant du GM-CSF que les donneurs ne présentant pas ce gène à risque [2]. Mais comment transposer ce constat à la clinique ? “Par exemple, avec un anticorps contre le GM-CSF comme le MOR103 [3]”, a expliqué le professeur Becher. “L’avenir nous dira si nous avons affaire à un nouveau candidat pour le traitement de la SEP”.
Handicaps liés à la SEP – comment les mesurer ?
Les handicaps liés à la sclérose en plaques ont fait l’objet d’une présentation par le Dr Christian Kamm, de la clinique universitaire de neurologie de l’Hôpital de l’Île à Berne. La soi-disant “no evidence of disease activity” (NEDA) est actuellement définie par trois paramètres : absence de poussée, absence de progression de l’EDSS, absence d’activité IRM. L’intégration des facteurs “atrophie cérébrale” et “cognition” dans ce concept est parfois discutée. L’échelle Expanded Disability Status Scale (EDSS) reste l’étalon-or pour mesurer le handicap dans la SEP (standardisée électroniquement sur neurostatus.net). Sept systèmes fonctionnels (visuel, tronc cérébral, pyramidal, cervelet, sensoriel, intestin/vessie, fonction mentale) permettent d’évaluer la sévérité du handicap. A cela s’ajoutent des informations sur la capacité de marche. L’échelle commence à 0 et va jusqu’à 10. Les faiblesses de l’EDSS sont : La variabilité de l’examen neurologique, de la perception de l’examinateur et les limites naturelles de la perception humaine. Des outils d’évaluation numériques (par ex. avec la caméra Kinect®) sont actuellement à l’étude et pourraient permettre à l’avenir d’évaluer les fonctions motrices dans la SEP de manière plus précise et standardisée (projet ASSESS-MS).
A partir d’une valeur de 4,5, l’EDSS ne prend presque plus en compte que la distance de marche et présente donc certaines limites auxquelles on peut remédier par des tests supplémentaires. Par exemple, la capacité fonctionnelle des membres supérieurs doit être testée séparément, car elle est de plus en plus limitée dans les cas d’EDSS avancés. Le test Nine-Hole-Peg (9HPT) évalue le temps nécessaire au patient pour placer neuf broches dans des trous prévus à cet effet et pour les retirer ensuite. Selon l’intervenant, ce test est fiable, valide et suffisamment sensible pour évaluer la dextérité manuelle chez les patients atteints de SEP. Il existe des données normalisées selon l’âge, le sexe et le fait d’être droitier ou gaucher [4]. Alors que le 9HPT nécessite encore divers ustensiles, la tâche de rotation des pièces (CRT) développée à Berne ne requiert qu’une pièce de 50 centimes. Pour ce faire, les patients doivent faire tourner la pièce de monnaie le plus rapidement possible entre le pouce, l’index et le majeur (plus de 19 s pour 20 demi-tours est pathologique) [5]. “Le CRT est comparable au 9HPT et au test ARAT (Action Research Arm Test), mais il n’est plus aussi facile à réaliser à partir d’un EDSS d’environ 7”, a expliqué le Dr Kamm.
La cognition est également sous-représentée dans l’EDSS, bien que de telles limitations, telles que les déficits de mémoire, d’attention ou de concentration, fassent partie des principaux symptômes de la SEP (prévalence de 43 à 65%). Le test de modalité numérique des symboles (SDMT) peut être considéré comme un complément pratique [6].
État de la pharmacothérapie
Les tableaux 1 et 2 donnent un aperçu des agents thérapeutiques de la SEP. Selon le professeur Heinrich Mattle, de la clinique universitaire de neurologie de l’Hôpital de l’Île à Berne, des études randomisées et contrôlées montrent que les lésions RM sont le principal moteur des déficits neurologiques – il faut donc les prévenir par des moyens thérapeutiques. Dans la SEP rémittente, les lésions se trouvent d’abord principalement dans la substance blanche, puis, dans la forme secondairement progressive, de plus en plus dans la substance grise [7]. Cela est alors déterminant pour le handicap à long terme, comme l’a illustré le professeur Nicola De Stefano, MD, Université de Sienne, dans son exposé précédent [8].
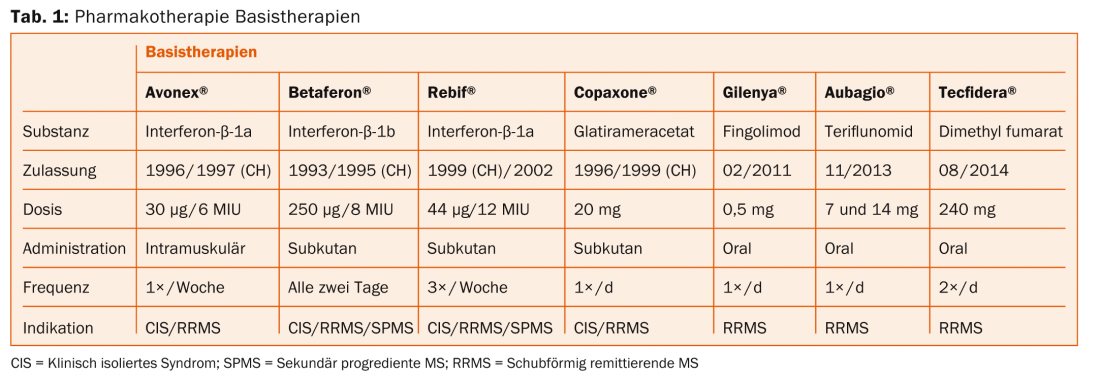
“Le traitement doit donc avoir lieu le plus tôt possible afin d’améliorer les résultats à long terme. Mais il faut aussi appliquer le principe “Primum nihil nocere” (“D’abord ne pas nuire”), c’est-à-dire trouver le meilleur équilibre entre l’effet et les effets secondaires”, a expliqué le professeur Mattle.
Médicaments injectables (Betaferon®, Rebif®, Avonex®, Copaxone®) : Nécessitent des injections régulières. Les effets secondaires possibles sont des réactions cutanées ou systémiques. Toutefois, il n’y a pas d’effets secondaires graves à long terme. “Nous ne connaissons pas encore les effets des nouveaux médicaments après 20 ans. C’est là que les agents injectables sont les plus étudiés”, a souligné le professeur Mattle. De plus, l’interféron β pégylé (peginterféron-β-1a) sera bientôt disponible sur le marché suisse (étude ADVANCE [9]) et nécessitera moins d’injections que les autres agents.
Fingolimod (Gilenya®) : L’administration se fait par voie orale, une fois par jour. La substance active peut provoquer des effets secondaires cardiaques (surveillance nécessaire lors de la première administration). Des œdèmes maculaires et des infections par le virus de l’herpès sont également possibles, mais rares. Le médicament est contre-indiqué en cas de grossesse. Chez les patients à risque de tumeurs cutanées malignes, la prudence ou une surveillance dermatologique régulière s’impose par mesure de sécurité (bien que les préoccupations à ce sujet ne soient pas clairement établies).
tériflunomide (Aubagio®) : L’administration se fait par voie orale, une fois par jour. Un monitoring des enzymes hépatiques toutes les deux semaines est nécessaire au cours du premier semestre, puis un monitoring toutes les huit semaines suffit. Les effets secondaires possibles sont les nausées, la diarrhée et l’alopécie. Une méthode de contraception fiable est une condition préalable au traitement.
le fumarate de diméthyle (Tecfidera®) : La substance active est administrée par voie orale deux fois par jour (ce qui peut limiter l’adhérence). Un bilan sanguin doit être effectué avant le début du traitement, après trois et six mois, puis tous les six à douze mois. Les effets secondaires possibles comprennent les bouffées vasomotrices, les douleurs abdominales et la diarrhée. Ici aussi, la contraception est une condition préalable.
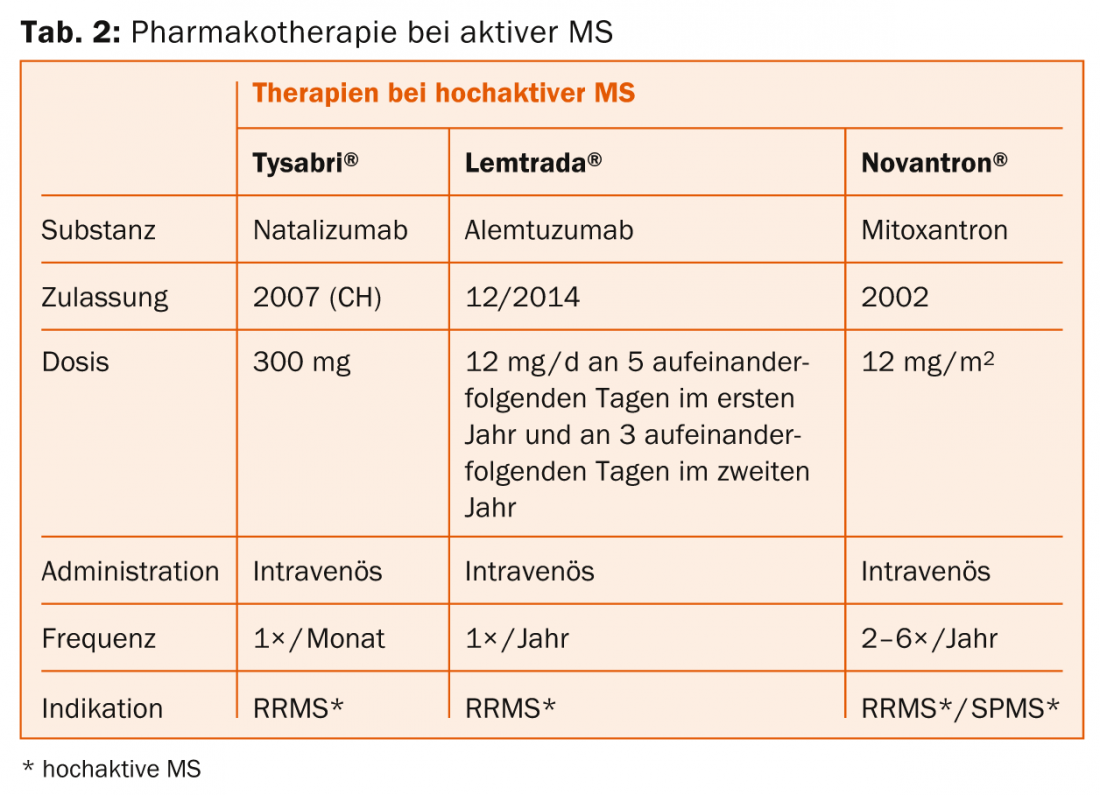
le natalizumab (Tysabri®) : La substance active est administrée commodément par perfusion une fois par mois. Un risque important est la leucoencéphalopathie multifocale progressive (LEMP) chez les patients infectés par le virus JC, d’où la nécessité de détecter les anticorps.
l’alemtuzumab (Lemtrada®) : La substance active est administrée confortablement deux fois en deux ans par série de perfusions. Des réactions graves à la perfusion peuvent se produire. Il convient également de mentionner le risque de développer d’autres maladies auto-immunes (entre autres de la thyroïde ou des reins) ou une thrombocytopénie immunitaire.
Application dans la pratique
Au moment de l’événement (janvier 2015), le schéma thérapeutique suivant était en vigueur à Berne pour la SEP rémittente :
Première ligne : en fonction des effets secondaires et de l’activité de la maladie, on utilise l’interféron-β, l’acétate de glatiramère, le tériflunomide, le fumarate de diméthyle ou le fingolimod. Dans le cas d’une SEP très active, le natalizumab et l’alemtuzumab peuvent être envisagés.
Deuxième ligne : en cas d’activité existante, on choisit entre le fumarate de diméthyle, le fingolimod, le natalizumab ou l’alemtuzumab (éventuellement aussi la mitoxantrone).
Troisième ligne : on dispose ici d’abord du natalizumab et de l’alemtuzumab (éventuellement aussi de la mitoxantrone). Les médicaments non autorisés en Suisse dans cette indication, comme le rituximab ou le daclizumab, ou encore l’autogreffe de cellules souches, sont des procédures expérimentales (y compris pour les formes très actives).
Contrairement à la forme dégénérative primaire, il existe davantage de données sur la SEP secondairement progressive, mais dans l’ensemble, les recherches sont moins avancées que pour la SEP rémittente. Pour la SEP secondaire progressive, Rebif® s’est révélé plus efficace chez les patients qui connaissent encore des poussées cliniques [10]. Betaferon® est également le plus bénéfique pour les patients présentant une activité de poussée et une progression significative du handicap (changement d’EDSS >1, deux ans avant l’entrée dans l’étude) [11].
Le Sativex® est un traitement symptomatique. Il est utilisé pour améliorer les symptômes chez les patients souffrant de spasticité modérée à sévère.
Source : Symposium sur la sclérose en plaques, 8 janvier 2015, Berne
Littérature :
- Ascherio A, et al : Vitamin D as an early predictor of multiple sclerosis activity and progression. JAMA Neurol 2014 Mar ; 71(3) : 306-314.
- Hartmann FJ, et al : Le polymorphisme IL2RA associé à la sclérose en plaques contrôle la production de GM-CSF dans les cellules TH humaines. Nat Commun 2014 Oct 3 ; 5 : 5056. doi : 10.1038/ncomms6056.
- Korolkiewicz RP, et al : Étude de phase Ib pour évaluer MOR103 dans la sclérose en plaques. NCT01517282. En ligne sur : https://clinicaltrials.gov/ct2/show/study/NCT01517282.
- Oxford Grice K, et al : Normes adultes pour un test Nine Hole Peg pour la dextérité des doigts disponible dans le commerce. Am J Occup Ther 2003 Sep-Oct ; 57(5) : 570-573.
- Heldner MR, et al : Coin rotation task : a valid test for manual dexterity in multiple sclerosis. Phys Ther 2014 Nov ; 94(11) : 1644-1651.
- Van Schependom J, et al : The Symbol Digit Modalities Test as sentinel test for cognitive impairment in multiple sclerosis. Eur J Neurol 2014 Sep ; 21(9) : 1219-1225, e71-72.
- Kutzelnigg A, et al : Démyélinisation corticale et lésion diffuse de la matière blanche dans la sclérose en plaques. Brain 2005 Nov ; 128(Pt 11) : 2705-2712.
- Filippi M, et al : Gray matter damage predicts the accumulation of disability 13 years later in MS. Neurology 2013 Nov 12 ; 81(20) : 1759-1767.
- Calabresi PA, et al : Pegylated interferon β-1a for relapsing-remitting multiple sclerosis (ADVANCE) : a randomised, phase 3, double-blind study. Lancet Neurol 2014 Jul ; 13(7) : 657-665.
- Secondary Progressive Efficacy Clinical Trial of Recombinant Interferon-Beta-1a in MS (SPECTRIMS) Study Group : Randomized controlled trial of interferon- beta-1a in secondary progressive MS : Clinical results. Neurology 2001 Jun 12 ; 56(11) : 1496-1504.
- Kappos L, et al : Interferon beta-1b in secondary progressive MS : a combined analysis of the two trials. Neurology 2004 Nov 23 ; 63(10) : 1779-1787.
InFo NEUROLOGIE & PSYCHIATRIE 2015 ; 13(2) : 36-39