Pour ralentir la progression des maladies rénales chroniques, il existe des mesures spécifiques à la maladie et des mesures non spécifiques. Le diagnostic de base de l’insuffisance rénale chronique comprend un bilan urinaire et une échographie des reins. Si la maladie rénale ne correspond pas clairement à une néphropathie hypertensive ou diabétique, il est généralement utile de consulter un spécialiste afin de viser un diagnostic précis et, le cas échéant, de permettre un traitement spécifique. La mesure non spécifique d’inhibition de la progression la mieux documentée est le traitement des patients protéinuriques par des IEC ou des ARA. Les autres mesures comprennent un contrôle adéquat de la pression artérielle, le traitement de l’acidose si nécessaire et une restriction de l’apport en sel. Les patients atteints de maladies rénales chroniques sont sensibles aux “seconds coups”. Les AINS, les laxatifs contenant des phosphates et les produits de contraste radiographiques iodés doivent donc être évités.
L’incidence et la prévalence des maladies rénales chroniques (MRC) n’ont cessé d’augmenter au cours des dernières décennies. D’un point de vue étiologique, l’IRC peut être causée par une grande variété de maladies rénales. Les néphropathies diabétiques et hypertensives sont les plus fréquentes et les plus responsables de l’augmentation de la prévalence de l’IRC. Outre le risque d’aboutir à une insuffisance rénale terminale, l’IRC entraîne une morbidité et une mortalité cardiovasculaires nettement plus élevées [1]. La maladie rénale chronique représente donc un fardeau important pour le système de santé. La plupart des patients atteints d’IRC sont suivis en premier lieu par un médecin généraliste. Il est donc important que les patients nécessitant un traitement spécifique soient identifiés à temps et que les mesures non spécifiques de réduction de la progression soient connues et appliquées.
Traitement spécifique à la maladie
Comme nous l’avons mentionné, un grand nombre de maladies rénales étiologiquement différentes peuvent conduire à l’IRC. Pour certains d’entre eux, il existe des traitements spécifiques (par exemple, immunosuppresseurs). Pour permettre un traitement causal, il faut donc s’efforcer de diagnostiquer la maladie de base. Un bon triage au cabinet du médecin généraliste est essentiel pour que les patients souffrant de maladies rénales pouvant être traitées spécifiquement soient examinés en néphrologie. Les règles générales suivantes s’appliquent :
- L’analyse d’urine et l’échographie des reins font partie du diagnostic de base de tout patient présentant une diminution significative de la fonction rénale qui ne peut pas être expliquée par des causes prénatales et qui est rapidement réversible. L’échographie aide à exclure une cause post-rénale, peut être diagnostique dans les néphropathies kystiques et permet parfois de conclure à la chronicité ou à la réversibilité potentielle de la néphropathie sur la base de la taille des reins.
- Les patients atteints de néphropathie hypertensive sont généralement plus âgés, présentent une dégradation de la fonction rénale plutôt lentement progressive, n’ont généralement pas de protéinurie significative (tout au plus une “microalbuminurie”), un sédiment urinaire normal et ont généralement des antécédents d’hypertension de longue date avec d’autres lésions d’organes terminaux hypertendus. Une autre caractéristique typique de ces patients est une capacité d’autorégulation rénale limitée, avec des variations marquées de la créatinine sérique en fonction de l’hydratation et de la pression artérielle. Dans ce cas, il n’est souvent pas nécessaire de consulter un spécialiste chez les patients âgés.
- La néphropathie diabétique se caractérise typiquement par une albuminurie lentement progressive, suivie d’une baisse plus rapide du débit de filtration glomérulaire (DFG) par rapport à la néphropathie hypertensive. D’ici là, on trouve généralement d’autres complications microvasculaires (rétinopathie). En cas d’évolution atypique, il vaut la peine de rechercher des causes alternatives.
- Chez les patients qui n’entrent pas dans l’une des catégories ci-dessus, en particulier ceux qui présentent une protéinurie pertinente, un sédiment urinaire anormal ou une diminution rapide du DFG, une évaluation par biopsie rénale doit être envisagée et une orientation vers un néphrologue est généralement indiquée. Dans ce cas, il pourrait y avoir une cause sous-jacente pouvant être traitée spécifiquement (par exemple, vascularite ANCA, néphropathie membraneuse, néphropathie à IgA, etc.)
Facteurs de progression non spécifiques et leur traitement
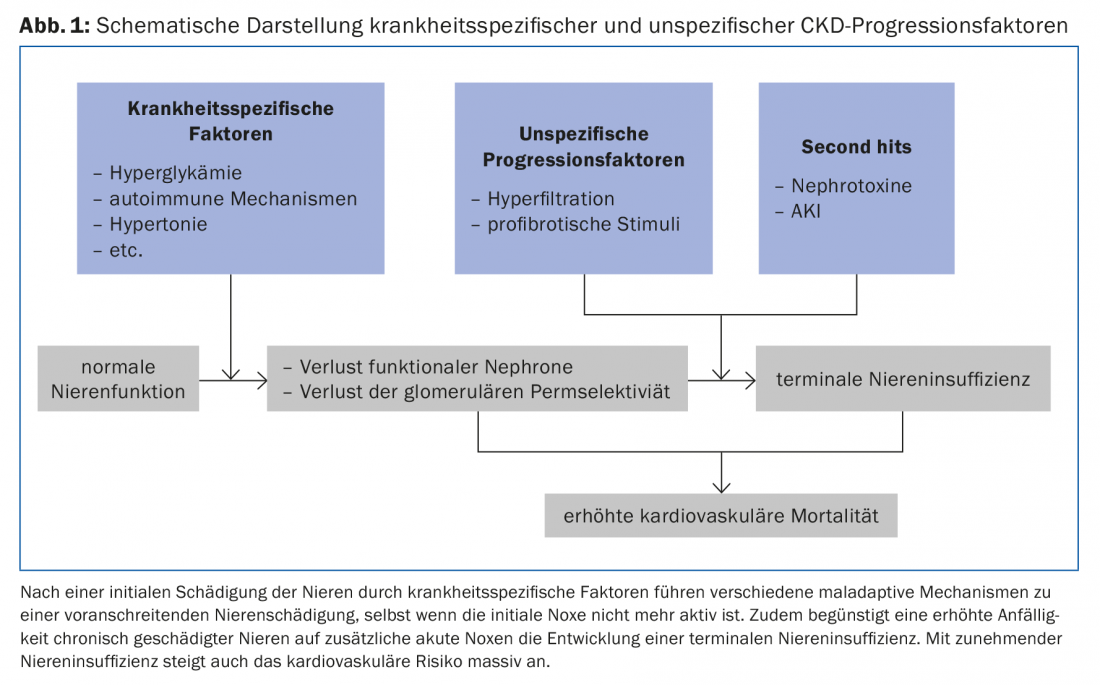
Lorsqu’une lésion rénale importante s’est produite, un certain nombre de mécanismes inadaptés contribuent à la poursuite de la détérioration de la fonction rénale, indépendamment de la maladie sous-jacente (Fig. 1).
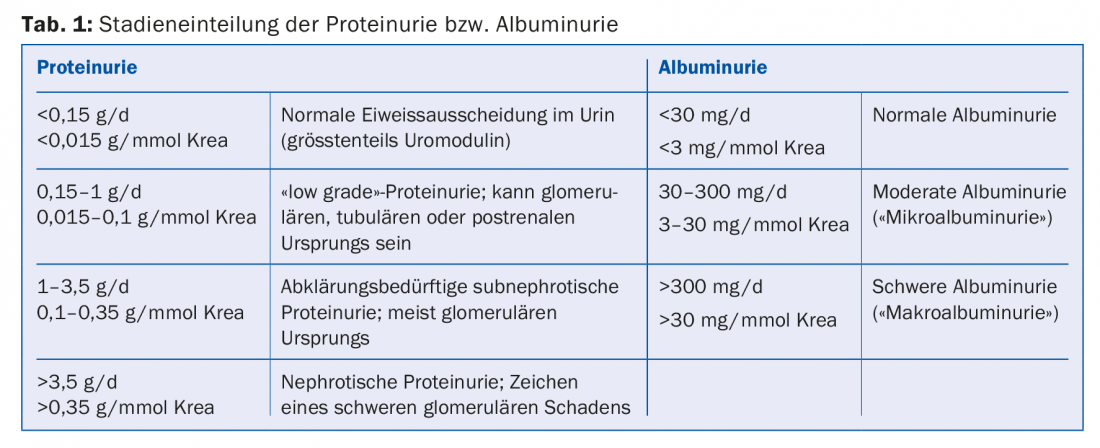
Protéinurie/albuminurie : La protéinurie ou l’albuminurie est généralement la conséquence d’un trouble de la perméabilité glomérulaire (encadré, tab. 1). Son ampleur est corrélée à la progression de l’insuffisance rénale [2]. Les interventions qui réduisent la protéinurie ou l’albuminurie entraînent également un ralentissement de la progression de l’IRC. Les inhibiteurs de l’ECA et les bloqueurs des récepteurs de l’angiotensine (ARA) réduisent la pression intraglomérulaire, l’hyperfiltration glomérulaire et l’albuminurie. Leur efficacité pour réduire la progression de l’IRC chez les patients atteints de protéinurie est bien établie, tant chez les diabétiques [3] que chez les non-diabétiques [4]. La posologie doit être augmentée jusqu’à ce que la protéinurie soit ramenée dans la plage cible (qui varie en fonction de la maladie rénale sous-jacente) ou que la dose soit limitée par des effets secondaires inacceptables (par ex. hypotension/vertiges orthostatiques) ou que la dose maximale de médicament autorisée soit atteinte. L’association d’un IEC et d’un ARA a été largement abandonnée.

Hypertension : l’hypertension artérielle peut entraîner une néphropathie hypertensive, mais aussi favoriser la progression d’autres maladies rénales, et doit donc être traitée de manière adéquate. Pour la néphroprotection, chez les patients sans albuminurie pathologiquement élevée, les valeurs cibles habituelles de <140/90 mmHg semblent suffisantes et les IEC ou les ARA ne sont pas clairement supérieurs aux autres médicaments. Chez les patients présentant une albuminurie sévère et probablement aussi chez les patients présentant une albuminurie modérée, il est raisonnable de viser des valeurs de <130/80 mmHg. Dans ce cas, il convient de supprimer en premier lieu un inhibiteur de l’ECA ou un ARA, avant d’ajouter d’autres antihypertenseurs si nécessaire [5]. Chez la plupart des patients dont la fonction rénale est nettement réduite, un contrôle adéquat de la pression artérielle ne peut être obtenu qu’avec l’utilisation d’un diurétique de l’anse. Il convient de noter que les valeurs cibles mentionnées s’appliquent en termes de néphroprotection et que la récente étude SPRINT a montré un bénéfice possible de valeurs cibles plus basses sur la mortalité globale [6].
L’acidose métabolique et sa correction : au fur et à mesure que l’insuffisance rénale progresse, la capacité d’excrétion acide des reins diminue et une acidose métabolique s’installe au fil du temps, ce qui a notamment des effets négatifs sur le métabolisme osseux et les muscles. Mais au-delà de ces effets extrarénaux, la charge acide semble également endommager les reins eux-mêmes [7]. Des études d’observation ont montré que le bicarbonate de sérum est inversement corrélé à la progression chez les patients atteints d’IRC. En cas d’acidose rénale, le traitement peut consister à réduire l’apport d’acide par l’alimentation (surtout dans les protéines animales) ou à neutraliser l’acide apporté par un traitement oral au bicarbonate de sodium. Quelques petites études randomisées ont montré un effet impressionnant de réduction de la progression pour cette intervention simple et peu coûteuse [6], mais les résultats d’études plus importantes sont encore attendus. Les inconvénients d’un traitement au bicarbonate sont le “pill burden” élevé (3 à 6 gélules de 500 mg de NaBic sont généralement nécessaires pour obtenir un effet suffisant) et l’apport de sodium qui en résulte.
l’alimentation et les interventions sur le mode de vie : Bien que l’influence positive de l’activité physique et de la recherche d’un poids “sain” (IMC 20-25) sur la progression de l’insuffisance rénale n’ait pas été formellement démontrée dans des études contrôlées, ces interventions peuvent avoir un effet bénéfique sur différents facteurs de risque cardiovasculaire, y compris la protéinurie.
Un régime pauvre en protéines a longtemps été préconisé comme mesure de réduction de l’hyperfiltration glomérulaire. Cependant, les données sur l’efficacité de la restriction protéique dans l’IRC ne sont pas tout à fait claires, et les études existantes datent d’avant l’utilisation généralisée des IEC et des ARA. En outre, une restriction protéique importante risque d’entraîner une malnutrition, dont le pronostic est très défavorable en cas de nécessité de dialyse ultérieure. Par conséquent, une forte restriction protéique n’est plus recommandée aujourd’hui, mais un apport excessif de protéines (par exemple sous forme de suppléments protéiques pour la musculation) doit être évité chez les patients atteints d’IRC.
Une consommation élevée de sel a été associée dans des études épidémiologiques à une augmentation de la pression artérielle, à une augmentation de la protéinurie et à une diminution plus rapide du DFG chez les insuffisants rénaux [8]. De plus, une consommation élevée de sel réduit fortement l’effet antiprotéinurique et l’effet pronostique positif des inhibiteurs de l’ECA et des ARA [9]. Une restriction de l’apport en sel à 5-6 g NaCl/jour est recommandée chez la plupart des patients souffrant d’insuffisance rénale chronique. Il n’est pas encore clair si une restriction supplémentaire est utile ou même éventuellement défavorable chez certains patients.
Le tabagisme a été associé dans plusieurs études de population non seulement à des événements cardiovasculaires, mais aussi à l’albuminurie et à l’insuffisance rénale [10]. De même, peu d’études d’intervention ont été menées sur l’influence de l’arrêt de la nicotine sur l’évolution de l’IRC, mais elles ont toutes été positives.
Approches thérapeutiques à l’efficacité incertaine ou non démontrée : de nombreuses études épidémiologiques montrent une association entre l’hyperuricémie et l’insuffisance rénale ainsi que le risque cardiovasculaire, bien que la causalité ne soit pas encore totalement établie [11]. Quelques petites études ont montré un effet favorable d’un traitement uricostatique par allopurinol sur l’évolution d’une insuffisance rénale chronique. Cependant, comme l’allopurinol n’est pas sans risque en termes d’effets secondaires, en particulier en cas de fonction rénale réduite, des études de plus grande envergure sont nécessaires pour recommander l’utilisation de l’allopurinol chez les patients atteints d’IRC et ne souffrant pas de la goutte et pour définir, le cas échéant, des taux cibles d’acide urique raisonnables. Le febuxostat, qui n’est pas éliminé par voie rénale et présente moins d’effets secondaires, pourrait jouer un rôle à l’avenir. L’hyperlipidémie a été considérée comme un facteur de progression possible de l’IRC sur la base de considérations physiopathologiques et de données épidémiologiques. Cependant, une évaluation de l’étude SHARP (la plus grande étude sur la réduction des lipides chez les patients atteints d’IRC) n’a pas permis de démontrer un effet positif de la simvastatine et de l’ézétimibe sur la progression de l’IRC [12]. Les statines ne semblent donc pas avoir d’effet pertinent sur la progression de l’IRC, mais elles sont utiles pour réduire le risque cardiovasculaire chez de nombreux patients atteints d’IRC. Les analogues actifs de la vitamine D semblent avoir un effet positif sur la protéinurie, mais un effet sur la progression de l’insuffisance rénale reste à démontrer [13].
“Second hits” et leur prévention : les reins pré-endommagés sont beaucoup plus sensibles aux toxines aiguës que les reins sains. Cela signifie que les patients souffrant d’insuffisance rénale chronique ont un risque massivement accru de subir une lésion rénale aiguë (acute kidney injury, AKI) [5], qui se rétablit souvent incomplètement [14].
Les anti-inflammatoires non stéroïdiens (AINS) font partie des médicaments les plus prescrits dans le monde. Chez les patients atteints d’insuffisance cardiaque sévère ou de fonction rénale réduite, l’inhibition de la synthèse intrarénale des prostaglandines peut entraîner une réduction critique de la perfusion glomérulaire et déclencher une IRA [15]. Les AINS sont donc contre-indiqués chez les patients dont la fonction rénale est fortement réduite et ne doivent être utilisés qu’avec retenue et à court terme chez les patients dont la fonction rénale est légèrement réduite [5].
Les agents de contraste radiographiques iodés peuvent entraîner des lésions rénales aiguës en cas d’altération préexistante de la fonction rénale, de déshydratation et d’insuffisance cardiaque décompensée. Les principales mesures de prévention de la néphropathie de contraste chez les patients atteints d’IRC sont les suivantes : (a) l’examen critique de l’indication et des conséquences thérapeutiques d’un examen, (b) envisager des méthodes d’examen alternatives en fonction de la question (par ex. échographie, scintigraphie), (c) si un examen avec un produit de contraste radiologique est inévitable : pré-hydrater, minimiser la quantité de produit de contraste appliquée et choisir un produit de contraste radiologique isoosmolaire [5,16].
Les laxatifs à base de phosphate sont parfois utilisés dans la préparation à la coloscopie comme alternative aux laxatifs à base de polyéthylène glycol. Une quantité considérable de phosphate est alors absorbée par l’intestin. Si la fonction rénale est normale, cette charge en phosphate peut être éliminée relativement rapidement par les reins. Cependant, lorsque la fonction rénale est altérée, des niveaux extrêmement élevés de phosphate sont atteints dans le sang et la concentration très élevée de phosphate qui en résulte dans l’urine primaire peut entraîner une néphropathie cristalline aiguë au phosphate de calcium [17]. Les laxatifs phosphatés sont donc contre-indiqués en cas de DFG <60 ml/min/1,73m2 ; les autres facteurs de risque de néphropathie aiguë à cristaux de phosphate sont la déplétion volémique, les diurétiques, les inhibiteurs de l’ECA et l’âge [17].
Littérature :
- Matsushita K, et al : Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts : a collaborative metaanalysis. Lancet 2010 ; 375 : 2073-2081.
- Gansevoort RT, et al : Chronic Kidney Disease Prognosis Consortium. Un DFG estimé plus bas et une albuminurie plus élevée sont associés à des résultats rénaux défavorables. A collaborative meta-analysis of general and high-risk population cohorts. Kidney Int. 2011;80(1) : 93-104.
- Kistler AD : Albuminurie chez le diabétique : gestion pratique. Pratique (Berne 1994). 2013;102(20) : 1229-35.
- Jafar TH, et al : Angiotensin-converting enzyme inhibitors and progression of nondiabetic renal disease. A meta-analysis of patient-level data. Ann Intern Med. 2001 ; 135(2) : 73-87.
- KDIGO 2012 Guide de pratique clinique pour l’évaluation et la prise en charge de la maladie rénale chronique. Kidney Int Suppl 2013;3(1). (www.kdigo.org/home/guidelines)
- SPRINT Research Group, Wright JT Jr, et al : A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015 Nov 26;373(22) : 2103-16
- Kovesdy CP : Acidose métabolique et maladie rénale : le traitement au bicarbonate ralentit-il la progression de l’IRC ? Nephrol Dial Transplant. 2012;27(8) : 3056-62.
- Meier P, et al : Sel et insuffisance rénale. Forum Médical Suisse 2014;14(04) : 50-53
- Lambers Heerspink HJ, et al : Modération of dietary sodium potentiates the renal and cardiovascular protective effects of angiotensin receptor blockers. Kidney Int. 2012;82(3) : 330-7.
- Orth SR, et al : Smoking : a risk factor for progression of chronic kidney disease and for cardiovascular morbidity and mortality in renal patients–absence of evidence or evidence of absence ? Clin J Am Soc Nephrol. 2008;3(1) : 226-36.
- Jalal DI, et al : Uric acid as a target of therapy in CKD. Am J Kidney Dis. 2013;61(1) : 134-46.
- Haynes R, et al. pour le groupe de collaboration SHARP : Effets de la réduction du cholestérol LDL sur la progression de la maladie rénale. J Am Soc Nephrol. 2014;25(8) : 1825-33.
- de Borst MH, et al : Active vitamin D treatment for reduction of residual proteinuria : a systematic review. J Am Soc Nephrol. 2013;24(11) : 1863-71.
- Chawla LS, et. al : Acute kidney injury and chronic kidney disease as interconnected syndromes. N Engl J Med. 2014;371(1) : 58-66.
- Harirforoosh S, et al : Renal adverse effects of nonsteroidal anti-inflammatory drugs. Expert Opin Drug Saf. 2009;8(6) : 669-81.
- KDIGO 2012 Guide de pratique clinique pour les lésions aiguës du rein. Kidney Int Suppl 2012;2(1). (www.kdigo.org/home/guidelines)
- Markowitz GS, et. al : Vers l’incidence de la néphropathie phosphatée aiguë. J Am Soc Nephrol. 2007;18(12) : 3020-2.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(12) : 35-38