En réunissant des domaines de recherche qui étaient jusqu’à présent indépendants les uns des autres, comme les neurosciences, le métabolisme et la diabétologie, ainsi que la psychologie, les connaissances augmentent également pour des maladies aussi complexes que l’obésité humaine. Le Dr Olivia M Farr et le Pr Christos S Mantzoros de la Harvard Medical School travaillent d’arrache-pied pour élucider les voies de communication entre le cerveau et les tissus adipeux. À Munich, lors du 52e Congrès européen des diabétologues (EASD), ils ont montré ce que l’on sait déjà.
Le cerveau reçoit en permanence des signaux de tous les organes impliqués dans le métabolisme. Il traite les informations et donne à son tour des ordres à toutes les cellules métaboliquement actives dans le but d’établir et de maintenir l’homéostasie. Jusqu’à présent, on ne sait que de manière cryptique quelles sont les centrales de commutation du cerveau qui contrôlent notre métabolisme afin de l’adapter de manière optimale à notre environnement. “Le cerveau intègre des informations provenant de l’intérieur et de l’extérieur, nous voulons savoir où se trouvent exactement les points de commutation”, a expliqué le professeur Christos S Mantzoros de la Harvard Medical School lors du Congrès européen sur le diabète à Munich (fig. 1).
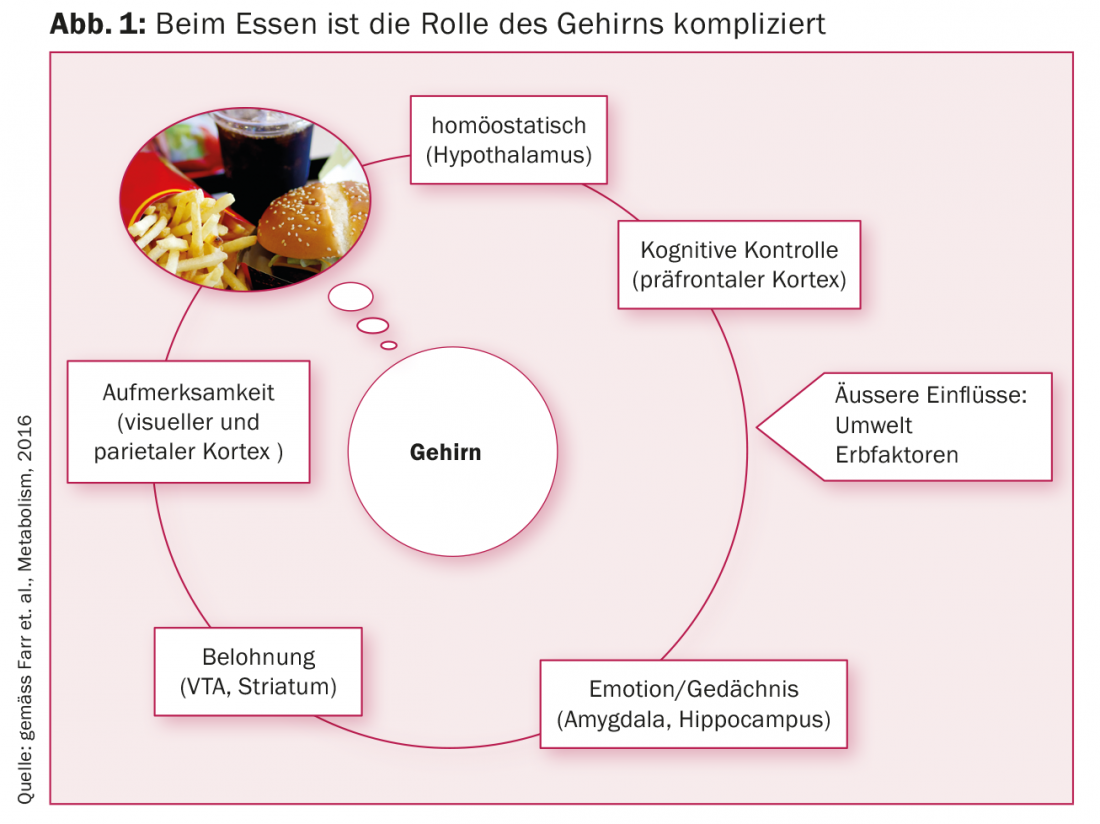
Nous mangeons parce qu’il y a quelque chose à manger
L’une des explications de l’épidémie d’obésité actuelle est très simple, à savoir que nous mangeons rarement à notre faim, mais parce que cela nous fait du bien, que c’est bon et que l’offre est si grande. La raison pour laquelle certaines personnes restent malgré tout minces alors que d’autres deviennent obèses est la grande boîte noire. Selon le Dr Farr et le Pr Mantzoros, les principaux acteurs sont les adipocytes et certains centres cérébraux. “L’effet de récompense des bons aliments rassasiants est comparable à celui de la cocaïne”, a souligné le Dr Farr (fig. 2).

Le tissu adipeux abdominal n’est pas seulement responsable du stockage des triglycérides. Il régule également les processus métaboliques et inflammatoires de multiples façons, qui vont bien au-delà du stockage de l’énergie sous forme de graisse. Les effets sur le système cardiovasculaire, la sensibilité à l’insuline et la sécrétion d’insuline sont connus. Si l’échange de signaux entre le système nerveux central et le tissu adipeux est déréglé par des influences internes et/ou externes, il dérive vers un dysfonctionnement et un cercle vicieux s’installe [1].
La leptine et le cerveau
Le professeur Mantzoros et son groupe de travail s’intéressent tout particulièrement aux messagers leptine, irisine et adiponectine des adipocytes, mais la ghréline, l’insuline et la PYY font également l’objet d’une attention particulière. À l’aide de l’imagerie par résonance magnétique fonctionnelle (IRMf), ils étudient à Harvard, chez l’animal et chez l’homme, les régions du cerveau qui “s’allument” lorsque, par exemple, des aliments appétissants sont présentés. Le Dr Olivia M Farr a souligné que le cerveau complexe de l’homme est difficilement comparable à celui des autres mammifères. L’un des problèmes fondamentaux de l’épidémie d’obésité actuelle du point de vue neuropsychologique est que les aliments gras et hautement caloriques sont perçus comme très désirables et disponibles presque partout, a expliqué le Dr Farr.
“Où naît la convoitise, comment sont répartis les récepteurs de la leptine, que se passe-t-il lorsque nous donnons de la leptine recombinante ?”, telles sont les questions actuelles autour de la leptine. La fonction de base de cette prohormone est de signaler au cerveau quand les réserves d’énergie sont suffisamment remplies. Si l’hormone ne peut pas être produite en raison d’une modification du patrimoine génétique, le cerveau ne reçoit pas le signal de satiété. En conséquence, la consommation de nourriture est débridée, ce qui entraîne un surpoids extrême. La leptine recombinante ne peut pas être utilisée pour le traitement de l’obésité, mais elle constitue une option pour la lipodystrophie liée au VIH. Il s’agit là d’un premier résultat cliniquement pertinent obtenu à Harvard [2].
Mangeurs émotionnels
Dans leur quête des récepteurs de la leptine et de la manière dont ils pourraient être influencés, les chercheurs de Harvard ont notamment étudié la lorcasérine. Le professeur Mantzoros a expliqué que cet agoniste des récepteurs de la sérotonine 5-hydroxytryptamine 2c permettrait de traiter efficacement les patients obèses qui mangent principalement pour des raisons émotionnelles et/ou comme récompense. Il crée une sensation de satiété et freine l’absorption de calories. L’IRMf a montré une activité réduite dans le cortex pariétal et visuel, ainsi que dans l’insula et l’amygdale. Les zones qui répondent fortement aux offres alimentaires chez les mangeurs émotionnels [3].

Les régions du cerveau responsables de la récompense et impliquées dans le comportement alimentaire présentent également une structure divergente par rapport aux personnes de poids normal. Des modifications des neurotransmetteurs dans le cerveau sont également associées au surpoids et à l’obésité. Concrètement, le système des opioïdes est différent de celui des personnes de poids normal. Dans cette mesure, on spécule sur le fait de savoir si le surpoids et l’obésité sont comparables à des maladies de dépendance, à des envies excessives et à un manque de contrôle de soi, ainsi qu’au besoin de consommer des quantités de nourriture toujours plus importantes. C’est ce que des chercheurs finlandais ont pu démontrer et publier dans le “Journal of Neuroscience” [4]. L’objet de la recherche sera maintenant de déterminer si ces modifications résultent d’une consommation alimentaire incontrôlée ou si elles sont dues à une prédisposition génétique.
Le glucagon et le cerveau
Pourquoi les patients diabétiques qui prennent du liraglutide, un analogue du glucagon-like peptide, perdent-ils du poids ? Cette question a également été étudiée à Harvard. Le liraglutide active le récepteur GLP-1, qui est impliqué dans la régulation de l’appétit, et active dans le cerveau des centres qui conduisent à la sensation de satiété. De ce fait, les personnes traitées mangent moins et perdent du poids. De plus, le liraglutide stimule la sécrétion d’insuline et diminue la sécrétion de glucagon, ce qui entraîne une réduction de la glycémie postprandiale et à jeun [5].
Le professeur Matthias H. Tschöp et son groupe de travail de l’Institut Helmholtz sur le diabète et l’obésité à Munich ont également entrepris d’analyser plus en détail le rôle du cerveau dans l’équilibre glycémique. Leur conclusion, publiée dans la revue scientifique “Nature”, est que la régulation normale de la glycémie dépend d’un partenariat entre les cellules pancréatiques productrices d’insuline d’une part et les circuits neuronaux de l’hypothalamus et d’autres régions du cerveau d’autre part [6]. Selon le nouveau modèle, la leptine active le système de régulation dans le cerveau, qui stimule ensuite l’utilisation du glucose – également par le biais d’autres hormones indépendantes de l’insuline. Ceux-ci contribuent au métabolisme du sucre de manière similaire à l’insuline. Pour que le diabète de type 2 se déclare, les deux systèmes doivent être perturbés simultanément.
Les scientifiques ont également montré que les astrocytes réagissent à la leptine. Celui-ci est un facteur important de la sensation de satiété. Comme il a été démontré que la leptine et l’insuline ont toutes deux une influence sur les astrocytes, les chercheurs proposent de développer un nouveau modèle qui, outre les cellules nerveuses, prendrait également en compte les astrocytes en tant que vis de réglage du métabolisme et de la sensation de faim. Ils espèrent que l’image plus détaillée qui en résultera ouvrira de nouvelles perspectives pour le développement de médicaments.
Source : 52e réunion annuelle de l’EASD, 12-16 septembre 2016, Munich
Littérature :
- Farr OM, et al. : Régulation de l’alimentation par le système nerveux central : les enseignements de l’imagerie cérébrale humaine. Métabolisme . 2016 mai ; 65(5) : 699-713.
- Farr OM, et al. : Leptin applications in 2015 : what have we learned about leptin and obesity ? Curr Opin Endocrinol Diabetes Obes. 2015 Oct ; 22(5) : 353-9.
- Farr OM, et al : Lorcaserin Administration Decreases Activation of Brain Centers in Response to Food Cues and These Emotion- and Salience-Related Changes Correlate With Weight Loss Effects : A 4-Week-Long Randomized, Placebo-Controlled, Double-Blind Clinical Trial. Diabète . 2016 Oct ; 65(10) : 2943-53.
- Karlsson H K, et al : L’obésité est associée à une diminution de la disponibilité des récepteurs μ-opioïdes mais non vieillis de la dopamine D2 dans le cerveau. The Journal of Neuroscience, 4 mars 2015, 35(9) : 3959-3965.
- Farr OM, et al. : Les récepteurs du GLP-1 existent dans le cortex pariétal, l’hypothalamus et la médulla du cerveau humain et l’analogue du GLP-1, le liraglutide, altère l’activité cérébrale liée à des repères alimentaires très importants chez les individus atteints de diabète : un essai croisé, randomisé et contrôlé par placebo. Diabetologia. 2016 May ; 59(5) : 954-65.
- Caceres, C. et al. : (2016) : Astrocytic insulin signaling couples brain glucose uptake with nutrient availability, Cell, DOI : 10.1016/j.cell.2016.07.028 www.cell.com/cell/fulltext/S0092-8674(16)30974-6.
CARDIOVASC 2016 ; 15(6) : 33-36