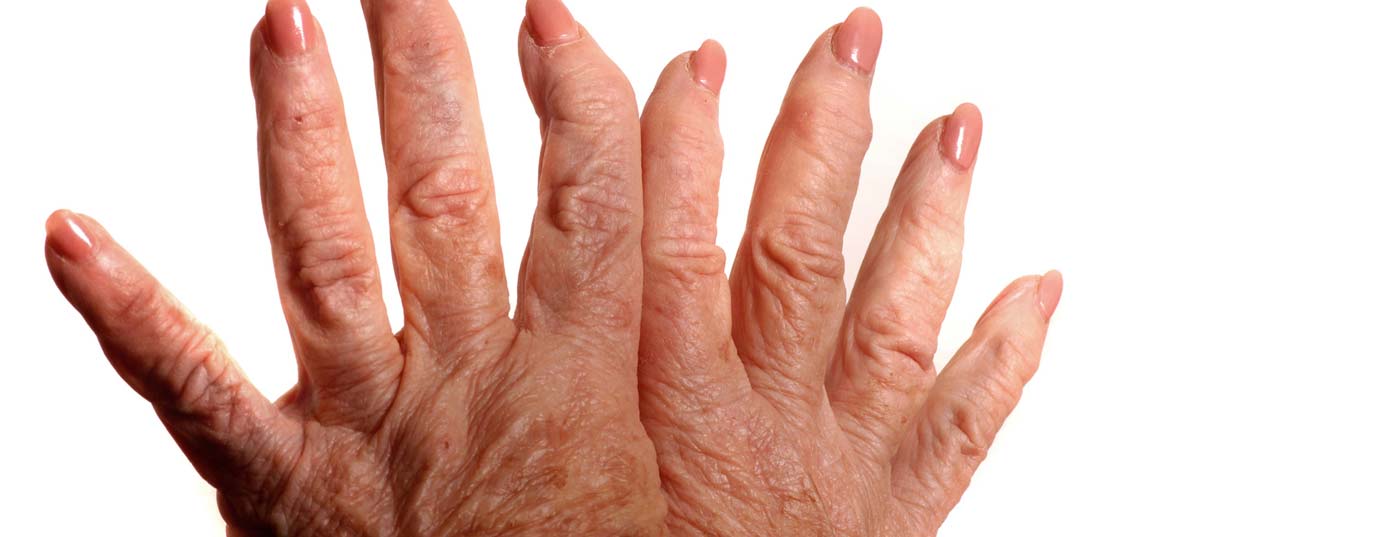
Une fois que les lésions articulaires dues à la polyarthrite rhumatoïde sont apparues, elles ne peuvent plus être inversées par des médicaments. Il est donc important d’utiliser des traitements de base le plus tôt possible. Si les substances traditionnelles ne fonctionnent pas suffisamment ou ne sont pas tolérées, les médicaments biologiques entrent en jeu. L’article suivant donne un aperçu des stratégies thérapeutiques.
Dans la polyarthrite rhumatoïde (PR), la destruction des articulations due à l’inflammation commence très tôt dans l’évolution de la maladie, généralement dès les premiers mois. Dans ce cas, les lésions articulaires ou arthroses secondaires (Fig. 1) sont irréversibles et ne peuvent donc plus être inversées par des médicaments. Plus les traitements de fond sont utilisés tôt, meilleure est la réponse.
Pour une bonne gestion, une collaboration interdisciplinaire avec la kinésithérapie, l’ergothérapie et parfois la chirurgie rhumatologique est indispensable. La coordination des mesures de traitement au sein de ces domaines doit être effectuée avec soin, en particulier dans le cadre de l’interaction entre le médecin de premier recours et le rhumatologue.

Diagnostic précoce
La rémission complète est aujourd’hui un objectif tout à fait réaliste et peut être atteinte plus facilement tôt que tard dans l’évolution. Comme le traitement de base doit être initié de manière optimale dans les trois premiers mois suivant le début des symptômes, un diagnostic précoce est essentiel. Au début de la maladie, il faut beaucoup d’expérience pour poser correctement le diagnostic à l’aide des symptômes typiques, du schéma d’atteinte articulaire et des examens complémentaires (laboratoire avec auto-anticorps, arthro-sonographie, radiographies).
Approches de traitement
Les médicaments de base : Les médicaments de base sont indispensables pour un contrôle adéquat de l’activité de la maladie dans la plupart des cas. À plus long terme, ils sont beaucoup moins toxiques que les glucocorticoïdes, à condition d’être utilisés de manière judicieuse. Ils ne se contentent pas de réduire les symptômes de l’inflammation, mais freinent et, dans l’idéal, stoppent le processus érosif-destructif. Avec les substances synthétiques traditionnelles, les effets commencent généralement avec une latence d’environ deux à trois mois.
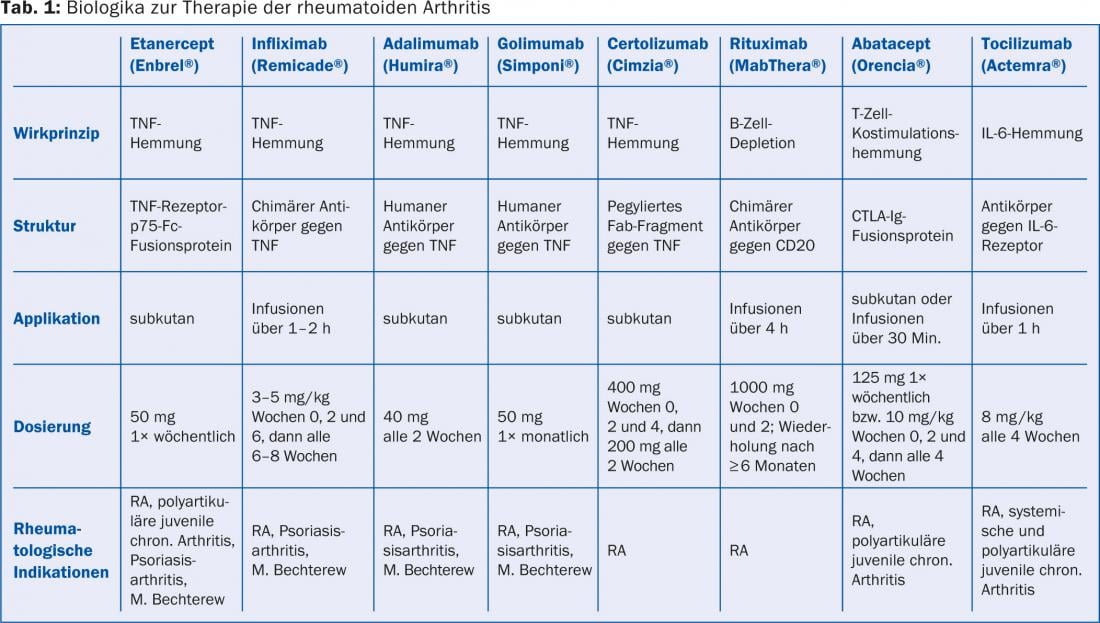
L’éventail des thérapies de base ne cesse de s’élargir. Les médicaments de base synthétiques traditionnels couramment utilisés sont le méthotrexate, le léflunomide (Arava® et génériques), la sulfasalazine (Salazopyrin® EN) et l’hydroxychloroquine (Plaquenil®). Depuis peu, on dispose également du tofacitinib (Xeljanz®), une préparation synthétique sélective qui inhibe des enzymes intracellulaires, à savoir les kinases Janus. Il est utilisé par voie perorale avec ou sans les médicaments de base traditionnels (par exemple le méthotrexate). Il existe également les médicaments biologiques (tableau 1), qui ont entraîné une véritable révolution dans le traitement de la PR au cours des 15 dernières années : Il est aujourd’hui possible de trouver un médicament efficace et bien toléré pour la plupart des patients, mais des combinaisons sont souvent nécessaires. Atteindre la rémission est aujourd’hui un objectif tout à fait réaliste.
L’adaptation du traitement aux besoins individuels des patients est exigeante. Elle demande beaucoup d’expérience. Le traitement doit donc toujours être effectué en collaboration avec un spécialiste en rhumatologie.
Le méthotrexate est généralement le premier choix, mais il peut parfaitement être administré en association avec, par exemple, l’hydroxychloroquine, le léflunomide ou des médicaments biologiques (combinaisons de deux médicaments). Des combinaisons de trois ou même de quatre sont également possibles. Les différents mécanismes d’action des substances individuelles produisent un effet additif et parfois même synergique, ce qui permet de réduire le dosage des substances individuelles (moins d’effets secondaires). Les thérapies combinées nécessitent beaucoup d’expérience, notamment en matière de suivi.
Le méthotrexate, le léflunomide, le tofacitinib et tous les médicaments biologiques ont un effet immunosuppresseur. Afin de ne pas augmenter excessivement le risque d’infection, les thérapies combinées ne doivent pas contenir plus de deux de ces immunosuppresseurs ou plus d’un médicament biologique. Des doses élevées de stéroïdes sont également à éviter. Il est indispensable d’instruire le patient de se manifester rapidement en cas de symptômes suspects d’infection et d’arrêter un éventuel traitement biologique. Si une suspicion d’infection est confirmée par une augmentation de la CRP, une hospitalisation immédiate s’impose si le foyer infectieux reste incertain ou si une antibiothérapie parentérale ou une surveillance est nécessaire.
Les médicaments biologiques interviennent spécifiquement dans le processus inflammatoire au niveau moléculaire. Une inhibition du TNF (inhibiteurs du TNF) ou de la costimulation des cellules T (abatacept), une réduction de l’activité de l’interleukine-6 (tocilizumab) et une déplétion des cellules B (rituximab) sont possibles. C’est avec les inhibiteurs du TNF que l’on dispose de la plus longue expérience. Cliniquement, ils sont à peine plus efficaces en monothérapie que le méthotrexate, mais leur action est beaucoup plus rapide : l’activité inflammatoire systémique (humorale) est supprimée en deux jours seulement, ce qui se traduit souvent par une amélioration soudaine des symptômes généraux (fatigue, lassitude et inappétence).
L’effet antiérosif des inhibiteurs du TNF est clairement supérieur à celui du méthotrexate. On peut en outre très bien les combiner avec des médicaments de base synthétiques et notamment le méthotrexate, ce qui entraîne en moyenne un effet clinique et antisocial encore meilleur.
Les inhibiteurs du TNF sont injectés par voie sous-cutanée ou perfusés par voie intraveineuse. Ils sont généralement bien tolérés. Les principaux effets secondaires sont des réactions cutanées au site d’injection ou des réactions à la perfusion. Le risque d’infection est environ doublé sous inhibition du TNF et des infections opportunistes sont possibles, en particulier avec des agents pathogènes intracellulaires. Comme il peut y avoir des réactivations de la tuberculose, un dépistage préalable de la tuberculose est nécessaire. Les vaccinations contre le pneumocoque et la grippe annuelle sont utiles. Les éventuelles portes d’entrée telles que la périodontite ou les lésions cutanées (y compris les mycoses) doivent être corrigées avant le début du traitement.
Après l’échec d’un traitement de fond classique, l’abatacept et le tocilizumab peuvent être envisagés à la place des inhibiteurs du TNF. Une autre indication de ces deux substances ainsi que du rituximab est l’effet insuffisant d’un traitement anti-TNF. L’abatacept a un excellent profil de tolérance. De tous les agents biologiques, le tocilizumab est celui qui supprime le plus l’activité inflammatoire systémique (humorale). Le rituximab présente l’avantage de ne pas nécessiter de cycles de traitement plus fréquents que six mois, et il est plus efficace chez les patients positifs pour le facteur rhumatoïde et les anticorps anti-CCP. L’abatacept, le tocilizumab et le rituximab font l’objet de précautions similaires à celles des inhibiteurs du TNF, mais les infections opportunistes sont moins fréquentes. A noter : Une augmentation de la CRP liée à une infection peut être inhibée par le tocilizumab (CAVE sous-estimation de la sévérité de l’infection).
Les médicaments biologiques sont coûteux en raison de leur fabrication complexe, c’est pourquoi ils ne sont autorisés que lorsqu’un traitement préalable avec des substances traditionnelles s’est avéré insuffisant. Une garantie de prise en charge des frais doit être obtenue au préalable auprès de la caisse d’assurance maladie.
Glucocorticoïdes : les stéroïdes ne sont indiqués qu’à court terme, en attendant l’effet des médicaments de base, et à long terme, à faible dose (par exemple, prednisone ≤ 7,5 mg/j), lorsque les traitements de base ne sont pas suffisamment efficaces. Depuis peu, une forme à libération prolongée de prednisone (Lodotra®) est disponible. Elle est prise avant le coucher et libère la prednisone avec un délai de plusieurs heures, ce qui lui permet d’être pleinement efficace dès le matin au lever. L’effet anti-inflammatoire rapide et puissant incite certes à utiliser les glucocorticoïdes à des doses plus élevées et sur une plus longue durée. Cependant, la monothérapie par glucocorticoïdes est aujourd’hui obsolète, car l’utilisation prolongée à des doses plus élevées est associée à une forte toxicité (p. ex. ostéoporose). Si certaines articulations sont dominées, des injections intra-articulaires de stéroïdes sont appropriées.
Monitoring pour l’optimisation du traitement
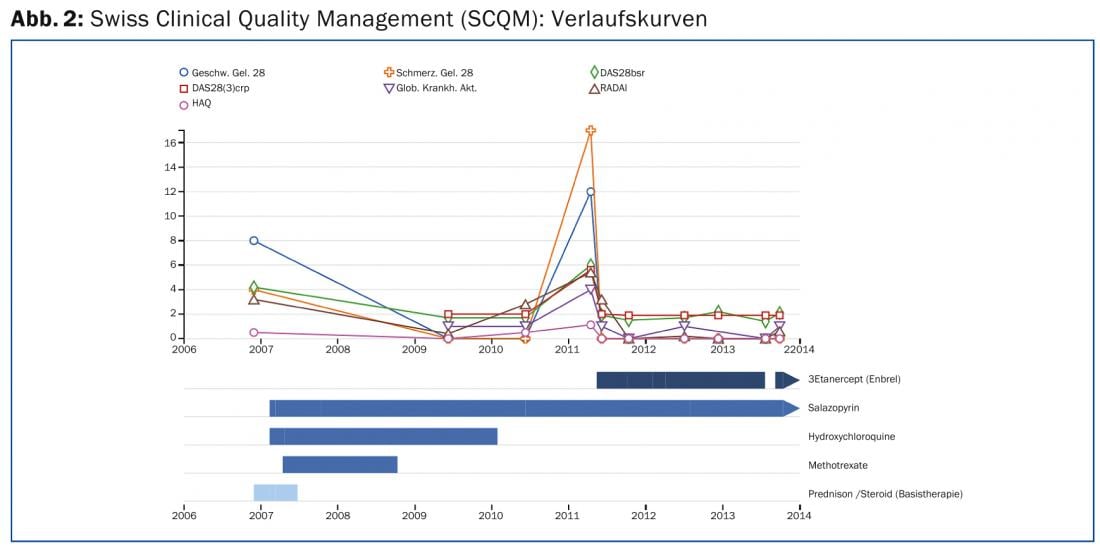
Dans tous les cas, il est nécessaire de surveiller et d’adapter continuellement les médicaments avec un spécialiste en rhumatologie, ce qui se fait de préférence dans le cadre d’une gestion de qualité. Le registre SCQM (Swiss Clinical Quality Management in Rheumatic Diseases) est disponible en Suisse à cette fin (www.scqm.ch). En tant que système d’amélioration des mesures, le SCQM est bien utilisable dans la pratique et fournit de précieuses données de registre “en vie réelle”. Des questionnaires remplis régulièrement par le patient et le rhumatologue, sur Internet ou sur papier, permettent de suivre de manière standardisée l’évolution de l’activité inflammatoire, des lésions articulaires et des effets de la maladie. Des examens radiologiques et de laboratoire font également partie de l’évaluation. Les évaluations centralisées permettent d’optimiser le traitement en permanence (figure 2). Les directives de la Société suisse de rhumatologie (www.rheuma-net.ch/Richtlinien) résument les mesures de surveillance nécessaires pour les différents médicaments de base.
Comorbidités
L’ostéoporose et l’artériosclérose sont les maladies associées les plus importantes. Les bisphosphonates sont utilisés sous traitement stéroïdien continu dès lors qu’il existe une ostéopénie modérée à sévère, et non pas seulement lorsqu’une ostéoporose est avérée (recommandations “Ostéoporose due aux stéroïdes” sur www.rheuma-net.ch/Richtlinien). Dans la PR, l’artériosclérose s’accélère. Les événements cardiovasculaires sont environ deux fois plus fréquents que dans la population normale, c’est pourquoi les facteurs de risque (diabète, tabagisme, hypertension et hypercholestérolémie) doivent être ciblés et traités de manière agressive.
Dr. med. Adrian Forster
Littérature :
- Schneider M, Krüger K : Arthrite rhumatoïde – diagnostic précoce et gestion de la maladie. Dtsch Ärztebl Int 2013 ; 110 : 477-484.
- Smolen JS, et al : EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs : 2013 update. Ann Rheum Dis 2014 ; 73 : 492-509.
- Bykerk VP, Schoels MM : Stratégies de traitement de l’arthrite rhumatoïde précoce. Curr Opin Rheumatol 2013 ; 25 : 375-383.
- Gramling A, O’Dell JR : Prise en charge initiale de l’arthrite rhumatoïde. Rheum Dis Clin North Am 2012 ; 38 : 311-325.
CONCLUSION POUR LA PRATIQUE
- Le fait de commencer le traitement de base le plus tôt possible est essentiel pour le pronostic. L’objectif du traitement est la rémission.
- Si les médicaments de base conventionnels ne sont pas assez efficaces, les médicaments biologiques ou le tofacitinib sont indiqués.
- La monothérapie par stéroïdes n’est plus d’actualité.
- Il est essentiel que le risque de maladies concomitantes telles que l’ostéoporose ou l’artériosclérose soit détecté et réduit à un stade précoce.
A RETENIR
- Un traitement de base instauré le plus tôt possible est crucial pour le pronostic. Le but du traitement est la rémission.
- Si les médicaments de base classiques ne sont pas suffisamment efficaces, les agents biologiques ou le tofacitinib sont indiqués.
- La monothérapie par des stéroïdes n’est plus d’actualité.
- Il est crucial d’appréhender le risque de comorbidités telles que l’ostéoporose ou l’artériosclérose et de le réduire.
PRATIQUE DU MÉDECIN DE FAMILLE 2014 ; 9(4) : 12-15