Lors du Congrès européen du cancer à Vienne, de nouvelles découvertes ont été faites sur l’étiologie possible du lymphome de Hodgkin. En outre, une comparaison européenne complète des soins du cancer a été présentée. Dans le domaine du mélanome métastatique, deux questions ont trouvé une réponse : Dans quelle mesure les patients présentant des facteurs de mauvais pronostic bénéficient-ils de l’immunothérapie combinée ? Et comment interpréter les données de survie actuelles de l’étude COMBI-v ?
Afin de mieux comprendre l’étiologie des lymphomes hodgkiniens (LH) chez les enfants et les jeunes adultes, une équipe anglaise a étudié 621 cas de LH enregistrés chez des patients âgés de 0 à 24 ans (années 1968-2003). 247 d’entre eux appartenaient au sous-type nodulaire-sclérosant, 105 au type mixte, 58 étaient des LH riches en lymphocytes (type offrant le meilleur résultat), 68 entraient dans la catégorie “Autres” et 143 dans la catégorie “Non spécifié”.
Dans l’ensemble, il y avait plus de patients HL de sexe masculin. C’est également le cas pour le sous-type HL nodulaire et sclérosant, avec 130 hommes contre 117 femmes. Il est intéressant de noter que le rapport entre les sexes change en fonction de l’âge : les femmes sont plus nombreuses dans le groupe des 20-24 ans (72 contre 55 personnes). Chez les jeunes hommes, les taux spécifiques à l’âge étaient de 14,26 (par million de personnes/an), tandis que la valeur correspondante chez les jeunes femmes était de 18,79.
Outre le sexe, la privation a également joué un rôle. Les chercheurs les ont définis à l’aide de quatre facteurs : Les ménages à forte densité de personnes, le chômage, l’absence de propriété, les ménages sans voiture. De manière remarquable, la privation était associée à des taux d’incidence plus faibles du sous-type nodulaire-scléreux. Chaque augmentation de 1 % du facteur “densité de personnes dans le ménage” a entraîné une réduction significative de 12 % du risque (RR 0,88 ; IC à 95 % 0,82-0,94). Une tendance inverse a été observée pour les types non spécifiés. Ici, le RR était de 1,17. Pour les autres sous-types, la privation n’a pas eu d’influence sur l’incidence.
Comment expliquer ces résultats ?
Les données sont révélatrices à plusieurs égards. D’une part, l’inversion du sex-ratio pourrait s’expliquer par des facteurs hormonaux jouant un rôle pendant la puberté féminine, notamment les œstrogènes. Il est donc possible que l’étiologie du sous-type nodulaire-sclérosant soit liée, entre autres facteurs, à des modifications hormonales féminines. Cela pourrait expliquer pourquoi l’incidence augmente chez les femmes après la puberté. De nombreux gènes sont directement (mais aussi indirectement) régulés par les hormones sexuelles.
De plus, l’incidence plus faible de ce sous-type dans les foyers surpeuplés pourrait indiquer un facteur étiologique environnemental. Là où les gens vivent proches les uns des autres, les agents infectieux sont plus nombreux. Les personnes exposées à différents agents pathogènes dès leur plus jeune âge et qui subissent de multiples infections peuvent développer un système immunitaire plus fort, capable de mieux réagir aux futures infections et aux cellules cancéreuses à l’âge adulte. C’est un avantage dans le domaine de l’HL. Selon cette théorie, les personnes génétiquement prédisposées au HL, qui vivent dans de grands espaces pendant l’enfance et subissent moins d’infections, seraient plus vulnérables au sous-type plus tard, car leur système immunitaire est moins développé. Selon les auteurs, l’inversion de la tendance pour les types non spécifiés est plus difficile à expliquer, mais il pourrait s’agir d’une coïncidence.
Soins aux patients atteints de cancer en Europe
EUROCARE, la plus grande étude de registre du cancer basée sur la population en Europe, est en cours depuis la fin des années 1990. De nouveaux résultats ayant une portée transnationale ont été présentés lors du congrès. Les données de plus de 10 millions de patients atteints de cancer âgés de plus de 15 ans, provenant de 29 pays européens et de 107 registres au total, ont été analysées, notamment en termes de survie à 5 ans. Celui-ci était corrigé des décès dus à des causes autres que le cancer et des différences d’âge. Les diagnostics jusqu’en 2007 ont été inclus.
Dans l’ensemble, les taux de survie sont faibles en Europe de l’Est, mais élevés en Europe du Nord et en Europe centrale. D’autres différences géographiques sont apparues, résumées dans le tableau 1 . Les différences les plus spectaculaires ont été observées dans la leucémie myéloïde et lymphoïde chronique (LMC/LCL), le lymphome folliculaire et le lymphome diffus à grandes cellules B et le myélome multiple. Dans le cas de la LMC, la survie moyenne à 5 ans était de 53%, mais il y avait une énorme variation dans les différents groupes d’âge. De tous les cancers hématologiques, c’est pour la LMC que les différences régionales étaient les plus importantes : 33,4% en Europe de l’Est contre 51-58% dans le reste de l’Europe. Des différences géographiques ont également été observées pour les cancers de mauvais pronostic tels que les cancers de l’ovaire, du poumon, du pancréas, de l’œsophage et de l’estomac, les tumeurs cérébrales et le lymphome de Hodgkin – mais elles étaient globalement un peu moins prononcées.
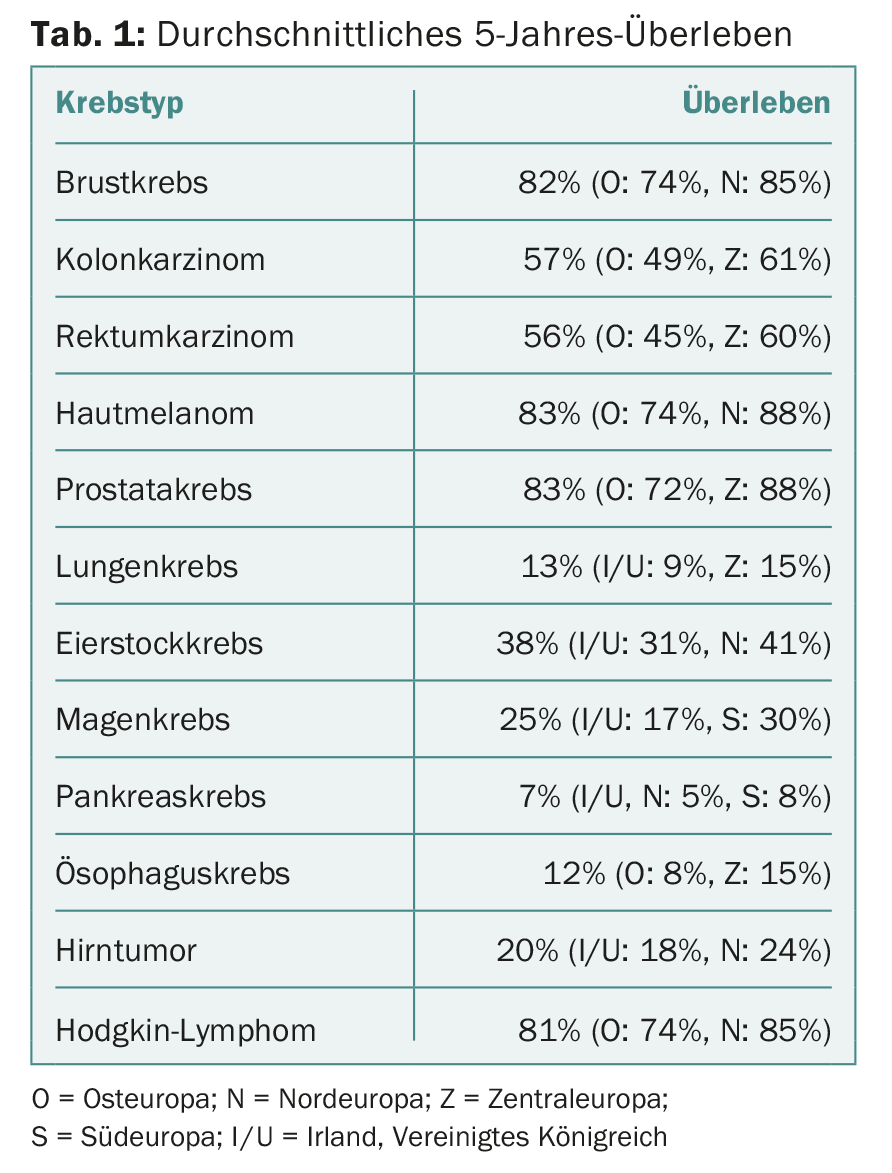
Les taux de survie à 5 ans ont augmenté dans toute l’Europe au cours de la période considérée, en particulier en Europe de l’Est. Concrètement, les taux ont augmenté par exemple pour les tumeurs du sein, du col de l’utérus, du foie, de la vésicule biliaire et de la tête et du cou (à l’exception du cancer du larynx). Les plus fortes augmentations entre 1999-2001 et 2005-2007 ont été observées pour la LMC (32-54%), le cancer de la prostate (73-82%) et le cancer rectal (52-58%). Il y a également eu une légère augmentation de la survie pour les mélanomes cutanés. Pour les cancers de l’œsophage, du pancréas, du pénis et des testicules, les taux sont restés stables.
Les taux de survie combinés à 5 ans de tous les cancers étaient positivement corrélés au produit intérieur brut et aux dépenses nationales totales de santé. Les pays ayant récemment connu une croissance plus élevée des deux paramètres ont également connu une augmentation plus importante des taux de survie. Cependant, ce n’était pas toujours le cas : des pays comme le Royaume-Uni et le Danemark auraient dû obtenir de meilleurs taux compte tenu de leurs dépenses de santé élevées.
Les variations géographiques s’expliquent notamment par les différences en termes d’effort diagnostique ou de qualité et par l’existence de programmes de dépistage nationaux (cancer de la prostate, du sein, colorectal). Outre le diagnostic précoce, l’accès à des traitements multidisciplinaires, une bonne qualité de soins, le mode de vie et le statut sanitaire et socio-économique de la population concernée jouent un rôle important pour la survie. Il reste à voir si les résultats entraîneront des efforts politiques concrets.
Les thérapies combinées pour le mélanome continuent de convaincre
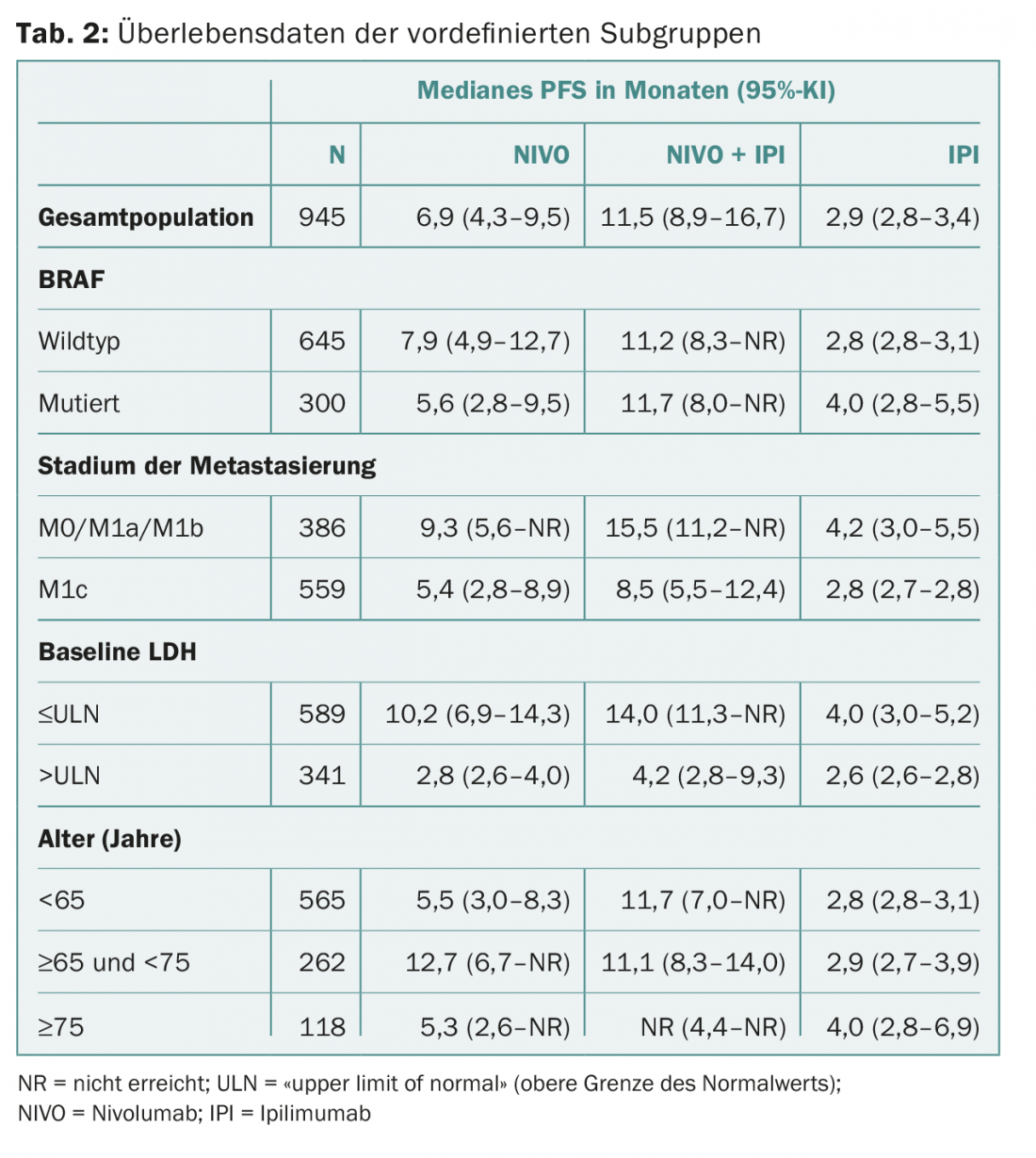
CheckMate 067 : les points de contrôle CTLA-4 et PD-1 sont utilisés par les cellules cancéreuses pour neutraliser la réponse immunitaire spécifique au cancer de l’organisme. Les inhibiteurs permettent de bloquer les points de contrôle, ce qui active le système immunitaire ou entraîne une augmentation de l’activité des lymphocytes T. Les inhibiteurs peuvent également être utilisés dans le traitement de l’hypertension. CheckMate 067 est une étude de phase III qui a comparé le nivolumab, un inhibiteur de point de contrôle PD-1, seul ou en association avec l’ipilimumab, un inhibiteur de point de contrôle CTLA-4, à l’ipilimumab en monothérapie. La population étudiée était composée de 945 patients atteints de mélanome avancé qui n’avaient pas été traités auparavant. L’association était significativement supérieure à l’ipilumumab en monothérapie en termes de survie sans progression (PFS) et de taux de réponse objective. Les résultats d’une analyse de sous-groupe pré-spécifiée ont été présentés au congrès ECCO/ESMO : La combinaison reste-t-elle supérieure indépendamment de l’âge, du statut génétique ou de la propagation de la tumeur ? Il était particulièrement intéressant de voir comment les patients présentant des facteurs pronostiques défavorables s’en sortaient. Les sous-groupes différaient en termes de métastases, de taux sériques de lactate déshydrogénase (LDH), de statut mutationnel BRAF et d’âge.
Dans les trois bras de traitement, les paramètres mentionnés étaient répartis de manière équivalente. La SSP a été de 11,5 mois (association) vs 2,9 mois (ipilimumab en monothérapie ; réduction significative du risque de 58%) vs 6,9 mois (nivolumab en monothérapie ; réduction significative du risque de 43%).
Les résultats pour les sous-groupes mentionnés sont présentés dans le tableau 2. Dans l’ensemble, la PFS a toujours été plus longue avec la combinaison. Il n’y avait pas non plus de différence dans le profil de sécurité (par rapport à la population totale).
Les auteurs concluent que la combinaison de nivolumab et d’ipilimumab est significativement supérieure aux monothérapies, même chez les patients présentant de mauvais facteurs pronostiques, et que son profil de sécurité est contrôlable. Dans la pratique, cela pourrait permettre à l’avenir une prise de décision plus rapide et plus simple concernant l’utilisation de la thérapie combinée. Surtout que les chercheurs ont délibérément étudié les sous-groupes les plus pertinents pour le clinicien. Savoir si certains patients ne bénéficient pas de la combinaison est important car, malgré l’euphorie, il ne faut pas oublier que les thérapies peuvent s’accompagner d’un nombre relativement important d’effets secondaires.
COMBI-v : dans cette étude de phase III, la combinaison de l’inhibiteur de la kinase BRAF dabrafenib et de l’inhibiteur de la MEK trametinib (bras 1) avec l’inhibiteur de BRAF vémurafénib (bras 2) comparé. La population de l’étude était composée de 704 patients atteints d’un mélanome métastatique non résécable de stade avancé IIIC/IV avec mutation BRAF V600E/K, qui n’avaient pas été traités auparavant. Selon les résultats déjà publiés en janvier 2015 dans le New England Journal of Medicine [1], le taux de survie globale, le critère d’évaluation principal, était de 72% à 12 mois dans le bras 1 et de 65% dans le bras 2 (HR 0,69 ; IC à 95% 0,53-0,89 ; p=0,005). Les taux d’effets secondaires étaient comparables dans les deux bras. En raison des résultats convaincants, l’étude a été arrêtée en juillet 2014. Cependant, comme les patients avaient l’option de rester sous leur traitement respectif, les chercheurs ont eu la possibilité de prolonger le suivi. Une mise à jour a été présentée lors du congrès, couvrant les données jusqu’au 13 mars 2015 :
- La médiane de survie globale était de 25,6 vs. 18 mois, ce qui correspond à une réduction significative du risque de mortalité de 34%.
- La médiane de la PFS était de 12,6 mois contre 7,3 mois, ce qui correspond à une réduction significative du risque de décès ou de progression de 39%.
- Après deux ans, 51 vs. 38% des patients étaient en vie.
- Le suivi prolongé n’a pas révélé de nouveaux effets secondaires surprenants.
- Une autre sous-analyse présentée au congrès a en outre montré que la qualité de vie s’était également améliorée de manière significative sous l’effet de la combinaison.
La mise à jour a donc confirmé en tous points les résultats convaincants de l’analyse publiée un peu plus de onze mois auparavant. L’UE a donc autorisé la combinaison dabrafenib-trametinib dans cette indication début septembre 2015.
Source : European Cancer Congress (18th ECCO, 40th ESMO), 25-29 septembre 2015, Vienne
Littérature :
- Robert C, et al : Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 2015 Jan 1 ; 372(1) : 30-39.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(11-12) : 32-34